基于网络药理学推测当归肉苁蓉配伍治疗功能性便秘的作用机制
宋蕊蕊
(河南科技大学第一附属医院消化内科,河南 洛阳 471003)
功能性便秘(Functional constipation,FC)是全球高发疾病,指肠道功能紊乱导致机体出现大便干结、排便难、次数减少或排便不尽等症状,属中医学“便秘”、“阳结”或“阴结”范畴。西医治疗存在易复发,副作用大,长期疗效一般等缺点。中医治疗功能性便秘历史悠久,方法多样,主张辨证施治,整体调节脏腑气血阴阳,祛邪不伤正,标本兼治[1]。当归与肉苁蓉是治疗功能性便秘常用方济川煎的主要组成药物,二者也是数据挖掘治疗便秘常用方的经典药物组合前三名[2]。当归-肉苁蓉药对温肾益精,润肠通便,可用于老年人、久病体虚、妇人产后、温病后期等功能性便秘患者,但其作用机制尚不明确。此外,FC发病原因复杂,与饮食、生活习惯、自主神经功能异常、药物或年龄等相关,给其作用机制探讨带来更大困难。
网络药理学结合药物、成分、作用靶点和疾病靶点信息,多角度、多方面探索药物和疾病之间的分子关联,从而更好的揭示药物治疗疾病的分子机制[3]。尤其是在中医药研究中,网络药理学与中医整体观不谋而合,从而探讨中药多成分、多靶点、多途径治疗疾病的方式。本文借助网络药理学方法,探讨当归肉苁蓉对FC的治疗作用及机制,为其临床应用提供理论依据,并为后期试验奠定基础。
1 材料与方法
1.1 当归-肉苁蓉化学成分、对应靶点和功能性便秘疾病靶点的筛选
基于TCMSP数据库(https://tcmspw.com/tcmsp.php)检索当归和肉苁蓉的化学成分,以口服生物利用度(oral bioavailability,OB)≥30%和类药性(Drug-like properties,DL)≥0.05作为条件,筛选当归和肉苁蓉的活性成分。基于TCMSP、STITCH(http://stitch.embl.de/)等数据库收集当归-肉苁蓉活性成分对应靶点,并于Uniport(https://www.uniprot.org /)数据库转换基因名,去重。
GeneCards数据库(http://www.genecards.org)检索“functional constipation”,获得FC疾病靶点。
1.2 药物-活性成分-靶点网络构建和生物信息学分析
采用Cytoscape 3.7.0软件进行“当归-肉苁蓉-活性成分-靶点网络”的构建,以度(degree)≥6为阈值筛选,得到“当归-肉苁蓉-活性成分-靶点网络”。DAVID数据库(https://david.ncifcrf.gov/)进行当归-肉苁蓉成分靶点的基因本体(Gene Ontology,GO)和京都基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析。
1.3 药物-活性成分-共有靶点网络构建
收集当归、肉苁蓉活性成分和FC疾病靶点的交集靶点,称共有靶点,Cytoscape 3.7.0软件构建“当归-肉苁蓉-活性成分-FC共有靶点网络”。
1.4 关键基因筛选和蛋白互作网络构建
于STRING数据库(https://string- db.org/)检索共有靶点,收集蛋白互作信息,CytoNCA插件基于点度中心性(Degree Centrality,DC)、接近中心性(Closeness Centrality,CC)、中介中心性(Betweenness Centrality,BC)筛选关键基因,进行关键基因的蛋白质互作网络(Protein-Protein Interaction Networks,PPI)构建[4]。
1.5 当归-肉苁蓉治疗FC的关键基因生物信息学分析
DAVID数据库进行当归-肉苁蓉治疗FC的关键基因的GO功能和KEGG通路富集分析,GO功能富集分析以P<0.01,count≥5为阈值,KEGG通路富集分析以P<0.01且count≥10为阈值。
2 结果
2.1 当归-肉苁蓉的活性成分收集
共检索到当归化学成分125个,肉苁蓉化学成分75个。其中,OB≥30%和DL≥0.05的当归活性成分25个,肉苁蓉13个。最终得到无重复且有相应靶标的活性成分39个,见表1。
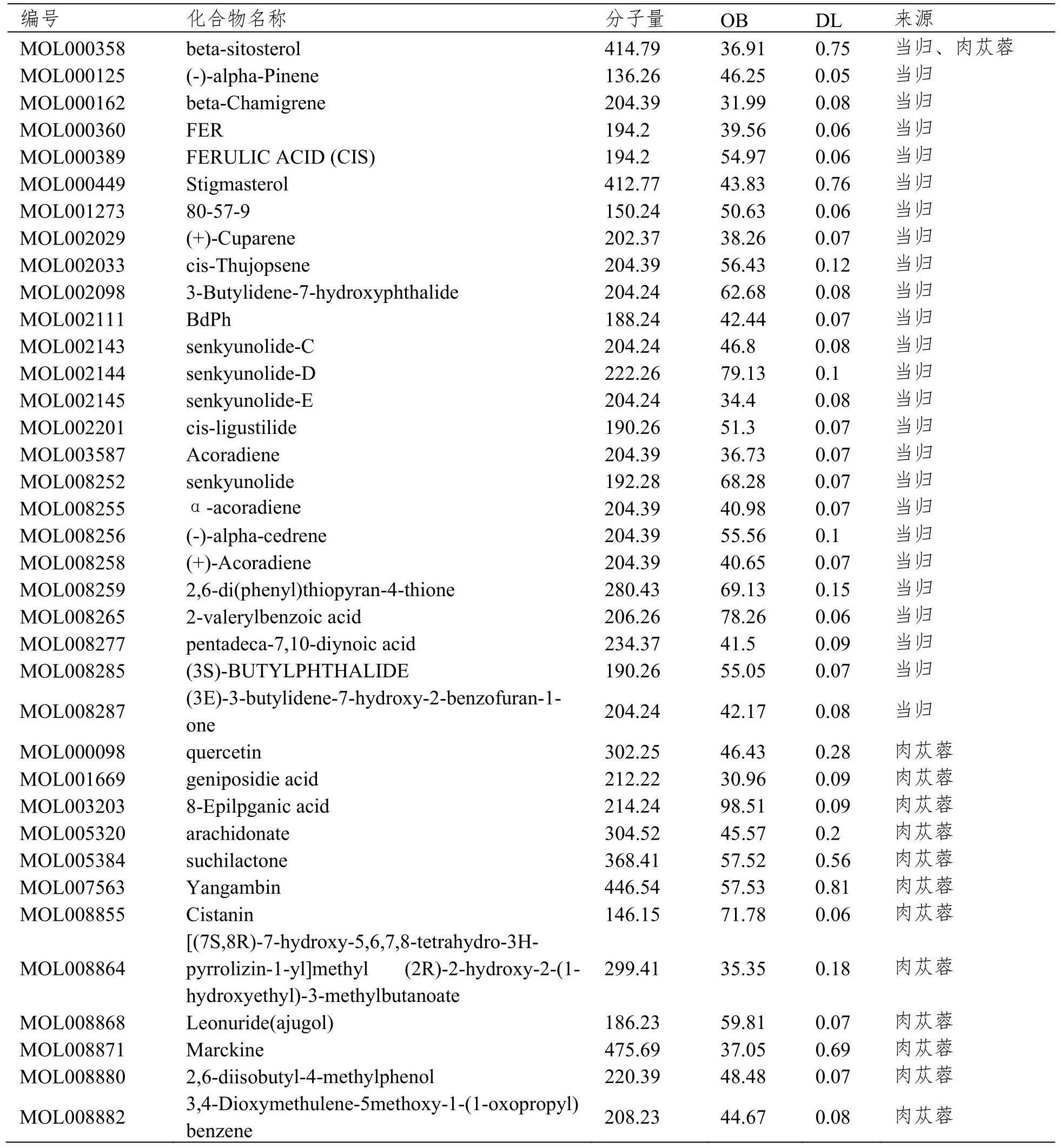
表1 当归和肉苁蓉的主要活性成分
2.2 药物活性成分靶点和FC疾病靶点的收集
数据库收集到当归活性成分相关靶点56个,肉苁蓉活性成分相关靶点143个,交集靶点16个。FC疾病靶点5199个,其中,Relevance score≥3的靶点为2428个。当归、肉苁蓉与FC三者交集靶点13个,当归-肉苁蓉药物靶点与FC疾病靶点交集靶点132个,见图1。
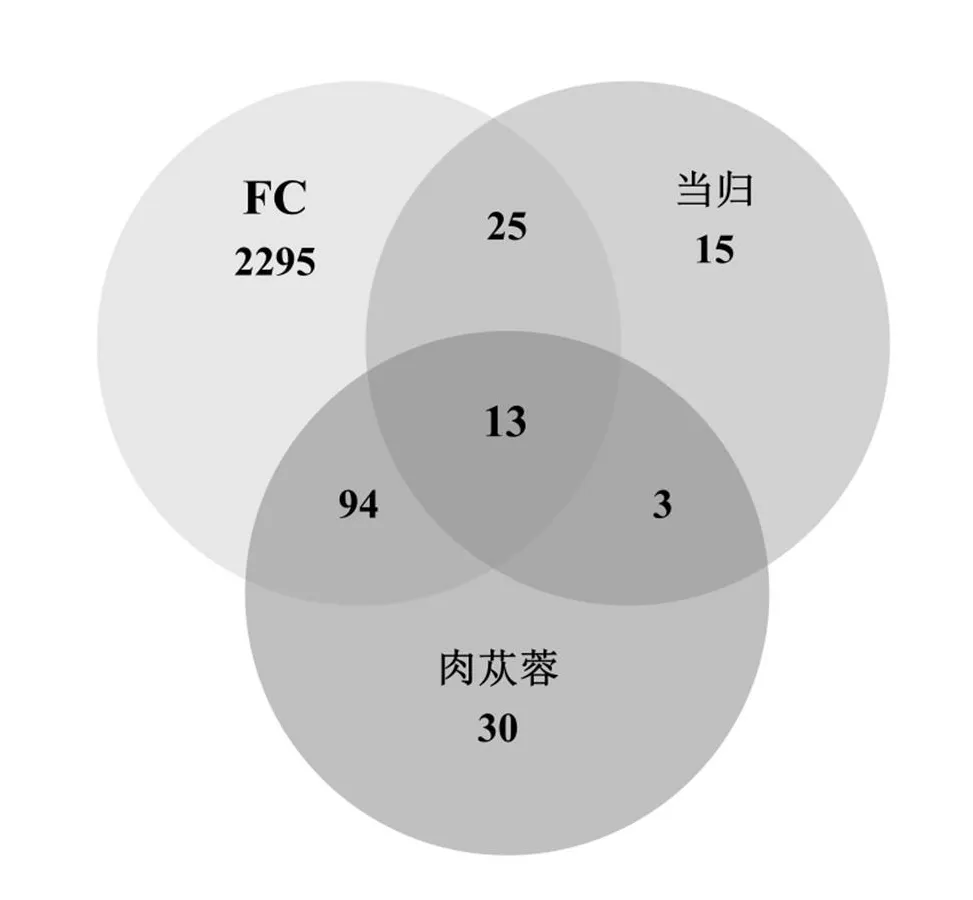
图1 药物与疾病靶点韦恩图
2.3 当归-肉苁蓉的药物成分-靶点网络和生物信息学分析
“当归-肉苁蓉-活性成分-靶点网络”包含276个节点和330条边。网络中,当归-肉苁蓉共有活性成分β-谷甾醇,肉苁蓉活性成分槲皮素,当归活性成分豆甾醇、阿魏酸、菖蒲二烯等degree值高,提示这些成分可能为当归-肉苁蓉配伍中的主要有效成分。
前列腺素内过氧化物合成酶(Prostaglandin G/H synthase and cyclooxygenase,PTGS2、PTGS1)、γ氨基丁酸A受体(Gamma-Aminobutyric Acid Type A Receptor Subunit Alpha1,GABRA1)、毒蕈碱型胆碱受体(Muscarinic Acetylcholine receptor,CHRM2、CHRM1、CHRM3)、去甲肾上腺素转运体基因(Sodium-dependent noradrenaline transporter,SLC6A2)、细胞肿瘤抗原p53(Cellular tumor antigen p53,TP53)、半胱氨酸蛋白酶(Caspase,CASP)和分裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)等靶点的degree值较高,提示这些靶点可能在当归-肉苁蓉配伍中起主要作用,网络中degree值排名前20的当归-肉苁蓉相关成分和靶点见表2。对当归-肉苁蓉的靶点富集分析结果显示,药对靶点的GO功能主要富集在细胞外空间、质膜组成、核质等细胞成分,酶结合、RNA聚合酶II转录因子活性、类固醇激素受体活性等分子功能,炎症反应、凋亡过程的负调控、血管收缩的正向调节等生物学过程,均与FC疾病机制相关,提示当归-肉苁蓉药对可用于FC等胃肠道疾病的治疗,见图2。
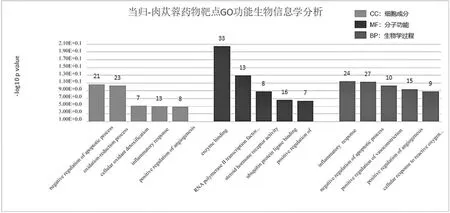
图2 当归-肉苁蓉药物靶点GO功能富集结果
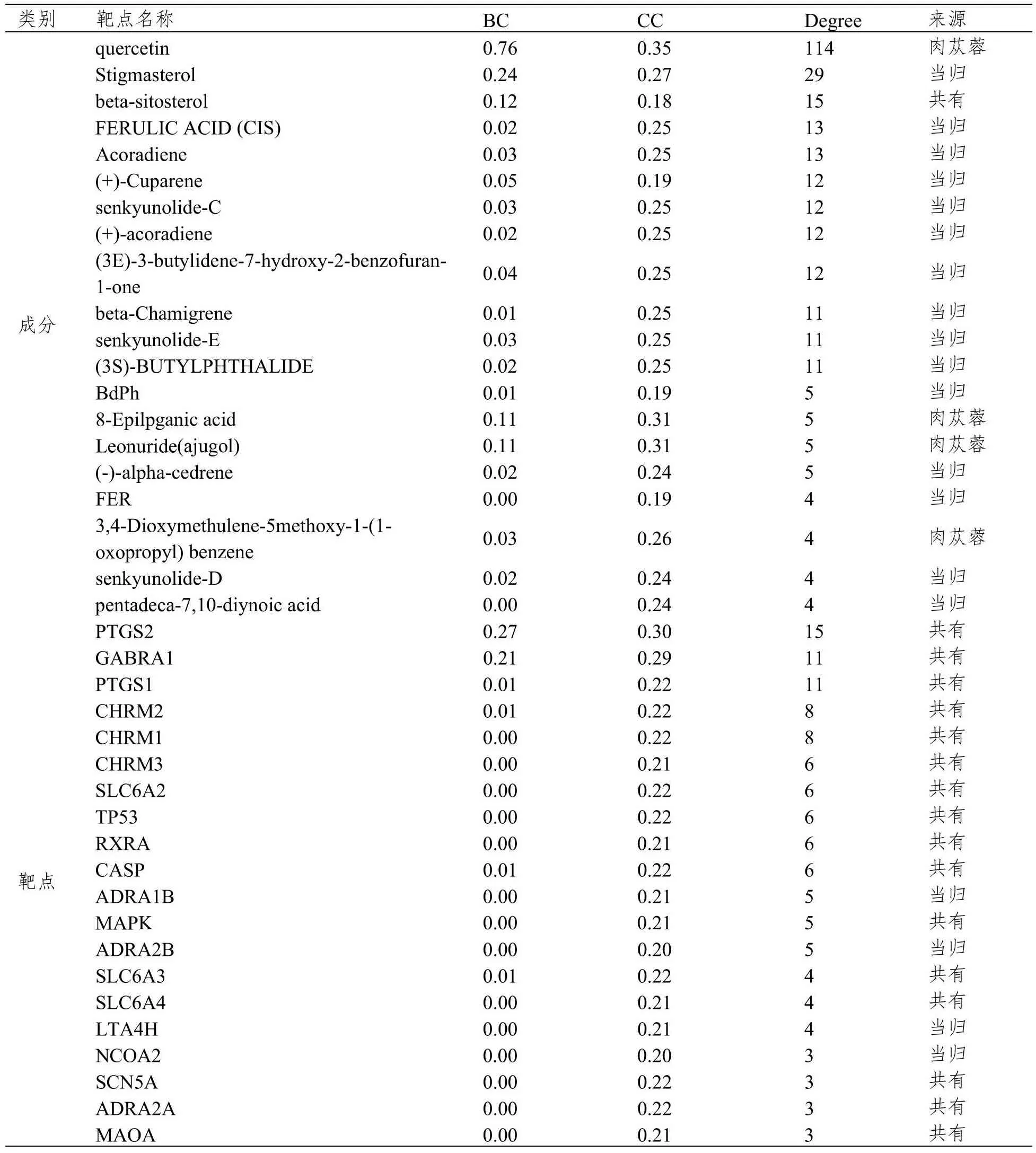
表2 当归-肉苁蓉-活性成分-靶点网络重要节点
2.4 当归-肉苁蓉治疗FC的药物-活性成分-共有靶点网络和关键基因筛选
“当归-肉苁蓉-活性成分-FC共有靶点网络”共有146个节点和226条边。β-谷甾醇、槲皮素、豆甾醇、阿魏酸等成分的degree值高。PTGS2、PTGS1、GABRA1、CHRM2、CHRM1、CHRM3和SLC6A2等靶点的degree值较高,提示这些靶点可能在当归-肉苁蓉治疗FC中起主要作用,见图3。CytoNCA插件按DC≥44、CC≥48.415613、BC≥0.517432975为阈值筛选,最终得到关键基因74个,PPI网络有节点74个,边1334条。AKT蛋白激酶(Threonine-protein kinase,AKT1)、血管内皮生长因子A(Vascular endothelial growth factor A,VEGFA)、表皮生长因子受体(Epidermal growth factor receptor,EGFR)、转录因子(Transcription factor Jun,JUN)、TP53、CASP和MAPK等节点degree值大,结合分数高,在网络最中心,预测为当归-肉苁蓉治疗FC的潜在关键靶点,见图4。

图3 当归-肉苁蓉-活性成分-FC共有靶点网络(节点大小与degree值成正比)

图4 当归-肉苁蓉治疗FC的关键基因PPI网络
2.5 当归-肉苁蓉治疗FC的关键基因的生物信息学分析
关键基因GO分析的结果可知,当归、肉苁蓉配伍治疗功能性便秘的机制多与缺氧的反应、RNA聚合酶II启动子转录的正调控、凋亡过程的负调控、类固醇激素受体活性等多个生物过程和分子功能有关,见图5。KEGG 通路主要有TNF信号通路、HIF-1信号通路、p53信号通路、PI3KAkt 信号通路、MAPK信号通路等,见图6。
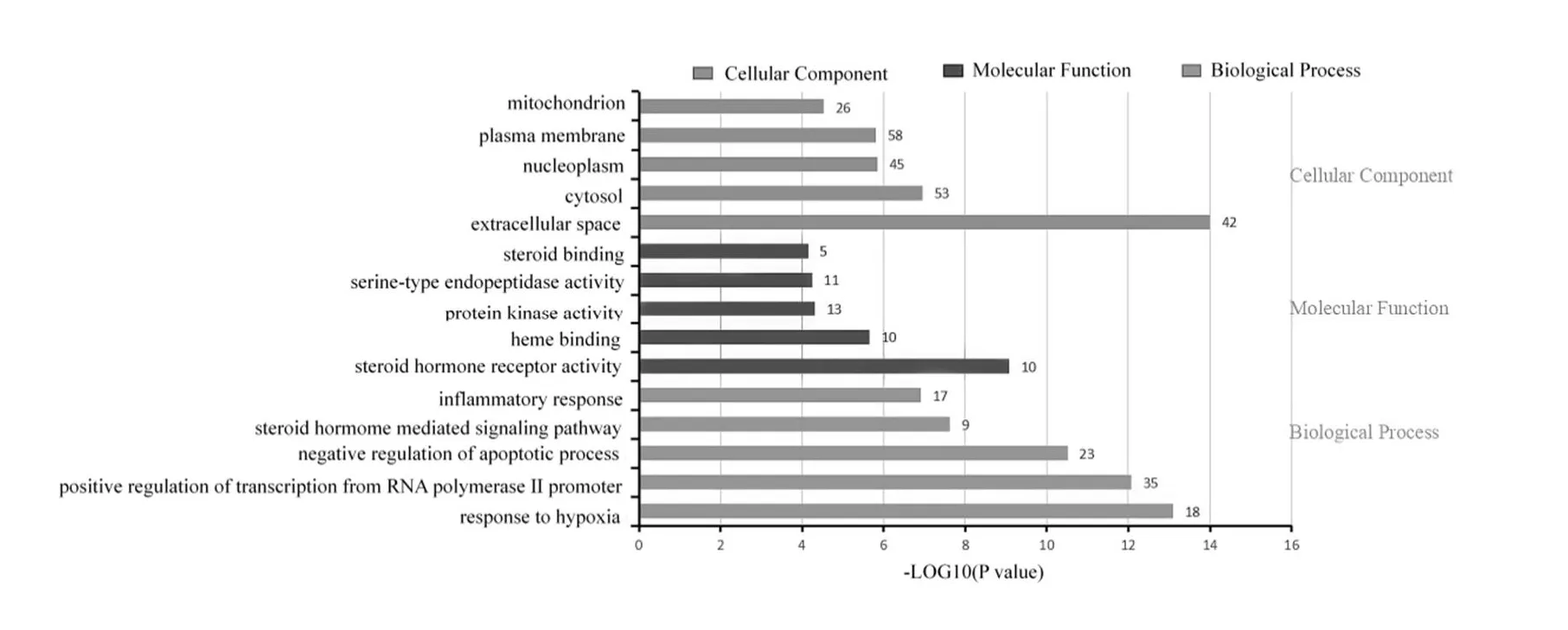
图5 GO功能富集分析
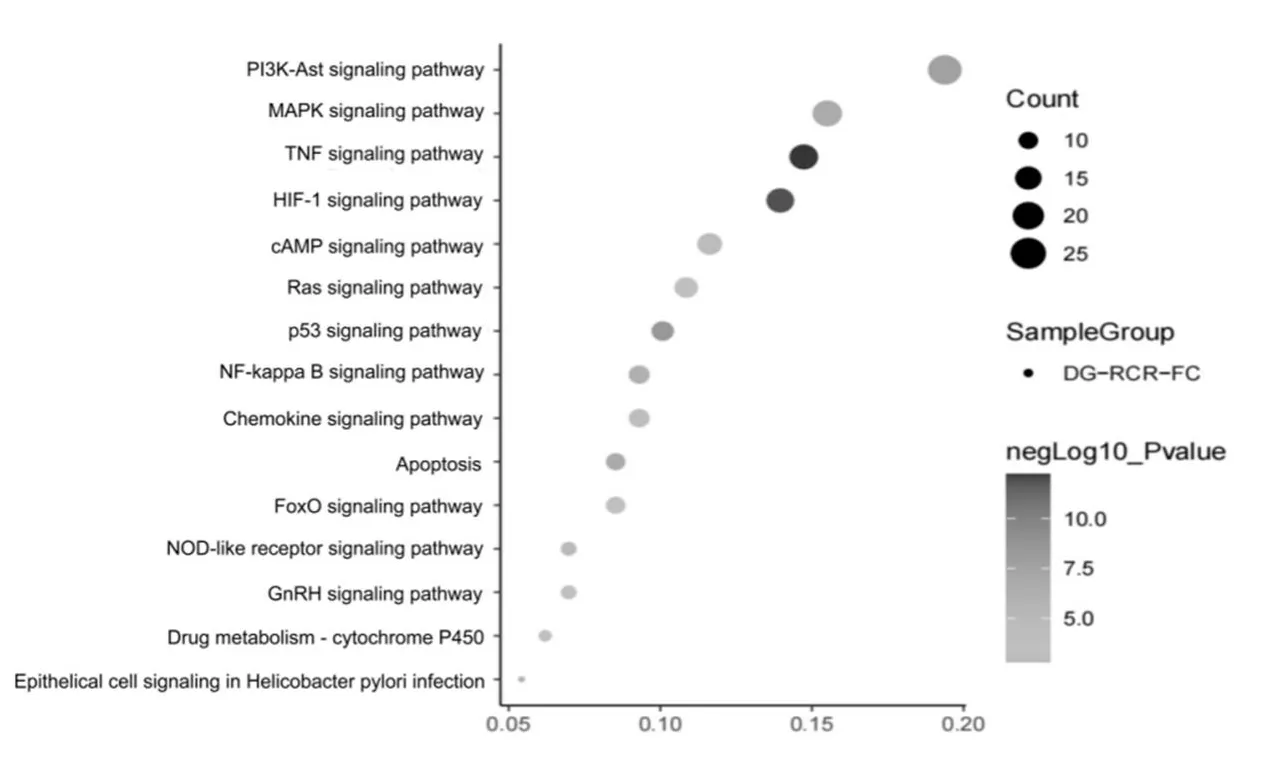
图6 KEGG通路分析
3 讨论
FC多与患者生活习惯、精神因素、肠道菌群失调、胃肠激素和神经递质异常等有关,病程长且治疗难度大[5]。西医药物治疗存在疗效欠佳,易引起复发,易形成依赖性等缺点[6]。中医用以活血养血、滋阴补阳、疏肝健脾、润肠通便的中药,改善患者阴虚血虚、肝气郁结、脾胃不和等状态[7]。当归-肉苁蓉为治疗FC常见药对,当归滋阴生血,补血活血,润肠通便;肉苁蓉补肾壮阳,滋阴养血,软坚通便。二者配伍,行中有补,补而不峻,起到调肝养血,润肠通便的功效。因此,本研究基于网络药理学技术进行了当归-肉苁蓉药对配伍治疗FC作用机制。的
最终收集到当归-肉苁蓉药对活性成分39个,成分相关靶点237个,FC疾病靶点2428个。其中,当归-肉苁蓉药对靶点与疾病靶点的交集靶点132个,筛选到关键基因74个。β-谷甾醇、槲皮素、豆甾醇、阿魏酸等成分可能是药对治疗FC的活性成分,β-谷甾醇为当归-肉苁蓉的共有活性成分,具有抗炎、抗氧化、抑菌等作用[8]。研究表明,β-谷甾醇和豆甾醇可改善小鼠实验性结肠炎,保护大鼠胃和十二指肠,预防消化性溃疡[9]。改善功能性便秘可通过减少炎症反应实现[10]。PTGS与胃肠道功能关系密切,是炎症反应的主要介质[11]。PTGS2在慢性和急性炎症反应中明显上调,可加重胃肠道毒性。在机械性肠梗阻模型中,表达上调甚至诱发结直肠癌发病[12]。AKT1依赖PI3K途径激活,对PI3K-AKT 通路的激活,可影响肠道传输功能从而参与功能性便秘、慢性传输性便秘等多种便秘[13]。
TP53信号通路、MAPK信号通路和NF-κB信号通路已被报道与功能性便秘发病机制密切相关[14-15]。MAPK信号通路通过调节水通道蛋白的表达,促进水分运输,调节慢性传输型便秘大鼠结肠水代谢平衡[16]。
综上所述,本研究基于网络药理学技术分析,发现当归-肉苁蓉可能通过β-谷甾醇、豆甾醇、阿魏酸等关键活性成分,作用于PTGS2、AKT1、TP53、CASP和MAPK等核心靶点,参与TNF信号通路、PI3K-Akt信号通路、MAPK信号通路等,发挥其多成分、多靶点、多通路治疗FC的作用,为深入研究其作用机制提供了理论依据和思路。

