小肠腺鳞癌合并肠穿孔1例报告及文献复习
李昊,张硕硕,陈小龙,李兴旺,姚坤厚
河南大学淮河医院 普外科,河南 开封475000
全球癌症数据统计报告指出,消化系统肿瘤约占所有癌症相关死亡的60%[1]。小肠腺鳞癌属于消化系统中较为罕见的恶性肿瘤,发病率约占消化系统肿瘤的0.4%~2.3%,多为内生型肿物,早期临床症状不典型,大多以急腹症入院行手术治疗后病理证实。目前关于小肠腺鳞癌的临床病例报道很少,对其临床病理特征和治疗方案的了解相对有限。本文回顾性分析我院收治的1例小肠腺鳞癌合并肠穿孔,以积累经验,也为此类罕见病例的相关治疗和研究提供参考。
1 病例资料
1.1 病史
患者,女,69岁,以“腹痛3 d,加重1 h”为主诉入院。3 d前无明显诱因出现腹痛不适,就诊某院,以“肠梗阻”为诊断行禁水禁食、胃肠减压、灌肠、补液等对症支持治疗,症状未见明显缓解,1 h前上述症状加重,急诊转入我科。高血压病病史15 a年,间断口服尼群地平缓释片,每晨1片,血压控制基本稳定。糖尿病病史5 a余,未规律监测及治疗。
1.2 查体
体温:36.6 ℃;脉搏:73次/分;呼吸:20次/分;血压:150/80 mm Hg。下腹部压痛、反跳痛明显,可触及全腹腹肌紧张,肠鸣音减弱。
1.3 实验室检查
1)血常规。白细胞计数:7.71×109/L;中性粒细胞百分比:83.1%;红细胞计数:3.07×1012/L;血红蛋白:81 g/L。血生化和凝血功能结果基本正常。
2)肿瘤标志物。CA125:29.2 U/ mL(参考范围:≤35);CA199:3.6 U/ mL(参考范围:≤33);AFP:1.32 ng/ mL(参考范围:≤7);CEA:2.07 ng/ mL(参考范围:≤6.5)。
1.4 影像学检查
腹部CT 提示腹腔少量游离气体,考虑消化道穿孔可能。
2 治疗情况
2.1 目前诊断
因考虑患者急性消化道穿孔,排除手术禁忌症。与患者及家属详细沟通病情,建议行腹腔镜探查。患者及家属同意并签署手术同意书。
2.2 探查所见
腹腔及盆腔内积存黄色浑浊脓液,量约100 mL。探查见距离回盲部约20 cm 处小肠肿物合并穿孔,穿孔直径约0.3 cm,内可见肠液流出;穿孔处小肠与周围肠管及腹壁组织粘连严重。
2.3 手术经过
用腔内冲洗吸引器吸除腹腔内积液,显露穿孔部位,按压肠壁可见肠液及气体溢出。钝性分离小肠肿物与周围组织粘连,决定中转开腹行小肠肿物切除并回肠单腔造口术:沿脐下正中逐层切开皮肤及筋膜层,进入腹腔后置入一次性切口保护套,分束分离结扎小肠系膜血管,游离裸化小肠肿物;在肿物远端近回盲部约10 cm 处用一次性直线切割闭合器切割离断小肠,在肿物近端约5 cm 处用一次性直线切割闭合器切割离断小肠,去除标本;3-0可吸收缝线将近回盲部断端做加固荷包缝合包埋处理;右侧腹腔切开一纵行切口约3 cm,将近端小肠断端自该切口处引出,将肠管与腹膜、皮肤分层缝合固定,做回肠单腔造口;大量生理盐水反复冲洗腹腔,直至吸出液基本澄清;吸除腹腔内渗液及冲洗液后,于肝脏右侧、文氏孔和盆腔分别置入螺旋引流管各1根自腹壁穿刺孔引出、固定。手术过程顺利,出血约50 mL,术毕患者于麻醉复苏室苏醒后安返病房。
2.4 术后病理
小肠腺鳞癌,大小为4 cm×3.2 cm×3 cm,癌组织呈浸润性生长,侵犯肠壁全层达浆膜层。癌组织侵犯神经纤维束,间质脉管内见癌栓;两端切缘小肠黏膜慢性炎,未见癌;肠系膜淋巴结未见癌转移(0/2),另见癌转移结节3 枚。免疫组化结果:CK(+),VImentin(+),CK8/18(腺癌成分+),P40(鳞癌成分+),CDX-2(-),SATB(+),MUC2(-),PAX(-),Ki67(+50%),标本及镜检见图1。

图1 病理标本大体观及HE染色显微镜下所见
行基因检测,基因KRAS P.Gln61His(E3)突变,突变丰度为23.16%。
3 文献检索策略及结果
计算机检索建库至今在Pub Med、Web of Science数据库收录的文章。英文检索词有“adenosquamous carcinoma”“jejunum”“duodenum”“ileum”“small intestine”“case reports”等,所检索的数据库及检出文献数具体如下:Pub Med,n=31;Web of Science,n=40。检索结果剔除重复、与小肠腺鳞癌不相关、信息不完整等文献。迄今为止的文献报道仅有9例(见表1),其中4例在最初诊断时已经发生转移。综合纳入本病例总结见表1。
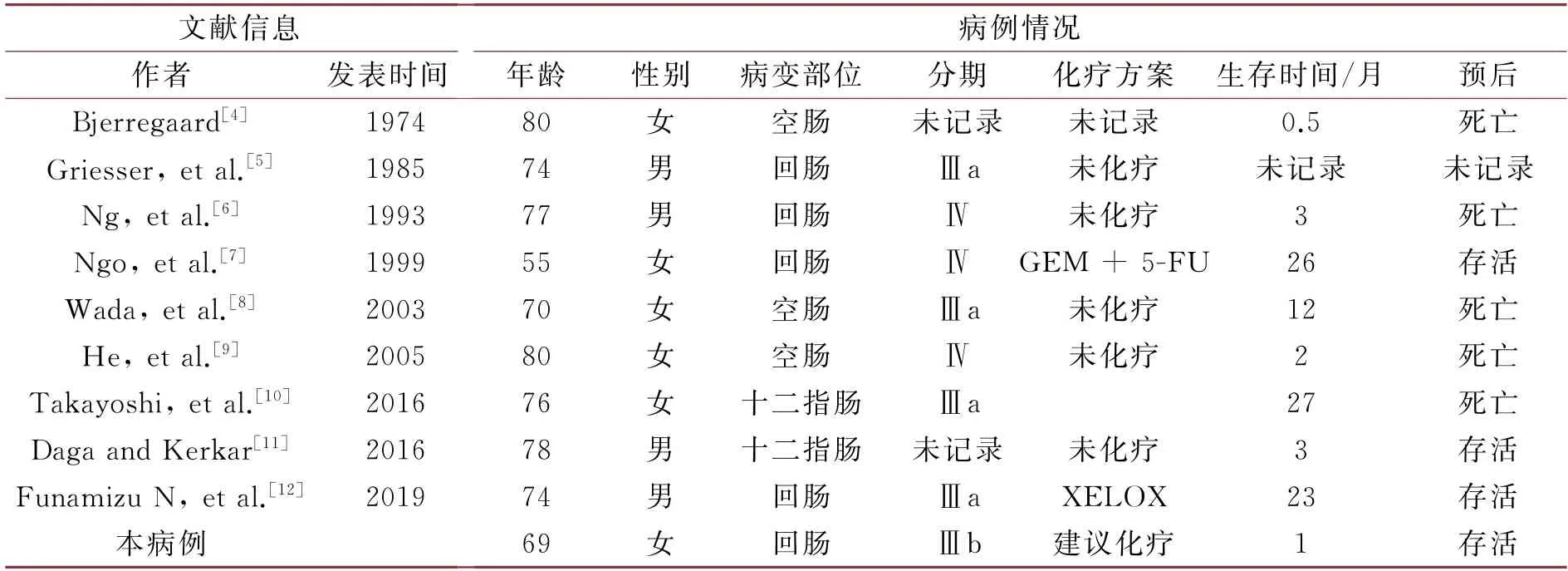
表1 小肠腺鳞癌的病例报告总结
4 讨论
4.1 临床表现
查阅以上文献,我们可以发现小肠腺鳞癌的患者早期多以腹痛为主诉入院,少数患者会有消化道出血,多为隐痛出血,表现为大便潜血试验阳性或黑便。此外,小肠腺鳞癌恶性程度较高,病情进展较快,肿瘤肿块较大时突入肠腔或者侵犯肠壁造成肠管狭窄可导致肠道梗阻。本篇报道中患者合并小肠穿孔,考虑是肿瘤局部侵犯肠壁形成溃疡引起的穿孔,随着病情进展患者也可能会出现消瘦、贫血等一系列全身性症状。
4.2 病理特征
小肠腺鳞癌的病理诊断原则与结直肠腺鳞癌基本相同[2],需要在HE 染色切片中查到鳞状细胞癌和腺癌两种分化:鳞状细胞癌分化的病例特征呈团、巢状分布的组织结构,细胞与细胞之间存在细胞间桥、角化珠形成及细胞内角化珠形成等;腺癌分化的结构特征呈腺管状,部分筛网状,细胞内分泌丰富等[3]。通常,可在两种成分相互移行的区域见到界于鳞状细胞癌和腺癌形态之间的中间形态,在分化较差时常需要免疫组化染色加以证实。
腺鳞癌比单纯的腺癌或鳞癌更具侵袭性,通常更容易发生局部和远处的转移,恶性程度也相对较高,目前由于此类临床病例较少,关于其临床病理特征及发生机制尚不清楚。目前已经提出以下几种假设[13-17]:①异位的鳞状细胞发生癌变;②位于腺体底部未分化的基底细胞向腺癌和鳞癌细胞转化;③慢性炎症刺激导致腺上皮鳞状化生,如溃疡性结肠炎或其他损伤刺激导致具有多向分化潜能的多能干细胞的激活,使该细胞恶性转化;④腺癌上皮的鳞状化生。
4.3 研究及治疗现状
小肠腺鳞癌属于消化系统中较为罕见的恶性肿瘤,除接受化疗的患者外,所有患者均在接受手术后1年内死于该疾病。目前关于小肠腺鳞癌的临床病例报道很少,因此对其临床病理特征和治疗方案的了解相对有限,暂时没有相关文献或指南提出有针对性的治疗建议。
4.3.1 外科手术
手术切除是小肠腺鳞癌获得较长生存期的首选治疗方法。常规腺癌或鳞癌的手术原则同样适用于腺鳞癌。干净的手术切缘、足够范围的淋巴结清扫和足够数量的淋巴结病理活检是基本原则。研究人员指出,尽管小肠腺鳞癌恶性程度很高,但如果进行根治性手术,患者可以有很好的预后。然而,不可回避的现实是,小肠腺鳞癌早期的临床症状多不典型,大多数患者在发病时已处于局部晚期或转移状态,并失去根治性手术的机会。这是该病预后差的主要原因。
4.3.2 化疗
放、化疗是除手术切除外首选的辅助治疗手段[18-19]。但目前尚无公认的最佳放化疗方案。近些年有一些回顾性分析结果显示,化疗可获得良好的肿瘤控制和延长生存期的效果。Funamizu N 等[12]人在2019年的病例报告中介绍一例小肠腺鳞癌的手术患者,术后病理分期:T4N1M0,IIIa期,其参照胃癌及结直肠癌诊疗指南,给予患者卡培他滨+奥沙利铂方案(XELOX)行术后6个月化疗,患者存活23个月(截至2018年10月17日)无复发。但是目前此类病例报道和回顾性分析较少,而且由于研究规模、种族、治疗方法和分析方法的差异,以及回顾性分析的固有缺点和临床试验的缺乏,化疗是否可以改善手术患者的预后仍需进一步考证。
4.3.3 靶向治疗
由于腺鳞癌的特殊分子生物学特征,抗血管靶向药物在小肠腺鳞癌的治疗应用中有一定的研究价值。部分临床研究[20]已经表明除胰腺导管外的腺鳞癌具有高表达的VEGFA、HIF1A 和Ang-2,并且具有比常规腺癌更活跃的血管生成;而且,通过以前的研究发现,肿瘤诱导的血管生成因子,包括血管内皮生长因子,可以促进肿瘤新生血管形成,产生功能和结构异常,导致肿瘤内应激反应增加,阻碍效应T细胞的浸润[21]。抗肿瘤细胞毒性T淋巴细胞不能渗透到肿瘤微环境。其他因素包括血管内皮细胞粘附分子-1的下调可以阻止效应T细胞迁移到肿瘤基质中[22]。
此外,髓系来源的抑制剂细胞(ICIs)代表未成熟的髓系细胞,这些细胞在肿瘤及炎症反应的影响下被阻止分化成成熟细胞,通过多种发生机制可进一步抑制效应性T细胞(CTL)的抗肿瘤反应[22]。阻止CTL和树突细胞的成熟,也会抑制CTLs的功能[23],抗VGFR治疗后肿瘤血管的正常化可以降低瘤内压力,恢复抗细胞毒性T淋巴细胞抗原浸润,增强ICI的抗肿瘤作用[24-25]。此外,在肿瘤微环境中存在几种类型的免疫抑制细胞,包括调节性T细胞(Tregs)和肿瘤相关巨噬细胞(TAMs)。以前的研究报道指出,Tregs 和TAMs的活性部分取决于血管内皮生长因子/血管内皮生长因子受体(VEGFR)轴,血管内皮生长因子的过表达促进肿瘤中Tregs的募集、分化和增殖[26]。同样,肿瘤诱导的血管生成因子或缺氧状态可通过血管内皮生长因子/血管内皮生长因子受体轴进一步促进Tregs 和TAMs的功能,导致抗肿瘤CTL活性的下调[25]。上述机制为抗血管靶向药物和ICIs的联合治疗提供了可能的理论基础。
4.3.4 免疫疗法
美国食品和药物管理局(FDA)已经批准对PD-L1阳性和MSI-高/DNA错配修复缺陷(d MMR)晚期胃肠肿瘤患者使用培布罗珠单抗进行治疗[26]。免疫抑制剂疗法(ICI)的突破为癌症免疫治疗创造了广泛的机会。特别是利用ICI抑制程序性死亡-1(PD-1)/程序性死亡配体1(PD-L1)轴已成为治疗消化系统肿瘤的一种新的治疗策略。然而,在过去的十年里,单药ICI治疗的单臂和随机试验表明,他们的治疗效果并不令人满意,包括晚期消化系统肿瘤的临床试验。然而,在选择合适的预测性生物标志物并开发抗血管生成靶向药物和其他化疗药物的组合后,消化系统肿瘤患者的客观有效率(ORR)和无进展生存期(PFS)显著提高。而且传统的化疗药物能够增强患者的抗肿瘤免疫反应,ICI可以相应地进一步清除对化疗耐药的肿瘤细胞。因此,ICI和化疗药物联合用于抗肿瘤治疗具有临床益处,许多临床试验已经验证了这一假设。本病例在患者住院期间,我们为探索有效可行的治疗方案,参照结直肠癌NCCN 指南推荐,对靶向治疗相关基因(KRAS,NRAS,BRAF)及免疫抑制剂相关标志物(MSI)进行了基因检测。检测到基因KRAS P.Gln61His(E3)突变,突变丰度为23.16%,提示预后效果不佳。MSI检测稳定,提示对5-FU方案可能敏感,但对免疫抑制治疗可能不敏感。
5 结论和展望
小肠腺鳞癌是一种罕见的消化系统肿瘤,具有独特的病理特征。由于其罕见性,关于其临床病理特征、预后和治疗的数据主要来自回顾性分析,大多没有进行过有针对性的对照临床试验。小肠腺鳞癌的治疗依赖于联合治疗,手术仍然是治疗的主要手段。小肠腺鳞癌早期的临床症状多不典型,多以急腹症为首发症状,需要与阑尾炎、结肠肿瘤、Crohn病、Meckel憩室炎、肠套叠等鉴别。本文报道病例,患者小肠腺鳞癌合并肠穿孔的情况更为少见。因此,应该进一步积累经验提高对小肠腺鳞癌的认识,为我国此类罕见病例的相关治疗和研究提供参考。

