薄荷醇修饰紫杉醇阳离子脂质体处方优选及体外靶向性评价
蔡佳雨,刘婉滢,司佳奇,刘 洋,李沣芮,孔 亮,2,李学涛*
(1.辽宁中医药大学 药学院,辽宁 大连 116600;2.辽宁中医药大学中医脏象理论及应用教育部重点实验室,辽宁 沈阳 110847)
脑胶质瘤是致死率较高的原发性脑肿瘤[1-3]。化疗作为一种治疗脑胶质瘤的重要手段,但由于血脑屏障(BBB)的存在,药物很难进入中枢神经并在肿瘤部位聚积[4-5]。紫杉醇(paclitaxel,PTX)是从红豆杉树皮中分离得到的二萜类广谱抗癌药,PTX 可在不同细胞中通过促进抗凋亡蛋白Bcl-2 磷酸化激活Raf-1、促进促凋亡蛋白cleaved capase-3、cleaved capase-8 表达等凋亡途径发挥抗肿瘤作用,但PTX存在对肿瘤细胞的选择性差、副作用大和水溶性差等问题,使其临床应用受到限制[6-10]。阳离子脂质体是由磷脂、胆固醇和阳离子材料构成的一种封闭的双层囊泡体系,能够同时包裹亲水性和疏水性药物,因其磷脂膜表面带正电荷使其更容易被肿瘤细胞摄取,但胆固醇会引起心肺副反应和过敏反应[11-12]。故本研究选用具有与胆固醇相似的类固醇结构的人参皂苷Rh2来代替胆固醇[13-15],并在阳离子脂质体的表面修饰具有芳香开窍作用的薄荷醇,构建薄荷醇修饰紫杉醇阳离子脂质体(menthol-modified paclitaxel cationic liposomes, Men-PCLPs),对其体外靶向能力进行初步考察。
1 材料
1.1 主要仪器
JY92-2D 型超声波细胞破碎仪(宁波新芝生物科技股份有限公司);Agress1100 型高效液相色谱仪(大连依利特分析仪器有限公司);FACSCCalibur 型流式细胞仪(美国BD 公司);B-220 型恒温水浴锅和RE52CS 型旋转蒸发器(上海亚荣生化仪器厂);FA1004 型电子天平(上海越平科学仪器有限公司)。
1.2 材料
磷脂(日本NOF 公司,批号:120025);PTX(大连美仑生物技术有限公司,批号:J1101A,纯度>99%);人参皂苷Rh2(成都普菲德生物技术有限公司,批号:20082504,纯度>99%);3β-[N-(N′-N′-二甲基氨基乙烷)-氨基甲酰基]胆固醇盐酸盐(DC-Chol,批号:201923,美国 Avanti 公司);DSPE-PEG2000-薄荷醇(批号:RF0222837,西安瑞禧生物科技有限公司);香豆素(批号:442631,美国Sigma-Aldrich 公司)。鼠源脑胶质瘤C6 细胞、小鼠脑微血管内皮bEnd.3 细胞购自赛百慷生物技术股份有限公司(上海)。
2 方法与结果
2.1 脂质体的制备
选择薄膜分散法制备脂质体。精密称取处方量的DSPE-PEG2000-薄荷醇、DC-Chol、人参皂苷Rh2、磷脂和 PTX 置于圆底烧瓶中,加5 mL 甲醇,超声溶解后在40℃水浴中减压旋转蒸发除去甲醇至成膜。取下圆底烧瓶并在瓶中加入5 mL PBS 后超声将薄膜溶解,随后在超声波细胞破碎仪中超声10 min,取出后经0.22 μm 微孔滤膜滤过2 次,即可得到Men-PCLPs。不加PTX,其余步骤同上制备空白脂质体。
2.2 PTX 测定方法的建立
2.2.1 色谱条件 色谱柱:Ultimate XB-C18柱(4.6 mm×250 mm,5 μm);流速为1 mL/min;检测波长为227 nm;柱温为20℃,检测器为紫外吸收检测器;进样量为10 μL;流动相为甲醇-乙腈-水= 28 ∶42 ∶30。
2.2.2 溶液的制备 (1)对照品溶液 取5 mg PTX,加5 mL 甲醇制成浓度为1 mg/mL 的对照品母液,后用甲醇将对照品母液依次稀释成浓度为5.000、10.000、15.000、20.000、25.000、30.000 μg/mL 的对照品溶液。
(2)供试品溶液 取1 mL Men-PCLPs,加甲醇9 mL 破乳,即得。
(3)空白溶液 取1 mL 薄荷醇修饰空白脂质体,加甲醇9 mL 破乳,即得。
2.2.3 专属性试验 吸取适量空白溶液、对照品溶液与供试品溶液,进样测定,记录色谱图,见图1。结果显示,PTX 在6.500 ~ 7.500 min 出峰,而空白溶液在对应时间段无色谱峰出现,显示该方法专属性良好。
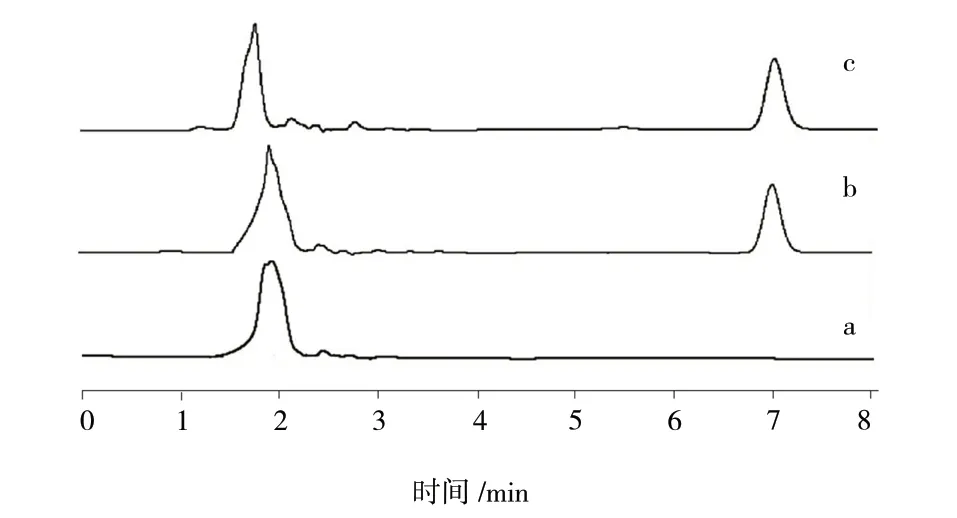
图1 PTX 含量测定HPLC 图Fig.1 HPLC figure of PTX content determination
2.2.4 标准曲线的绘制 取浓度5.000、10.000、15.000、20.000、25.000、30.000 μg/mL 的对照品溶液适量进样测定。用待测成分质量浓度(X,μg/mL)和对应峰面积(Y)进行标准曲线绘制,得PTX 的回归方程为Y= 43.682X+ 2.711(r= 0.999)。结果表明,PTX 在5.000 ~ 30.000 μg/mL 质量浓度范围内与其峰面积的线性关系良好。
2.2.5 重复性试验 取处方优选方案样品6 份,进样测定,将峰面积代入回归方程计算PTX 含量。结果RSD = 1.54%,表明该方法重复性良好。
2.2.6 精密度试验 取“2.2.2”项下对照品溶液,进样测定6 次,将峰面积带入回归方程。结果RSD =0.90%,表明仪器精密度良好。
不良反应组患者的P T(1 0.8 6±2.0 1)s,T T(14.69±0.87)s,APTT(27.71±1.84)s,Fib(1.08±0.11)s;其PLT(139.91±10.76)×109/L,HCT(0.56±0.07),Hb(82.26±7.08)g/L,RBC(2.91±1.45)×109/L。
2.2.7 稳定性试验 取2.2.2”项下供试品溶液,分别于0、2、4、8、12、24 h 进行测定。结果RSD =0.59%,表明该脂质体24 h 内的稳定性良好。
2.2.8 加样回收率试验 按“2.2.2”项下方法制备供试品样品6 份,按质量比1 ∶1 加入对照品溶液,进样测定,计算加样回收率。结果可得,PTX 的平均加样回收率为104.07%(RSD = 0.99%)。
2.3 脂质体包封率的测定
取Men-CCLPs 样品2 mL,经0.22μm 微孔滤膜滤过,得到过膜后脂质体。分别精密吸取过膜前与过膜后的脂质体0.50 mL 加入4.50 mL 甲醇,破乳后经0.45μm 微孔滤膜滤过,用HPLC 对破乳后过膜前与过膜后滤液按“2.2.1”项下色谱条件进行测定,计算PTX 包封率,包封率=M过膜后/M过膜前×100%。
2.4 脂质体处方工艺优选
根据课题组前期研究经验,选用磷脂质量(A)、人参皂苷Rh2质量(B)与PTX 质量(C)作为考察因素,选定考察指标为PTX 平均包封率(Y,%),选择Box-Benhken 设计-响应面实验优选脂质体的处方工艺,处方量5 mL。实验设计及结果见表1 ~ 3。
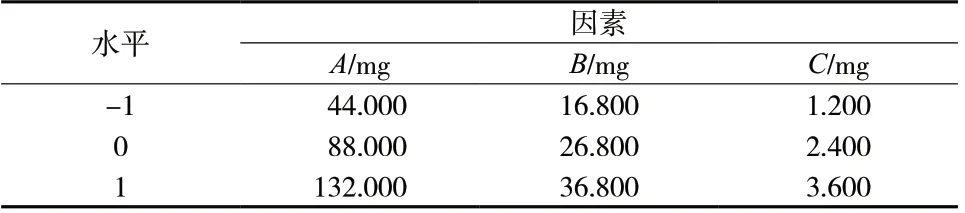
表1 各因素水平编码Tab.1 Horizontal coding of each factor
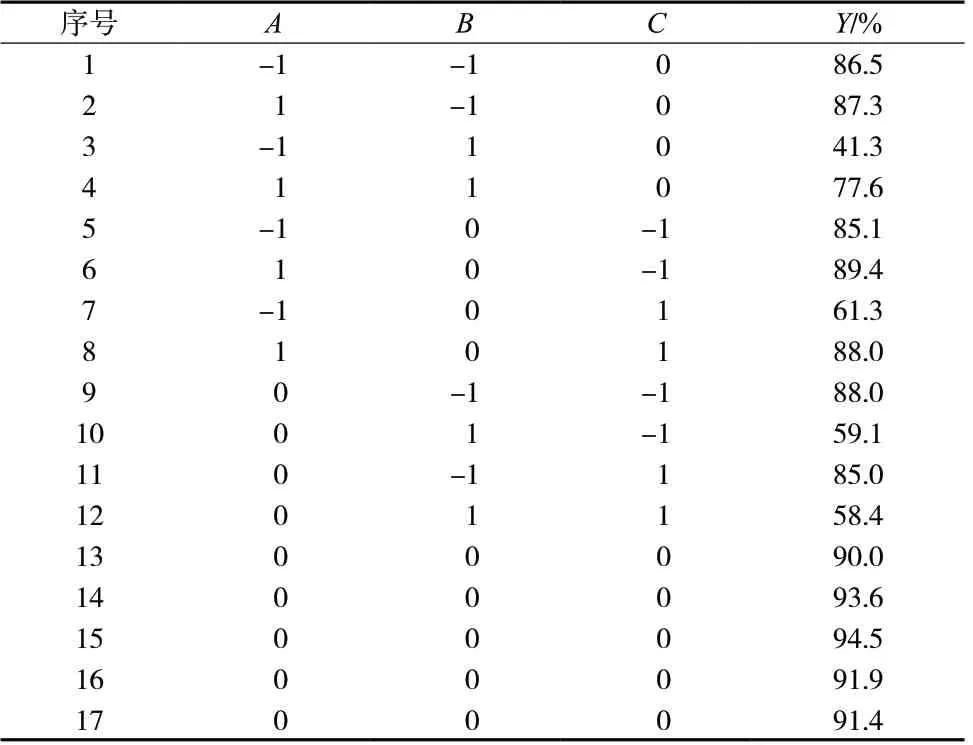
表2 Box-Behnken 实验设计方案与结果Tab.2 Box-Behnken experimental design scheme and results
将表3 中包封率数据输入Design-Expert8.0.6.1 软件中,拟合的方程为:Y= 92.280 + 8.510A- 13.800B-3.610C+ 8.880AB+ 5.600AC+ 0.570BC- 5.390A2-13.710B2- 5.940C2(r= 0.990 3,P<0.05)。拟合结果表明,该模型可以较好地反映Y值的变化,可用于优选Men-PCLPs 的处方工艺。对拟合模型进行显著性检验发现,A、B、C、A2、B2、C2、AB、AC对Y值有显著影响(P<0.05),因素BC对Y值没有显著影响(P>0.05);3 个因素对平均包封率影响的大小顺序为B>A>C,即人参皂苷Rh2质量>磷脂质量>PTX 质量。用Design-Expert 8.0.6.1 软件绘制因变量和自变量的三维效应面图和二维等高图,见图2。
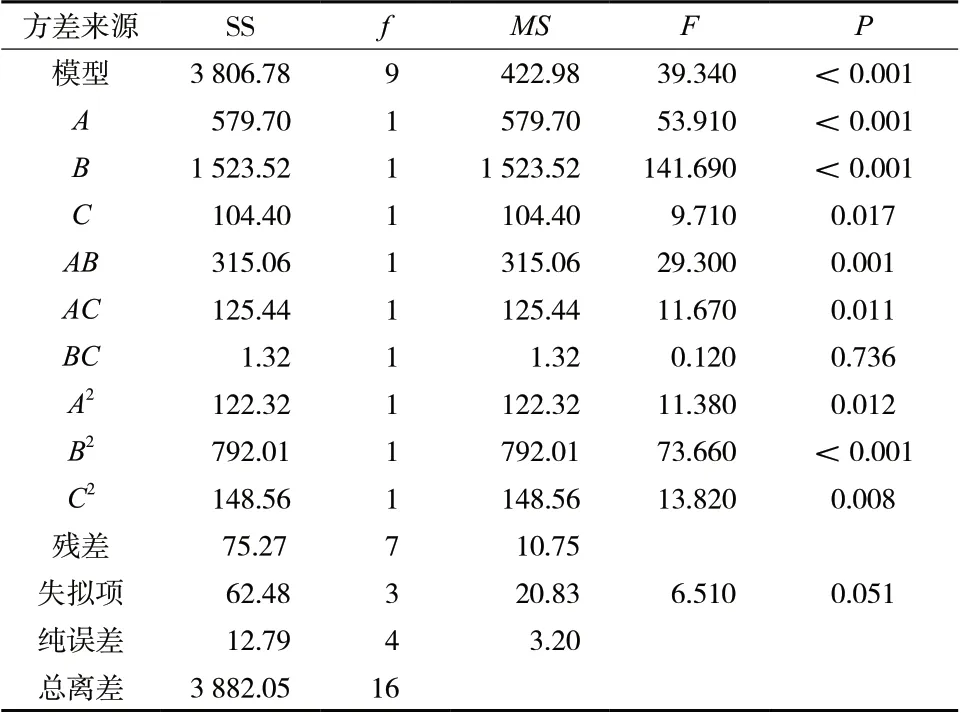
表3 方差分析结果Tab.3 Results of variance analysis
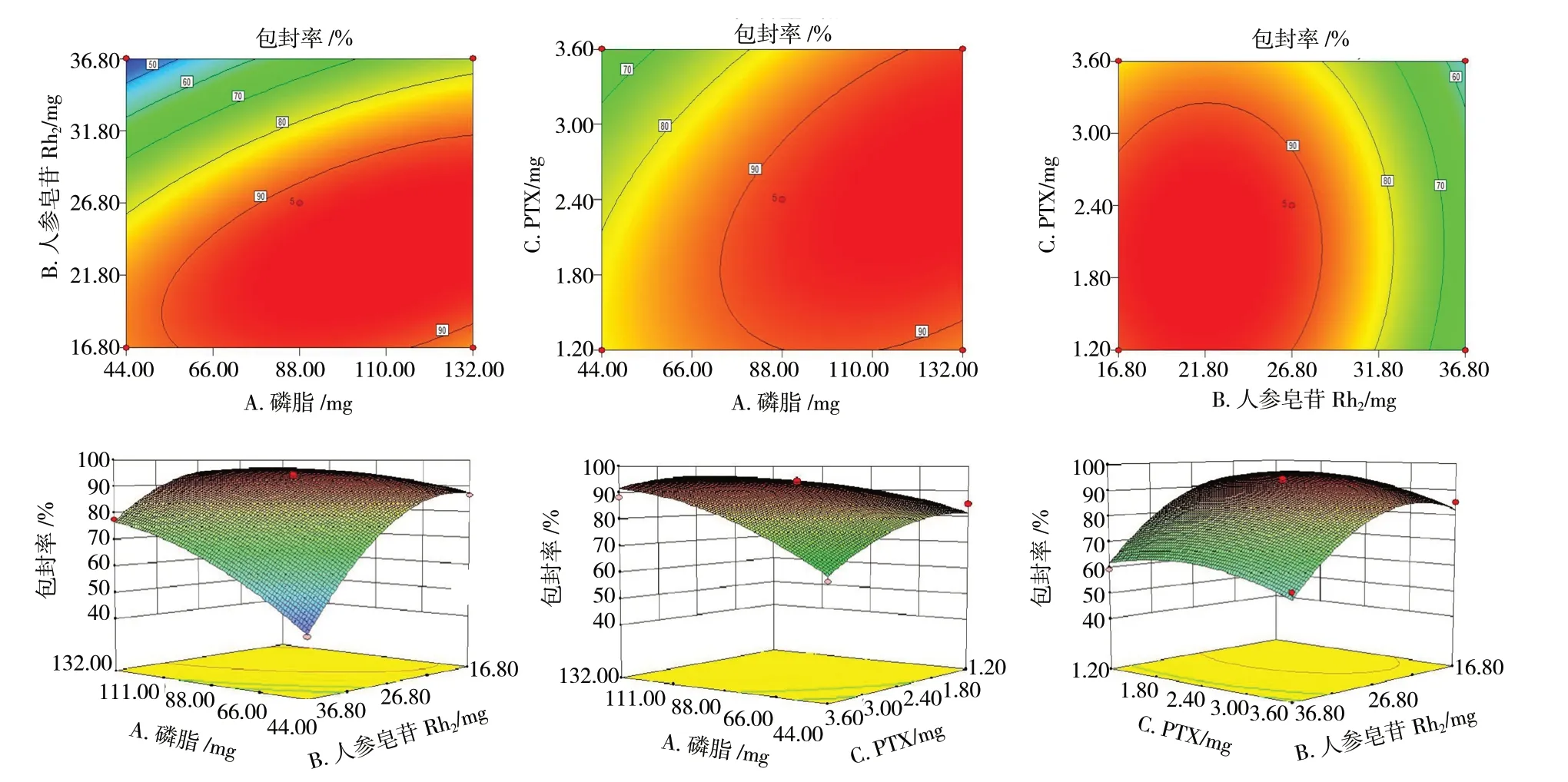
图2 各因素对Men-PCLPs 平均包封率影响的等高线图和效应面图Fig.2 Contour plot and effect surface plot of the influence of various factors on the average encapsulation rate of Men-PCLPs

图3 各组细胞存活率的测定结果Fig.3 Cell survival rate of each group
最终优选处方为:处方量5 mL、磷脂106 mg、人参皂苷Rh220 mg、PTX 2.200 mg。制备3 批Men-PCLPs,计算PTX 平均包封率为(93.800±0.006)%。表明研究优选的处方可行、工艺稳定。
2.5 Men-PCLPs 对C6 细胞存活率的影响
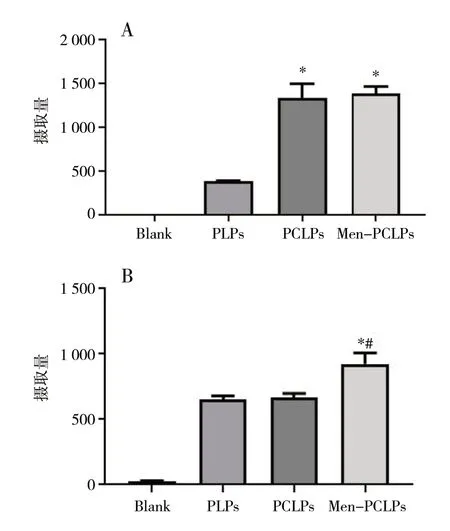
图4 细胞摄取结果(n = 3)Fig.4 Cell uptake results(n = 3)
结果显示, Men-PCLPs 组IC50[(1.540 ± 0.118)μmol/L]和紫杉醇阳离子脂质体组(paclitaxel cationic liposomes,PCLPs)IC50[1.670 ±0.134)μmol/L]高于紫杉醇脂质体组(paclitaxel liposomes,PLPs)IC50[(2.600±0.425)μmol/L]和空白脂质体组。PLPs组毒性低于PCLPs 和Men-PCLPs 组(P<0.05)。
2.6 Men-PCLPs 体外靶向性研究
2.6.1 荧光脂质体的制备 用香豆素代替PTX 按“2.1”项下方法制备薄荷醇修饰香豆素阳离子脂质体、香豆素阳离子脂质体组、香豆素脂质体组和空白脂质体。
2.6.2 流式细胞术检测细胞摄取量 取C6 细胞接种至6 孔板中(5×105个/孔)分为不同脂质体给药组,24 h 后加入含药培养基继续培养3 h,经处理后,用流式细胞仪对细胞摄取量进行检测。bEnd.3细胞实验方法同上。最后用Graphpad-prism-8.02 对各脂质体组的摄取量进行方差分析。C6 细胞对Men-PCLPs 和PCLPs 的摄取量明显高于PLPs(P<0.05),见图4A;bEnd.3 细胞对Men-PCLPs 的摄取量明显高于PLPs 和PCLPs(P<0.05),见图4B。结果表明,Men-PCLPs 可提高药物的靶向性。
3 讨论
研究表明,肿瘤新生血管内皮细胞上带有负电荷的大分子物质[16-17],而阳离子脂质体表面带有正电荷可与之通过静电吸附作用,更容易被肿瘤细胞摄取,从而产生被动靶向作用。目前常见的脑靶向物质有转铁蛋白、甘露糖和多肽等,但由于受体、生物安全性或转运机制等问题,使其应用存在争议,因此开发一种安全有效的跨BBB 途径尤为重要[18]。薄荷醇是薄荷油的主要成分,是一种从薄荷的茎或叶中提取得到的环类单萜[19]。近年来有研究发现薄荷醇可降低紧密连接相关蛋白的表达,有效增加血脑屏障的通透性以协助其他药物进入脑内。LIANG J 等[20]发现薄荷醇的转运效率和生物安全性要比转铁蛋白高。
通过前期预实验筛选出影响包封率的3 个主要因素磷脂、人参皂苷Rh2和PTX 质量,选择Box-Benhken 设计响应面法对处方进行优化,成功制备包封率为(93.800±0.006)%的Men-PCLPs,经验证本方法安全可行。本实验考察不同组脂质体对C6 细胞存活率的影响以及被C6 细胞、bEnd.3 细胞的摄取情况。由于阳离子脂质体的正电荷与肿瘤细胞的静电吸附作用,在体外细胞实验中Men-PCLPs 和PCLPs对肿瘤细胞的抑制能力相似且较PLPs 显著增强,还可有效增加C6 细胞对药物的摄取。薄荷醇可降低肠上皮细胞相关蛋白的表达,增加血脑屏障的通透性,所以在体外靶向性考察中经薄荷醇修饰的脂质体可有效增加bEnd.3 细胞对药物的摄取。
4 结论
本研究成功制备Men-PCLPs,并筛选出优化处方,证明Men-PCLPs 对C6 细胞有一定的抑制能力,且Men-PCLPs 对 C6 细胞和bEnd.3 细胞有明显的主动靶向能力,体外实验结果初步表明Men-PCLPs 是一种安全、高效的靶向制剂,为后续抗肿瘤作用研究提供一定基础,但药物进入体内过程复杂,Men-PCLPs的抗肿瘤机制还需要更深入的实验探究。

