黄酮碳苷的分布、生物合成及其生物学功能研究进展
李 帅,戴轶群,赵玉成,秦民坚
(中国药科大学 中药学院,江苏 南京 211198)
黄酮类化合物是一类以二苯基色原酮(C6-C3-C6)为基本骨架,由两个芳香环(A 环与B 环)通过中间三碳结构连接而成的植物次生代谢产物,黄酮类化合物主要以其结合态(黄酮苷)形式存在,少量以游离态(黄酮苷元)的形式存在于植物体内[1-2]。根据糖基与黄酮苷元的连接方式,黄酮苷类化合物可分为黄酮氧苷和黄酮碳苷,黄酮苷元上氧原子与糖基以C-O 键连接形成黄酮-O-糖苷,而黄酮苷元上碳原子与糖基以C-C 键连接则形成黄酮-C-糖苷。黄酮碳苷常与氧苷共存,相对于黄酮氧苷更加稳定,且具有抗糖尿病、抗炎、抗阿尔茨海默病、抗氧化、抗病毒、抗焦虑和镇痛等多种药理活性[2-5]。在生物合成上,黄酮碳苷由C-糖基转移酶催化合成[1],迄今已有67 条CGTs 被报道。黄酮类成分具有重要的植物生物学功能,其中,黄酮碳苷在共色作用[6-7]、生殖[8]、抗食性[9]、化感作用[10]、抗真菌[11]、非生物胁迫[12]等方面也具有多重生物学功能。现今已有大量关于黄酮氧苷结构、分布、生物合成、药理活性及生物学功能等方面的研究,但是关于黄酮碳苷的综述鲜见报道。本研究对黄酮碳苷的相关研究进展进行了综述,以期为黄酮碳苷的进一步开发利用提供依据。
1 黄酮碳苷的结构
黄酮碳苷的类型可以由黄酮母体结构、糖基类型、糖基数目以及酰基修饰决定,按黄酮母体结构可分为黄酮、异黄酮、黄烷酮、黄酮醇、二氢查耳酮、酮和双黄酮等苷元类型;糖基供体有葡萄糖、鼠李糖、芹糖、木糖、阿拉伯糖、半乳糖等,糖基的连接位置主要在黄酮母体A 环的6 位和8 位,此外也有一些糖基连接在C 环C-3 位和B 环C-4′位的碳苷结构[4,13]。黄酮碳苷的主体主要是以木犀草素、芹菜素为母体,在其A 环6、8 位连接糖基,形成单碳苷黄酮或双碳苷黄酮,详见图1,部分以葡萄糖为糖基的单碳苷黄酮在其葡萄糖2、4、6 位连接葡萄糖、木糖、鼠李糖形成二糖或双二糖碳苷黄酮或葡萄糖的2 位被3,4,5-三羟苯甲酰基、乙酰基、咖啡酰基等酰基取代的黄酮碳苷[5,14]。较为常见及被广泛研究的黄酮碳苷有(异)牡荆素、(异)荭草素、牡荆素-2"-O-木糖苷、(异)夏佛托苷、胡芦巴苷Ⅱ、葛根素、红花苷、maysin 等[3-6]。近年来,也有一些新型黄酮碳苷衍生物被报道,例如:牡荆素2′′-O-(4‴-乙酰鼠李糖苷)、獐牙菜素2′′-O-(4‴-乙酰鼠李糖苷)和芹菜素7,4′-二甲醚6-C-β-鼠李糖苷-(1 →2)-木糖苷、2‴,4‴-O-二乙酰基恩比宁和6′′,4‴-O-二乙酰基恩比宁等[7,15]。
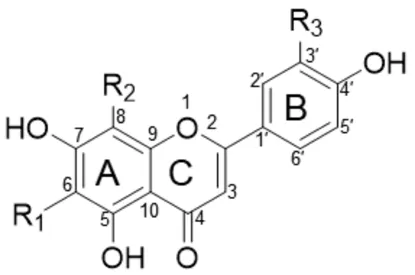
图1 主体黄酮碳苷母核及代表性结构Fig.1 Main flavonoid C-glycosides parent nucleus and representative structures
2 黄酮碳苷资源分布
黄酮碳苷是碳苷中数量最多的一类,广泛分布于被子植物中,在少数苔藓类、藻类以及裸子植物等低等植物中也有发现,其中分布最广的有牡荆素、异牡荆素及其衍生物[3]。目前至少在70 个科的300 余个物种中发现了黄酮碳苷类化合物的存在,在禾本科、豆科和菊科中的分布报道最多,详见表1。尤其值得注意的是,黄酮碳苷作为膳食黄酮在禾本科中含量丰富,且主要分布在植株的叶片、果皮和谷物等地上部分。

表1 黄酮碳苷分布植物表Tab.1 The distribution of flavonoid C-glycosides in plants
3 黄酮碳苷的生物合成
3.1 黄酮碳苷生物合成途径
大多数黄酮碳苷来源于植物,是类黄酮生物合成途径的产物,位于苯丙素生物合成途径的下游。该途径首先由苯丙氨酸解氨酶PAL 通过非氧化脱氨反应酶C4H 和4-香豆酰辅酶A 连接酶4CL 的作用下生成柚皮素查尔酮的前体——4-香豆酰辅酶A,查尔酮合酶CHS 是黄酮类化合物合成的起始酶,其产物柚皮素查尔酮通过查尔酮异构酶CHI 转化为柚皮素,柚皮素在黄酮合成酶FNS/黄酮2 位羟化酶F2H 的作用下生成黄酮芹菜素/黄烷酮2-羟基柚皮素,而糖基化是合成黄酮碳苷的最后一步。黄酮碳苷的生物合成途径可分为两条[20-21,46-48],详见图2。
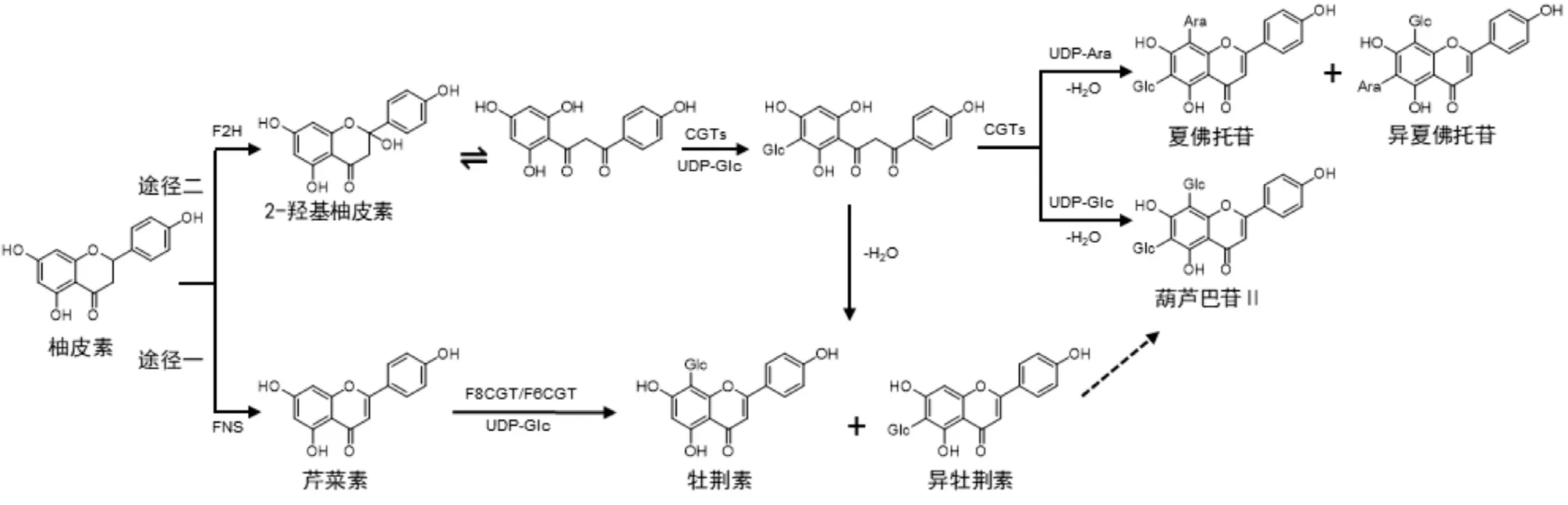
图2 黄酮碳苷的两种生物合成途径Fig.2 Two biosynthetic pathways of flavonoid C-glycosides
3.2 黄酮碳苷生物合成过程中的关键酶
黄酮碳苷生物合成的最后一步由C-糖基转移酶CGTs(C-glycosyltransferase)催化,此步骤是区别黄酮碳苷与其它黄酮(黄酮苷元、黄酮氧苷)的关键步骤。CGTs 属于GT1 即糖基转移酶家族I,GT1 是最大的糖基转移酶家族,以尿苷5'-二磷酸作为糖供体,受体可以是萜类、类黄酮、皂苷、植物激素和外源性物质等,其结构特征是C 端具有一个高度保守的44 个氨基酸组成的一致序列,称为植物次生产物糖基转移酶(PSPG)盒子[47-49]。
2009 年,水稻中首次报道了CGTs,发现其以2-羟基黄酮为底物生成黄酮碳苷[50];催化黄酮二-C-糖苷糖基化的CGT 在柑橘属植物中首次发现,并解析了其晶体结构[51],至今共有8 种植物源CGTs(TcCGT1, GgCGT, SbCGTa, SbCGTb, LpCGTa,LpCGTb, ZmCGTa, FeCGTa)的晶体结构被解析。2020 年,SUN Y 等[52]发现了部分禾本科作物存在708 家族基因串联现象,表征了禾本科30 条CGTs(部分属于双功能C-葡萄糖/C-阿拉伯糖基转移酶),并实现了黄酮碳苷在大肠杆菌细胞工厂的生产,产量达20 ~ 40 mg/L,此外,该团队还发现了单子叶植物和双子叶植物之间UGT708 家族的明显分化和禾本科植物特有的UGT708A 家族的分化;同年,XIE K B 等[47]发现了可以催化间苯三酚结构底物的糖基转移酶,AbCGT 表现出了对底物和糖供体的杂泛性;2022年,首个来源于蕨类的ScCGT1 被报道,其P164T突变体通过与糖供体形成氢键增加了酶活性[53]。
由于CGTs 的基因序列相似性较低等原因,迄今为止,植物中只有67 条CGTs 的功能被验证,目前报道的属于第一种类型的CGTs 只有4 条,其余均属于第二类,且在进化上都属于UGT708 家族[1],但不同植物中UGT708 家族CGTs 的功能具有差异性,部分甚至具有一些非黄酮类底物催化活性,通过关键氨基酸位点的突变,已实现C-糖基化向O-糖基化功能的转变以及黄酮二-C-糖苷的糖基化向黄酮单-C-糖苷的糖基化功能的转变[46-48,51]。见表2。

表2 植物来源已表征功能的CGTsTab.2 The functional CGTs previously characterized from plants
3.3 黄酮碳苷生物合成的调控
关于黄酮碳苷类化合物的调控鲜有报道,MOROHASHI K 等[66]发现P1 编码R2R3-MYB 转录因子,P1 为玉米须中黄酮碳苷maysin 积累的主要数量性状位点,负责玉米中maysin 的积累,染色质免疫沉淀结合高通量测序证明P1 可能通过靶向调控F2H 来调控黄酮碳苷的合成,并且P1 可能是类黄酮生物合成途径的主要调节因子;而最近YANG Y 等[67]发现转录因子QFcDof4 和FcDof16 可靶向调控FcCGT以增加黄酮碳苷的生成。
4 黄酮碳苷的生物学功能
4.1 促产卵作用
凤尾蝶的幼虫只以柑橘属及芸香科其他一些属植物为食,且雌蝴蝶非常精准的在寄主植物的嫩叶上产卵,OHSUGI T 等[68]从柑橘的提取物中分离到一种黄酮二碳苷类促产卵物质胡芦巴苷Ⅱ。
4.2 雄性生育能力
类黄酮在一些植物物种中是雄性生育能力所必需的,为了探索与雄性生育能力有关的类黄酮,有学者对水稻突变体的下游类黄酮途径分支点酶进行了详细分析,包括黄酮3-羟化酶(OsF3H;黄酮醇途径进入酶)、黄酮合成酶II(CYP93G1;黄酮途径进入酶)和黄酮2-羟化酶(CYP93G2;黄酮碳苷途径进入酶)。研究结果表明不同种类(黄烷酮、黄酮醇、黄酮和黄酮碳糖苷)的组合对于水稻的雄性完全生育能力至关重要[8]。
4.3 抗食性
褐飞虱、白背飞虱和纹飞虱在植物薄壁细胞组织中表现出刺探行为特征,KIM M 等[9]从水稻中分离鉴定出夏佛托苷、刺苞菊甙等8 种黄酮碳苷作为飞虱刺探的刺激物。另外,研究者发现在喂养含夏佛托苷250和500 μg/mL 的人工饲料时,飞虱幼虫分别在10 d 和5 d 后死亡,而在喂养缺乏夏佛托苷的对照饲料时,有20%的幼虫在11 d 后仍存活[69]。推测黄酮碳苷类成分既作为口针刺探的刺激物,又作为吸食的抑制剂。
4.4 抗虫剂
RECTOR B G 等研究表明与低maysin 玉米须饲料、无maysin 玉米须饲料和无玉米须对照饲料相比,高maysin 玉米须饲料显著减缓了棉铃虫所有菌落幼虫的生长和发育[70]。
4.5 化感作用
豆科植物银叶山蚂蝗作为玉米间作作物能显著减少玉米被寄生的菟丝子侵袭。HOOPER A M 等[10]用生物测定法对银叶山蚂蝗的根提取物进行分离,发现抑制菟丝子生根生长的活性成分主要为异夏佛托苷。
4.6 抗真菌作用
MCNALLY D J 等[11]发现黄酮碳苷类化合物作为植保素在黄瓜真菌防御策略中发挥重要作用,并推断黄酮碳苷可能会对真菌蛋白质的正常功能产生不利影响,从而使黄瓜植株对白粉病产生抗性。
4.7 共色作用
只有少数花色素作为色素发色团被发现,黄酮碳苷可作为共色素参与花色形成。GOTO T 等[71]阐明了康乃馨花颜色转变为蓝色的原因,并通过光谱鉴定了几种类黄酮共色素,其中黄酮碳苷类的共色素效应最强。HONDO T 等[72]从鸭跖草的深蓝色花瓣中分离出一种以晶体形式存在的鸭跖草苷,它由3 种成分([M6F6Mg2]6-)组成,其中,F 是一种黄酮碳苷类共色素。结合已报道文献,推测黄酮碳苷可能作为共色素参与许多蓝色花系植物的花色形成,并在稳定花色中发挥重要作用。
4.8 淹水胁迫
WANG T 等[73]通过广泛靶向代谢组学发现杭菊在不同生长期的总黄酮积累量不同,大部分黄酮碳苷在淹水胁迫后的两个阶段均显著增强。
4.9 UV-B 胁迫
为了应对暴露于破坏性的UV-B 辐射,植物进化出了紫外线诱导的保护和修复机制,如积累吸收紫外线的化合物。CASATI P 等[74]发现高海拔玉米植株通过在叶片中积累吸收紫外线的黄酮碳苷异牡荆素和maysin 等来响应UV-B 辐射。
4.10 低温胁迫
URRUTIA M 等[12]通过蛋白组和代谢组关联分析发现不同基因型玉米对冷胁迫反应相似,温度从20℃降到16℃、13℃、8.5℃,鉴定到包括黄酮碳苷在内的多种差异代谢物,田间实验验证确定了包括异牡荆苷在内的几个响应冷胁迫的候选代谢物和蛋白质,可以作为预测田间早播的生物标记物。
5 结语
黄酮碳苷具有广泛的药理活性和生理作用,然而作为黄酮类化合物的重要组成部分,对于黄酮碳苷的研究却远不及其他黄酮类化合物(苷元、氧苷)深入。黄酮碳苷类化合物在植物中分布较广,且不同物种中的CGTs 具有功能差异性,利用这一特性可在植物体或工程菌株中高效特异的合成目标黄酮碳苷或其他具有药理活性的新型黄酮碳苷。此外,黄酮碳苷广泛的生物学功能可应用于蓝色系花色的园艺植物培育以及中药抗性品种的分子育种等。为更好的利用黄酮碳苷的CGTs 及其广泛的生物学功能,CGTs 的催化机制及其基因水平的网络调控机制亟待进一步研究。

