SPE 结合UPLC-MS/MS 同时测定半夏曲中24 种真菌毒素含量
南文萍,倪 倩,张 俐,孙 晶,冯有龙*
(1.南京中医药大学 药学院,江苏 南京 210023;2.江苏省食品药品监督检验研究院,江苏 南京 210019)
半夏曲是由天南星科植物半夏Pinellia ternata(Thunb.)Breit 及其辅料发酵而来的曲剂。半夏制曲后可降低半夏的毒性,增强燥湿化痰、消积止泻的功效,用于治疗脾虚、消化不良、咳嗽痰多等症。目前半夏曲的炮制大多采用自然发酵工艺,发酵效果受自然菌种和环境温湿度影响,发酵质量不稳定,存在引入杂菌的风险,进而导致真菌毒素的污染[1]。真菌毒素超标不仅影响中药的质量,而且对人体具有致癌致畸危害[2]。已有研究在发酵类中药如六神曲、淡豆豉、红曲中检出黄曲霉毒素B1(aflatoxin B1,AFB1)[3]、脱氧雪腐镰刀菌烯醇(deoxynibalenol,DON)[4]、桔青霉素(citrinin,CIT)[5]。但已有方法检测的真菌毒素种类有限,大多为常见的真菌毒素,且鲜有半夏曲中多种真菌毒素检测的相关报道。
目前,随着质谱技术在真菌毒素检测中的应用,超高效液相色谱串联质谱(UPLC-MS/MS)法具有特异性强、灵敏度高的特点,广泛适用于中药中多种真菌毒素的痕量检测[6-8]。中药基质复杂,杂质种类多,固相萃取(SPE)技术基于固液色谱分离的原理使目标物与杂质分离,以达到净化目的,可用于多种真菌毒素的净化[9]。因此,本实验拟建立一种基于SPE结合UPLC-MS/MS 技术的半夏曲中24 种真菌毒素快速定量分析方法,并利用所建立的方法对实际样品进行检测,为考察半夏曲中真菌毒素的污染情况及完善和评价其质量及探索临床安全用药提供保障。
1 仪器与试药
1.1 主要仪器
ExionLC 型超高效液相色谱、AB QTRAP 4500 LC/MS/MS(美国SCIEX 公司);MSE224S 型万分之一天平(德国Sartorius 公司);Sorvall ST 16R 型台式冷冻型离心机(德国Thermo Scientific 公司);Auto EVA-60 型全自动平行浓缩仪[睿科集团(厦门)股份有限公司)];MX-S 型涡旋混合仪(美国Scilogex公司);T 18 digital 型高速分散机(德国IKA 公司)。
1.2 药物与试剂
10 种真菌毒素混合标准品溶液和14 种单标对照品溶液(纯度均≥98.3%)均购自天津阿尔塔公司。乙腈和甲醇(HPLC 级)均购自德国Merck 公司;甲酸(HPLC 级)购自美国ACS 恩科化学公司;甲醇和乙腈(分析纯)购自国药集团化学试剂有限公司。Oasis HLB(60 mg/3 mL)固相萃取柱购自美国Waters 公司;MycoSep 226、MycoSep 229 净化柱均购自Romer 国际贸易(北京)有限公司;MFC100 固相净化柱购自青岛普瑞邦生物工程有限公司。共收集10 批次半夏曲,经江苏省食品药品监督检验研究院胡浩彬主任中药师鉴定为天南星科半夏属植物半夏Pinellia ternata(Thunb.)Breit 经发酵炮制的曲剂。
2 方法
2.1 色谱-质谱条件
色谱条件:Poroshell 120 EC-C18色谱柱(150 mm×2.1 mm,2.7μm),柱温为35 ℃;流速为0.5 mL/min;进样体积为5μL;流动相A 为0.1%甲酸-水溶液(V/V),B 为乙腈。梯度洗脱:0.0 ~ 4.0 min,5%→40%B;4.0 ~ 11.0 min,40%→45%B;11.0 ~ 16.0 min,45%→90%B;18.0 ~ 18.1 min,90%→5%B;18.1 ~20.0 min,5%B。
质谱条件:电喷雾电离源(ESI);喷雾电压为5 500V(+)/4 500V(-);毛细管温度为500℃;气帘气压力(CUR)为1.72×105Pa;碰撞气电压强度为Low。分段多反应监测模式。24 种真菌毒素检测的质谱参数见表1。MRM 图见图1。

图1 24 真菌毒素的MRM 图Fig.1 MRM of the 24 mycotoxins

表1 24 种真菌毒素的质谱参数Tab.1 MS parameters of the 24 mycotoxins
2.2 样品前处理
样品用研磨机研磨成粉末,过二号筛,临用前取出。准确称取样品粉末2.0 g,精密加入84%乙腈-水溶液20 mL,12 000 r/min 高速搅拌3 min,5 000 r/min离心10 min,吸取上清液4 mL,加水稀释至10 mL,涡旋混匀。精密吸取3 mL 缓慢通过活化的Oasis HLB柱(依次用甲醇和水各3 mL 洗脱),收集洗脱液,随后加2 mL 水淋洗,弃去淋洗液,再依次加入3 mL 90%甲醇-水溶液、3 mL 甲醇洗脱,收集洗脱液。合并洗脱液,40℃氮吹至近干。加40%甲醇-水溶液定容至2 mL,涡旋混匀,过0.22 μm 微孔滤膜,收集续滤液至进样瓶,待测。
2.3 对照品溶液的配制
分别精密吸取24 种真菌毒素对照品适量,置20 mL 棕色容量瓶中,加水定容至刻度,摇匀,配制成储备液,于-20℃冰箱中保存、备用。精密吸取混合对照品储备液适量,加40%甲醇配制成适当浓度的系列对照品溶液,24 种真菌毒素储备液和系列对照品溶液浓度见表2。

表2 24 种真菌毒素储备液和系列对照品溶液浓度(ng/mL)Tab.2 Concentration of 24 mycotoxins reserve solution and serial reference solution(ng/mL)
3 结果
3.1 专属性试验
取经预先筛查,未检出目标真菌毒素的空白样品,按“2.2”项下方法制备空白基质溶液,40%甲醇做空白溶液。分别取空白溶液和空白基质溶液稀释混合对照品储备液,配成相同浓度的混合对照品溶液和空白基质对照品溶液。分别将空白溶液、空白基质溶液、对照品溶液和空白基质加标样品溶液按“2.1”项下条件进样检测,色谱图见图2。结果显示,空白基质的离子峰与不与对照品离子峰重叠。空白基质不干扰真菌毒素的测定。

图2 溶液UPLC-MS/MS 总离子流色谱图Fig.2 Chromotogram of solution UPLC-MS/MS total ion
3.2 基质效应考察试验
按“2.2”项下方法制备空白基质溶液,用该空白基质溶液稀释得到对照品储备液,配制一系列相同浓度梯度的溶液,上机检测。得到基质匹配标准曲线和外标法标准曲线。两者曲线斜率分别记为Sm 和Ss,以信号抑制或増强效应(Suppression/Enhance-ment,SSE)体现基质效应:SSE = Sm/Ss×100%。SSE ≈ 100%,表明基质效应不显著,SSE<100%表明存在基质抑制效应,SSE >100%表明存在基质増强效应。半夏曲基质效应见表3。结果显示,HT-2 的SSE 为63.9%,存在基质抑制效应、AFM1的SSE 为126.1%,OTC 的SSE 为155.67%,存在基质促进作用。为保证24 种真菌毒素的准确定量,应采用基质匹配的标准曲线进行测定。
3.3 基质匹配标准曲线线性关系、检测限、定量限检测试验
取经预先筛查未检出上述目标真菌毒素的样品,按供试品方法制备空白基质溶液。取适量对照品储备液,加空白基质溶液配制不同浓度的系列空白基质对照品溶液,按优化的液质条件测定。以峰面积(Y)为纵坐标,浓度(X,ng/mL)为横坐标建立24 种真菌毒素标准曲线。以信噪比S/N ≥3 计算检出限(LOD),以S/N ≥10 计算定量限(LOQ)。半夏曲基质匹配标准曲线线性关系、检测限和定量限检测见表3。24种真菌毒素线性相关系数 (r)为0.998 8 ~ 1.000 0,LOD 为0.02 ~ 4.17μg/kg,LOQ 为0.03 ~ 9.92μg/kg。低于2020 年版《中国药典》[10]、国家标准[11]及欧盟委员会[12]真菌毒素限量要求。
3.4 精密度试验
精密吸取同一空白基质线性对照品溶液,连续进样6 次,记录峰面积,计算RSD 值。结果如表3 所示,RSD 为0.68% ~ 6.48%,均小于10%,表明仪器精密度良好。
3.5 加标回收率试验
取经预先筛查未检出上述目标真菌毒素的样品,分别在空白样品中添加100、500、1 000μL 的混合对照品储备液,进行低、中、高浓度三个水平的加标回收率试验,每个水平平行制备3 份,按“2.2”项下方法制备供试品溶液,进样检测,测定峰面积,计算回收率和RSD。结果见表4。各水平加标回收率为69.20% ~ 118.20%,RSD <13%,符合AOAC 和2020 年版《中国药典》分析方法验证指导原则限度要求[10,13]。
3.6 稳定性试验
精密吸取同一份中浓度水平加标供试品溶液,分别于0、2、4、8、12、24 h 进样检测。记录峰面积并计算RSD。结果如表4 所示,24 种真菌毒素RSD为1.93% ~ 8.21%,表明供试品在24 h 内基本稳定。
3.7 重复性试验
取经预先筛查,未检出上述目标真菌毒素的样品,样品中添加500μL 的混合对照品储备液,按“2.2”项下方法制备供试品溶液,平行制备6 份,进样分析。记录峰面积并计算RSD。结果如表4所示,24 种真菌毒素RSD 为1.33% ~ 10.36%,符合AOAC和2020 年版《中国药典》分析方法验证指导原则限度要求[10,13]。
3.8 样品检测
采用建立的方法对半夏曲饮片中真菌毒素进行检测,结果见表5。10 批样品共检出8 种真菌毒素。2020 年版《中国药典》规定AFB1不得过5μg/kg,AFB1、AFB2、AFG1、AFG2总和不得过10μg/kg。薏苡仁药材中ZEN 不得过500μg/kg[10]。暂未规定中药中其他真菌毒素的限量标准,国家标准及欧盟委员会均规定食品中DON 不得过1 000μg/kg,食品中FB1与FB2总和不得过1 000μg/kg[11-12],欧盟委员会规定甘草根及其浸渍物中OTA 不得过20 μg/kg[13]。参照相关标准,10 批样品中真菌毒素含量未超出限度,但仍提示需要关注半夏曲中真菌毒素的污染。
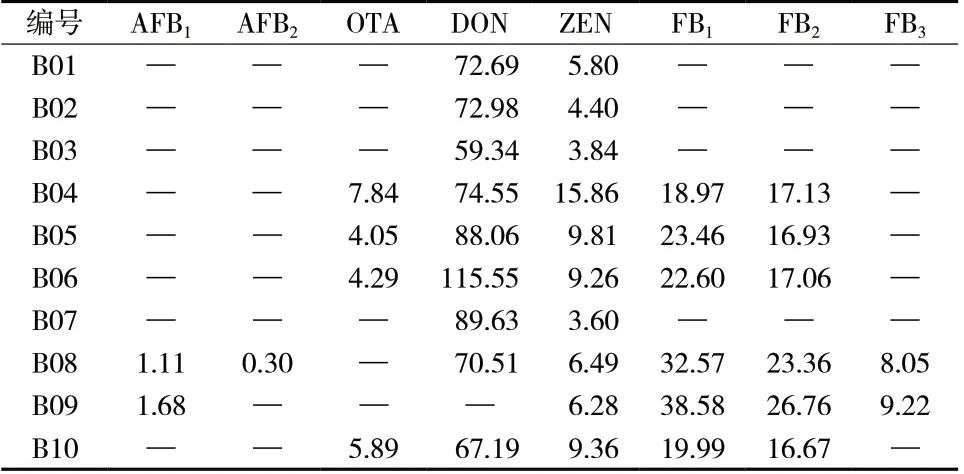
表5 半夏曲样品中真菌毒素含量测定结果(μg/kg,n = 3)Tab.5 Results of mycotoxins in Rhizoma Pinelliae Fermentata samples(μg/kg,n = 3)
4 讨论
4.1 24 种真菌毒素选择依据
《四川省中药饮片炮制规范》规定半夏曲需检查黄曲霉毒素项目[14],这提示需要关注半夏曲中黄曲霉毒素污染。根据2020 年版《中国药典》中真菌毒素同时测定法中真菌毒素名单,有常见的黄曲霉毒素类、赭曲霉毒素类、伏马毒素类、玉米赤霉烯酮类、单端孢霉烯族毒素A 型和B 型6 大类共10 种真菌毒素。本研究在此基础上增加同类真菌毒素的检测,全面考察半夏曲中真菌毒素的污染。ST 作为一种致癌真菌毒素,其代谢产物O-甲基-杂色曲霉素是AFB1、AFG1的前体物质,因此ST 可能伴随黄曲霉毒素同时存在[15]。CIT 在曲类中药的红曲中有大量检出[5]。因此,考虑增加ST 和CIT 检测。最终选择24种真菌毒素以综合评价半夏曲中真菌毒素污染情况。
4.2 色谱条件的选择
本研究分别考察了水-乙腈、水-甲醇、5 mmol/L乙酸铵-乙腈、5 mmol/L 乙酸铵-甲醇、0.1%甲酸-甲醇、0.1%甲酸-乙腈流动相体系。实验结果显示:乙腈的分离效果和离子化效率优于甲醇。水相中添加0.1%甲酸能提高FB1、FB2、FB3等化合物的离子化效率,并改善部分化合物峰型。因此,选择0.1%甲酸-乙腈为流动相体系。同时比较了3 种真菌毒素常用色谱柱对24 种真菌毒素的分离情况,分别为Agilent Poroshell 120 EC-C18(150 mm×2.1 mm,2.7μm)、ACE Excel(100 mm×2.1 mm,1.7μm)和Waters ACQUITY UPLC BEH Shield RP18(100 mm×3 mm,1.7μm)。结果表明,ACE Excel 柱和BEH柱造成了CIT 拖尾,而Agilent Poroshell 柱分离后化合物分离效果较好,CIT 峰型改善。因此,选择Poroshell 120 EC-C18作为最终的分析柱。
4.3 提取溶剂的选择
真菌毒素常用的提取溶剂为甲醇[16]、乙腈[17]与水的混合溶液。本研究比较84%乙腈-水、70%乙腈-水、80%甲醇-水、70%甲醇-水的提取效率。结果发现,84%乙腈-水对半夏曲基质中各真菌毒素回收率较好,有21 种真菌毒素的回收率在70% ~120%,AFM1、AFM2、OTC 有适当的基质增强效应,可通过净化过程降低基质增强效应。因此选择84%乙腈-水作为提取溶剂。
4.4 净化方法的选择
MycoSep 226 多功能净化柱[18]、Oasis HLB 固相萃取柱[19]等固相萃取柱常用于真菌毒素的净化。本实验比较了MycoSep 226、MycoSep 229、MFC100 与Oasis HLB 柱对实验结果的影响,考察四种固相萃取柱对24 种真菌毒素的回收率。结果显示,Oasis HLB柱整体净化效果好。进一步优化Oasis HLB 柱淋洗剂和洗脱剂的选择,采用2 mL 水淋洗后,依次用3 mL 90%甲醇-水溶液、3 mL 甲醇洗脱后净化效果较好,回收率满足实验要求。
5 结论
基于SPE 结合UPLC-MS/MS 建立了半夏曲中24种真菌毒素的检测方法。与传统方法相比,本方法扩大真菌毒素种类,缩短检测周期,满足相关标准对真菌毒素的限度要求,可实现半夏曲中24 种真菌毒素的定性和定量分析,为完善其质量标准、保证临床安全用药提供依据,也为其他发酵类中药中真菌毒素的检测提供参考。

