siRNA 干扰对人软骨细胞Skp2 表达的影响
袁长深,李彦宏,刘晋邑,廖书宁,梅其杰,徐文飞,段 戡
(1.广西中医药大学第一附属医院四肢骨伤科,广西 南宁 530023;2.广西中医药大学研究生院,广西 南宁 530000)
S 期激酶相关蛋白2(S-phase kinase associated protein,Skp2)是一种癌症相关蛋白,主要位于细胞核和细胞质中,可在骨髓等组织中广泛表达(https://www.ncbi.nlm.nih.gov/gene/6502#geneexpression)。Skp2 作为细胞周期的关键调节剂,可促进细胞从G1期向S 期的转换,对肿瘤的发生、发展密切相关[1,2];甚至认为靶向Skp2 通路是癌症治疗的关键靶点[1]。然而,Skp2 在非肿瘤中,特别在骨关节炎(osteoarthritis,OA)中的作用机制仍不明确。
RNA 干扰(RNA interference,RNAi)可导致靶基因序列中同源双链RNA 引起一种特异性转录后的基因沉默现象[3];RNAi 具有序列特异性、高效性、药物毒性小等特点,可参与调控细胞增殖、分化、凋亡,影响非肿瘤与肿瘤的发病[4]。RNAi 已成为基因功能研究,甚至癌症基因治疗的重要手段。目前小干扰RNA(small interfering RNA,siRNA)技术已被用于食管癌[5]、胰腺癌[6]、喉癌[7]、肺癌[8]等研究,但在OA 中的报道鲜为少见。
因此,本研究通过设计合成针对siRNA 转染人软骨细胞,观察Skp2 在人软骨细胞中蛋白表达情况及基因沉默后对人软骨细胞作用,为OA 进一步基因靶向治疗提供依据。
1 材料与方法
1.1 材料
人软骨细胞完全培养基(CM-H107,普诺赛);IL-1β(CG93,novoprotein);FBS(10099-141,Gibco);Lipofectamine 3000 Transfection Reagent(L3000015,Invitrogen);OPTI-MEM 培养基(31985-062,Gibco);胰蛋白酶-EDTA 消化液(T1300,Solarbio);1×PBS(0.01 mol/L,pH7.4)(KGB5001,凯基生物);CCK-8 法细胞增殖检测试剂盒(KGA317,凯基生物);内参:β-actin;Skp2 siRNA-318,Skp2 siRNA-504,Skp2 siRNA-59(洪博元分子实验室提供);Trizon Reagent(CW0580S,CWBIO);超纯RNA 提取试剂盒(CW0581M,CWBIO);HiScriptⅡ QRT SuperMix for qPCR(+gDNAwiper)(R223-01,Vazyme);ChamQ Universal SYBR qPCR Master Mix(Q711 - 02,Vazyme);50×TAE 缓冲液(T1060,Solarbio);6×DNA Loading Buffer(GH101-01,TRANS);50 bp DNA Ladder(MD108,TIANGEN);Gsafe Red plus 核酸染料(GK20002,GLPBIO);琼脂糖粉(75510-019,Invitrogen)。
1.2 方法
1.2.1 siRNA 设计及载体构建 根据基因库Genebank 中提供人类Skp2(NM_001243120,Gene ID:6502)序列,通过https://www.ncbi.nlm.nih.gov/网站在线siRNA 设计工具设计三条siRNA。设计基因靶点是在NS 基因的第59、318、504 位点,靶点序列 分 别 是 :Skp2 (human )siRNA - 59 :CAAAAAACUCAAAUUUAGUTTACUAAAU -UUGAGUUUUUUGTT ;Skp2 (human )siRNA-318:CCAUCUAGACUUAAGUGAUTTAUCACUUAAGUCUAGAUGGTT;Skp2 (human)siRNA - 504:CCUUCAACUGUUAAAGGAATTUUCCUUUAACAGUUGAAGGTT;并设置阴性对照siRNA:UUCUCCGAACGUGUCACGUTTACGUGACACGUUCGGAGAATT 和空载组。与任何基因序列均无同源性,以上序列均由江西中洪博元生物技术有限公司合成。模板链两端分别设计SacⅠ和XhoⅠ酶切位点,载体构建名称:YCSWT-Skp2-Pmi-rGLO,将结合位点进行突变,将突变目的基因片段进行生物合成,与pmirGLO 载体相连,载体构建名称为YCS-UMT-Skp2-pmirGLO。使用SacⅠ和XhoⅠ双酶切突变YCS-UMT-Skp2-pmirGLO 质粒,在pmirGLO 载体上连接目的片段。将2 个多聚核苷酸片段置于37 °C 条件下酶切30 min 后,进行1%琼脂糖凝胶电泳分离得到条带。紫外灯下切下线性化的条带,应用琼脂糖DNA 回收试剂盒,回收线性化的载体并发生连接反应的体系如下:目的质粒(50 ng)1 μL,pmirGLO-F 0.5 μL,pmirGLO-R 0.5 μL,2× ES Taq Master Mix(Dye)12.5 μL,去离子水10.5 μL。连接产物分别命名为:siRNA-59、siRNA-318、siRNA-504 和NC(阴性对照质粒)。
1.2.2 细胞转染 本实验分为5 组:空载组、NC 组、Skp2 siRNA-59 组、Skp2 siRNA-318 组、Skp2 siRNA-504 组。首先,在6 孔板上植入细胞,每个孔约2×105~10×105个细胞,6 cm 皿每孔约5×105~2×106个细胞。当细胞密度达到70%时,准备转染;用容量为1 mL 的无血清培养基取代细胞培养基;其次,取2 支灭菌EP 管,每支加入125 μL Opti-MEM,其中1 支加入5 μL lipofectamine 3000,另1 支加入12.5 μL siRNA 或者miRNA(siRNA 或者miRNA 干粉使用DEPC 水溶解;125 μL/1OD),混匀后室温孵育5 min;最后,将以上2 支EP 试管混匀,在室温孵育15 min 后,把混合溶液滴入6 孔板相应小孔中,将细胞移回室温孵育。当转染4~6 h 后,将1 mL 含20%血清完全培养基加到6 孔板中,在48 h 后进行后续实验。
1.2.3 RT-PCR 检测Skp2mRNA 表达水平 对人软骨细胞总RNA 进行RT-PCR 检测,根据TRIzol操作说明书进行总RNA 提取,用紫外分光光度仪从38 μL 体系的总RNA 溶液中抽取1.3 μL,在OD260和OD280下测定数据并记录。RNA 浓度和纯度分别由OD260×40=RNAng/μL 公式、1.8≤OD260/OD280≤2.2 公式计算。提取总RNA 进行琼脂糖凝胶电泳,进行RNA 跑胶,电压200 V,电流180 mA 左右,时间13 min 左右,取出凝胶,化学发光成像系统仪在显影后进行图像采集。根据HiScript Ⅱ QRT SuperMix for qPCR 逆转录试剂盒操作方法获得到单链cDNA。PCR 反应体系:2×miRNA Universal SYBR qPCR Master Mix 10 μL,cDNA 模板1 μL,引物各0.4 μL,去DEPC 水8.2 μL 总体积20 μL。PCR 条件为:95 ℃预变性10 min;95 ℃变性10 s;58 ℃(β-actinF、β-actinR 为58 ℃,Skp2F、Skp2R 为60.5 ℃)退火30 s,72 ℃延伸30 s,40 个循环。PCR产物琼脂糖凝胶电泳,超高灵敏度的化学发光成像系统仪所获取的影像,以β-actin为内参,引物名称及序列见表1。
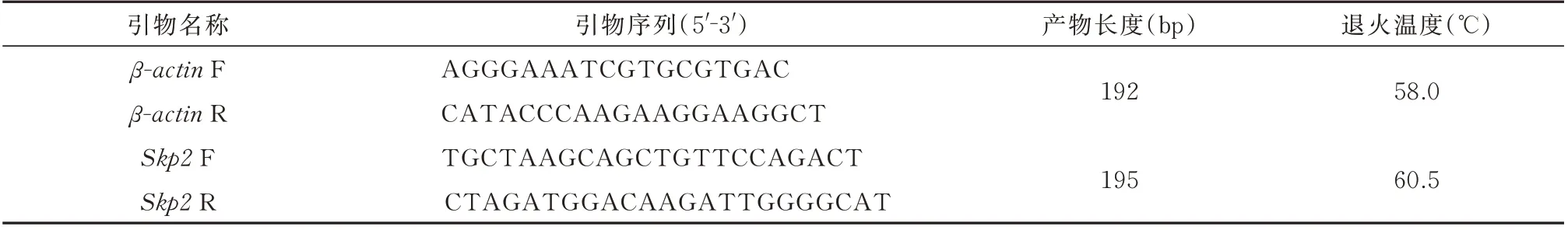
表1 引物名称及序列Tab 1 Names and sequences of primers
1.2.4 细胞增殖抑制率检测 先将细胞贴壁后加药24 h,将待测96 孔板细胞用相同的培养基,每孔100 μL;并在每个孔中添加10 μLCCK8 试剂,然后放入培养箱孵化2 h,酶标仪检测450 nm 波长下各孔吸光值(IOD 值)。当细胞贴壁后加药24 h,再把待测96 孔板细胞用相同培养基,100 μL/孔培养基替换;Skp2mRNA 表达抑制率(%)计算方法为:1-siRNA 组Skp2mRNA/NC 组Skp2mRNA×100%。
1.2.5 统计学处理 运用SPSS 18.0 软件进行统计分析,组间用t检验和普通单因素方差分析比较均数,实验数据采用均数±标准差(±s)表示,P<0.05 为差异有统计学意义。
2 结果
2.1 重建质粒的酶切鉴定及测序鉴定
YCS-WT-Skp2-pmirGLO、YCS-MUT-Skp2-pmirGLO 载体通过PCR 扩增后的条带为578 bp,见图1,电泳检测结果和理论值吻合相似,测序结果和设计的DNA 片段序列完全一致,证实均为正确质粒,得到的重组干扰质粒的目的片段完全相符预期。
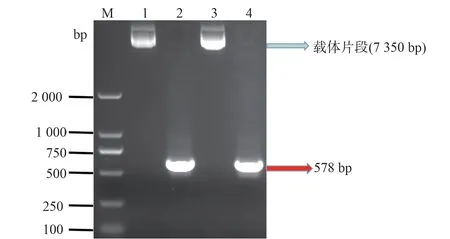
图1 琼脂糖凝胶电泳检测PCR 产物条带大小Fig 1 Agarose gel electrophoresis detection of PCR products stripe size
2.2 重组质粒转染对Skp2 mRNA 表达的影响
重组质粒经转染后,siRNA-59、siRNA-318 和siRNA-504 转染组Skp2mRNA 表达明显低于NC组,具有显著性差异(P<0.05),且以siRNA-504Skp2mRNA 表达最低;而空载组和NC 组比较,差异具有统计学意义(P<0.05),siRNA 干扰后实验各组Skp2 mRNA 表达量,见表2;重组质粒转染对Skp2mRNA 表达的影响见图2。同时,进一步采用DNA 电泳对其结果进行验证,其结果与各组重组质粒转染后Skp2mRNA 结果一致。空载组、NC 组、siRNA-59 组、siRNA-318 组和siRNA-504 组表达量从左至右,分组顺序与浓度测定一致,β-actin、Skp2条带亮度正常且位置正确,为目的产物,见图3。
图2 重组质粒转染对Skp2 mRNA 表达的影响Fig 2 Effect of recombinant plasmid transfection on Skp2 mRNA expression
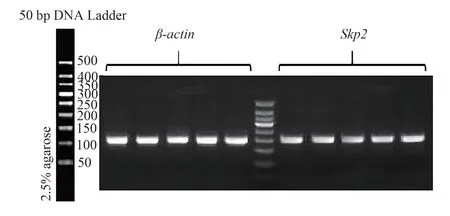
图3 DNA 电泳结果Fig 3 DNA electrophoresis results
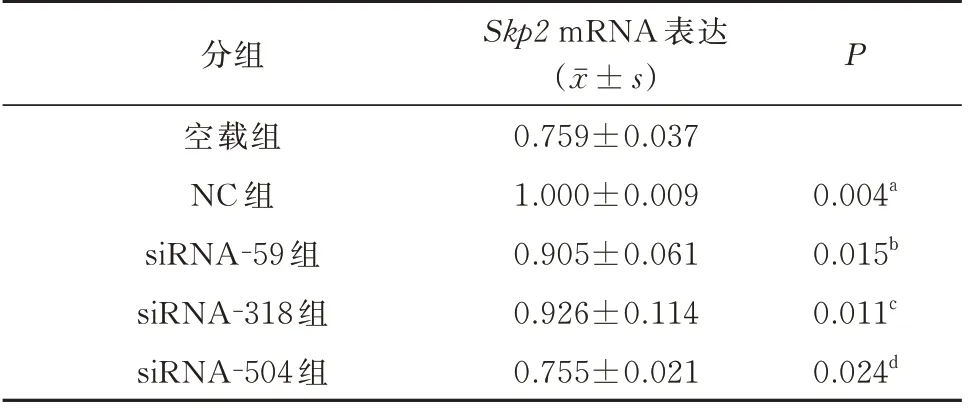
表2 siRNA 干扰后实验各组Skp2 mRNA 表达量(n=3)Tab 2 Skp2 mRNA expression quantity after siRNA interference in all experimental groups(n=3)
2.3 细胞增殖抑制率检测
细胞增殖抑制率检测:采用1-siRNA 组Skp2mRNA/NC 组Skp2mRNA×100%,计算出siRNA-59 组、siRNA-318 组、siRNA-504 组的细胞增殖抑制率,结果分别为:60%、41%、64%,其中以siRNA-504 组的细胞增殖抑制率最为显著。
3 讨论
1998 年,Fire 等[9]首次发现双链RNA(doublestranded RNA,dsRNA)是秀丽隐杆线虫转录后基因沉默的致病因子,并将这种现象称为RNAi。RNAi 作为进化过程中高度保守的双链RNA 分子之一,可调节几乎人类所有细胞中mRNA 的稳定性和翻译[3]。在RNAi 中,有个重要的核酸内切酶Dicer,它可与双链RNA 分子结合,并从dsRNA 钝头或3 端有小悬突的dsRNA 上进行切割,将其剪切成2l-23nt 长及3'端突出的片段,即siRNA[10]。siRNA 对核苷酸序列具有高度特异性,可有效地对特定基因进行RNAi 沉默[3],这是因为siRNA 在细胞内被依附于RNA 的RNA 聚合酶1、2、6 进一步扩增,并以单链的形式与AGO1 蛋白结合,从而形成由RNA诱导的沉默复合体(RNA-induced silencing complex,RISC),引导部分或完全互补的mRNA 与其相互作用,导致特异的mRNA 被降解,产生转录后水平基因沉默(post-transcriptional gene silencing,PTGS)[11]。PTGS 存在于自然生物细胞中,是细胞抵抗外来核酸入侵,并维持自身基因组完整性的一种防御手段[12];PTGS 能将特异性同源双链RNA 导入细胞内,使靶点基因不表达或者表达水平下降。因此,RNAi 也作为一种简单有效的代替基因敲除的方法[11]。随着RNAi 技术的不断发展,由于其具有高稳定性、高特异性及高效性等特点,已在基因功能及肿瘤治疗方面被广泛运用[13],但在OA 领域则较为少见。所以,RNAi 的发现和应用为生物医学研究提供一个独特且适应性强的工具,成为发展生命科学和药物研发的重要方向[14]。RNAi 也有望成为治疗OA 的一种有效方法,为防治OA 开辟新的途径。
Skp2作为Skp1-Cullin-F-box(SCF 复合体)E3连接酶中的一种F-box 蛋白,可通过泛素介导G1 检查点CDK 抑制剂-p21 和p27、p57 和叉头转录因子1降解来靶向细胞周期进程。由于Skp2具有调控细胞周期的作用[4],所以其表达水平影响肿瘤发生、发展、预后等[2,15-17]。目前Skp2在肿瘤领域研究较多,但在OA 的研究甚少。Wang 等[18]通过对GSE48556、GSE46750、GSE32317 数据集综合荟萃分析发现,Skp2存在于OA 中;且认为高糖状态下Skp2过表达可促进软骨细胞增殖[19]。同时,研究发现在营养丰富的条件下,Skp2的SCFE3 泛素连接酶可维持细胞核中精氨酸甲基转移酶共激活因子1(CARM1)稳定性[20];而在饥饿状态下,Skp2则会激活细胞核中的AMP 依赖蛋白激酶(AMPK),激活的AMPK使叉头转录因子O3 磷酸化,导致Skp2下调并增加细胞核中CARM1 蛋白水平;稳定的CARM1 作为转录因子EB 必要激活因子,进而调控细胞自噬和溶酶体基因的表达。由于Skp2在AMPK-Skp2 -CARM1 信号轴中发挥关键介质作用[21],所以Skp2被认为是自噬相关疾病潜在治疗靶点[19]。生信预测发现Skp2是OA 的关键基因[18],而自噬能够清除受损和功能失调的细胞器和大分子,保持OA 软骨内环境的稳态[22],因而推断Skp2可能在OA 自噬中发挥重要作用。因此,观察Skp2在人软骨细胞中的表达情况,为研究Skp2在OA 中的靶向治疗提供依据。
本实验通过使用在线siRNA 设计工具,利用Skp2 序列作为靶位点,设计三条序列,采用基因重组技术,成功体外构建Skp2siRNA 表达载体,然后转染到人软骨细胞。结果发现,siRNA-59、siRNA-318、siRNA-504 转染组Skp2mRNA 表达明显低于NC 组,具有显著性差异(P<0.05);进一步采用DNA 电泳对其结果进行验证,其结果与各组重组质粒转染后Skp2mRNA 结果一致。进而观察对Skp2mRNA 表达抑制率,实验显示Skp2mRNA 在siRNA-59、siRNA-318、siRNA-504 中的抑制率分别为60%、41%、64%,其中以siRNA-504 转染组抑制率最高。针对Skp2的siRNA,能有效降低Skp2mRNA 表达,产生基因沉默效应,提示Skp2可能成为OA 治疗的一个靶基因,而Skp2第504 位点可能是研究其重要靶点。
本研究通过构建载体,成功介导siRNA 对人软骨细胞Skp2表达的抑制作用,表明在OA 基因治疗领域中具有可行性。随着siRNA 技术的日臻完善,该技术可能成为OA 基因治疗的重要组成部分。
作者贡献度说明:
袁长深:文章撰写,文章后期审校;李彦宏、刘晋邑、廖书宁、徐文飞:文章内容修改;段戡:文章设计。梅其杰:文章评估。
所有作者声明不存在利益冲突关系。

