基于生物信息学数据库的结肠癌SDC4基因表达调控机制及作用研究
唐梓涵 袁炜嗣 吴泽强 张粤烽 詹涵 王琛瑶 李恩民 陈滋凯 周飞

摘 要:为了揭示SDC4基因在结肠癌中的功能及其表达调控机制.通过GEPIA2、Ualcan与Oncolnc等数据库研究分析SDC4基因在结肠癌的表达及其对患者总生存期的影响.通过Wanderer、UCSC、Cistrome DB、miRcode和miRDB等数据库研究分析结肠癌SDC4基因启动子区的甲基化、组蛋白修饰,调控其表达的转录因子和miRNAs.通过GEPIA2、Ualcan、HCMdb与DAVID等数据库研究分析在结肠癌中与SDC4基因共表达的基因及其生物学作用.基于以上生物信息学数据库,研究发现,在结肠癌中:SDC4基因的表达水平显著增高,并与肿瘤组织分期、淋巴结转移正相关,与患者预后负相关.SDC4基因启动子区的甲基化水平显著升高,转录激活性组蛋白修饰H3K4Me1与H3K27Ac显著富集.SP1、TEAD4、JUND、FOSL1、NR1H3、PPARG、SRF、TFAP4共8个转录因子可能调控SDC4基因的转录表达.与此同时hsa-miR-194和hsa-miR-124也可能调控SDC4基因表达.hsa-miR-194和hsa-miR-124的表达下调.SERINC3、DNTTIP1、ATP9A、CHMP4B、BCL2L1、STAU1、SYS1、YWHAB、OSBPL2、SLC35C2、TM9SF4与SDC4基因共表达.SDC4基因可能参与调控结肠癌细胞凋亡、细胞通讯、物质运输与定位等生物学过程.基于生物信息学数据库研究发现的结果,为进一步阐明SDC4基因在结肠癌中的功能及其表达调控机制提供重要的线索.
关键词:生物信息学;结肠癌;SDC4;表达调控机制
中图分类号:R 735.3 文献标识码:A 文章编号:1007-6883(2023)03-0013-11
DOI:10.19986/j.cnki.1007-6883.2023.03.003
SDC4蛋白质是一种跨膜(I型)硫酸乙酰肝素蛋白聚糖,包含胞外结构域(N端)、跨膜结构域和胞质结构域(C端)[1].SDC4蛋白質常作为受体分子,通过其胞外结构域,与细胞外基质成分(如纤连蛋白)、生长因子(如FGF、PDGF、VEGF)、细胞因子(如MCP-1、CXCL12)等相互作用,传递细胞外信号[1-3].SDC4蛋白质的胞质结构域能结合磷脂酰肌醇4,5-二磷酸(PIP2),继而激活 PKCα信号通路[1].SDC4蛋白质还能激活MAPK、ERK、Wnt/β-catenin信号通路[4-6].这些分子功能表明SDC4蛋白质具有重要的细胞生物学作用.据报道:SDC4蛋白质能调控细胞的生长、粘附、移动、侵袭,上皮-间质转化(EMT)等与肿瘤进展密切相关的细胞生物学过程[1,6].而且,SDC4基因在肝癌、肾癌、雌激素受体阴性的乳腺癌、黑色素瘤、胶质瘤中高表达[7].但是,肿瘤细胞SDC4基因的表达调控机制,知之甚少[7].
基因转录调控是基因表达调控的重要环节.DNA甲基化、组蛋白修饰、转录因子在基因转录调控中起重要作用[8-10].DNA甲基化是一种发生在胞嘧啶-鸟嘌呤二核苷(CpGs)的化学修饰[9-10].在肿瘤中,基因启动子的DNA甲基化水平,往往与其转录活性负相关[9].组蛋白修饰类型很多,不同类型的组蛋白修饰对基因表达调控的作用不同,有的抑制基因表达,也有的促进基因表达[9-10].其中H3K4me1与H3K27Ac被认为是基因转录激活标记,占据染色质中转录活跃的基因区域,通常与基因的转录激活正相关[9-11].转录因子与基因启动子区特异DNA序列结合,调节基因对RNA聚合酶的招募作用,既可上调基因表达,也可下调基因表达[12].MicroRNAs(miRNAs)是一类小的非编码RNA,在转录后水平调控基因表达,通过与靶基因mRNA完全或不完全互补配对,引起mRNA降解或翻译阻遏[13].
结肠癌是常见的消化道恶性肿瘤,严重威胁人民健康.我国结肠癌发病率和死亡率逐年升高.2015年我国结肠癌新发病例38.8万,死亡病例18.7万[14].据报道,SDC4蛋白质在结肠癌的肿瘤细胞浸润前缘高表达[11].而且SDC4蛋白质高表达与结肠癌进展性病理特征显著正相关,对患者生存率不利[11].然而SDC4基因在结肠癌中的表达调控机制与作用,至今尚不清楚.为此,本研究基于多种生物信息学数据库,研究分析SDC4基因在结肠癌中的表达调控机制及其作用,为进一步阐明SDC4基因在结直肠癌发生发展中的生物学功能奠定基础.
1 材料与方法
1.1 结肠癌SDC4基因的表达水平
通过GEPIA2数据库(http://gepia2.cancer-pku.cn/)和Ualcan数据库(http://ualcan.path.uab.edu/),研究分析SDC4在人结肠癌组织及其癌旁正常组织中的表达情况.(1)GEPIA2数据库的参数设置:“gene:SDC4”,“|Log2FC|Cutoff:0.5”,“p-value Cutoff:0.01”,“cancer name:COAD”,“Log Scale:Yes”,“Jitter Size:0.4”,“Matched Normal data:Match TCGA normal data Plot”.(2)Ualcan数据库参数设置:“Scan by gene:SDC4”,“TCGA dataset:Colon adenocarcinoma”,“SDC4 expression based on:Sample types/Individual cancer stages/Nodal Metastasis status”.
1.2 结肠癌SDC4基因表达水平对患者生存率的影响
通过OncoLnc数据库(http://www.oncolnc.org/)、GEPIA2数据库,研究分析结肠癌SDC4基因表达水平对患者生存期的影响.Oncolnc数据库的参数设置如下,“gene:SDC4”,“cancer:COAD”,“high:50,low:50”.GEPIA2数据库的参数设置如下,“gene:SDC4”,“methods:overall survival”,“group cutoff:median”,“hazards ratio:NO”,“95%confidence interval:NO”.
1.3 结肠癌SDC4基因的甲基化修饰水平
通过Wanderer在线服务器(http://maplab.imppc.org/wanderer/),研究分析结肠癌组织及其癌旁正常组织细胞SDC4基因启动子区(Chr20:43977064-43979064;GRCh37/hg19)的甲基化水平.参数设置如下,“Gene Symbol:SDC4”,“Project:Colon adenocarcinoma”,“Data Type:450K Methylation array”,“Specify a region:Start=43977064;End=43979064”.
1.4 结肠癌SDC4基因的组蛋白修饰水平
利用数据库UCSC Genome Browser(http://www.genome.ucsc.edu/),研究分析SDC4基因的组蛋白修饰情况.方法如下,选择参考基因组Human GRCh38/hg38,并用Track search工具检索结肠癌细胞(HCT-116)SDC4基因的基因区内H3K4me1、H3K27ac修饰情况.通过Zoom in/out工具调整窗口大小.通过Vertical viewing range工具设置图形纵坐标的最小值与最大值.
1.5 结肠癌中调控SDC4基因表达的转录因子
通过Cistrome DB数据库(http://cistrome.org/db/#/)的在线工具,研究分析在结肠癌细胞中调控SDC4基因表达的转录因子.具体参数如下,“Species:Human hg38”,“Data type in Cistrome:Transcription factor, chromatin regulator”,“Gene or transcript:SDC4”,“The half-decay distance to transcription start site:10 kb”.同时设置,Regulatory Potential分值大于0.6.
1.6 结肠癌中调控SDC4基因的miRNA
通过miRcode在线分析工具(http://www.mircode.org/)、miRDB数据库(http://mirdb.org/)和TargetScan数据库(http://www.targetscan.org/vert_80/)预测调控SDC4基因表达的miRNAs.利用Jvenn数据库(http://jvenn.toulouse.inra.fr/app/example.html),分析它们共同预测的miRNAs.利用miRCancer数据库(http://mircancer.ecu.edu/index.jsp)检索调控SDC4的miRNAs在结肠癌中的表达情况.
1.7 结肠癌中SDC4基因的生物学作用
通过GEPIA2数据库、Ualcan数据库与HCMdb数据库(http://hcmdb.i-sanger.com/index),研究分析在结肠癌中与SDC4基因共表达的基因.研究分析时,设置这三个数据库的皮尔森相关系数≥0.5.在利用HCMdb数据库研究分析时,选择其收录的EXP00421项目数据.因为EXP00421项目检测的结肠癌临床样本最多,为453例.通过DAVID数据库对SDC4基因及与其共表达的基因进行GO注释,从而分析SDC4基因的生物学作用.参数设置,[p<0.05],[Count<2].
2 结果与分析
2.1 结肠癌组织SDC4基因的表达水平
GEPIA2数据库显示,与相应的癌旁正常组织相比,SDC4基因在结肠癌组织中的表达水平显著增高.而且Ualcan数据库,也证实了此分析结果(图1A和图1B).本研究进一步分析发现,SDC4基因的表达水平,在癌旁正常组织、I期~Ⅳ期结肠癌组织中逐渐升高,在发生淋巴结转移的结肠癌中显著增高(与无淋巴结转移的结肠癌或癌旁正常组织相比)(图1C和图1D).这些证据表明,SDC4基因表达可能与结肠癌的组织分期和淋巴结转移正相关
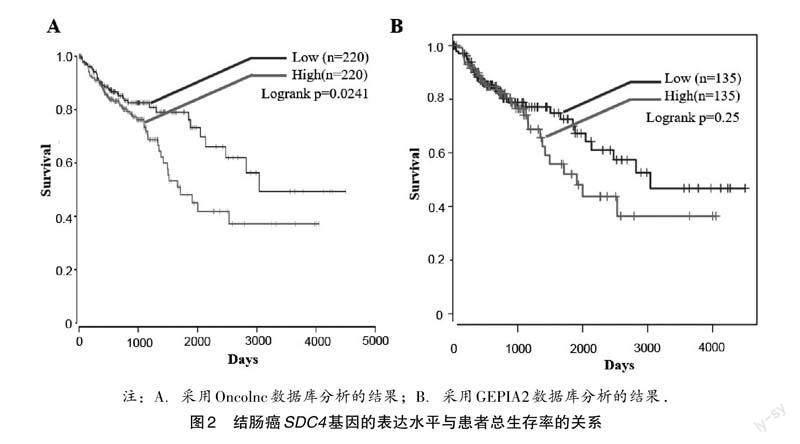
2.2 结肠癌SDC4表达水平与患者生存率的关系
通过Oncolnc数据库,研究分析SDC4基因表达水平对结肠癌患者总生存率的影响.结果发现,SDC4基因高表达的患者总生存率显著较低(图2A).为了验证此结果,本研究又通过GEPIA2数据库,分析SDC4基因表达水平与结肠癌患者总生存期的关系.其分析结果,也表明SDC4基因高表达对结肠癌患者预后不利(图2B).
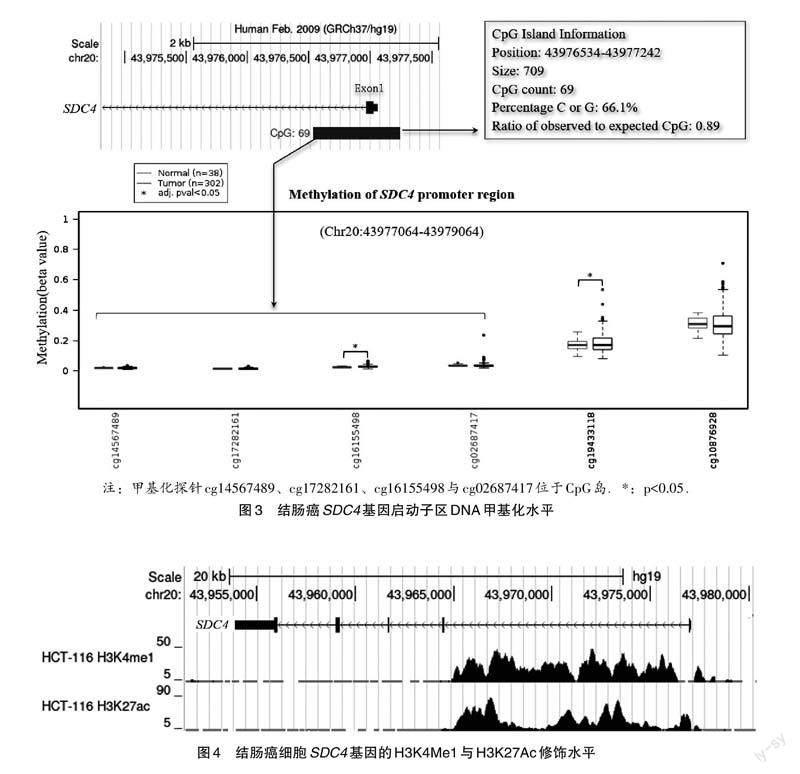
2.3 结肠癌SDC4基因的甲基化修饰水平
本研究认为SDC4基因转录起始位点上游2000 bp为其启动子区域(Chr20:43977064-43979064,GRCh37/hg19).UCSC基因组浏览器显示SDC4基因的启动子及与其相邻的基因组区域(chr20:43976534-43977242;GRCh37/hg19)中有一个长为709 bp的CpG岛,岛内包含69个CpG.Wanderer数据库显示SDC4基因启动子区中存在6个甲基化位点,其中4个位于此CpG岛的3'端区域,2个位于CpG岛下游.与癌旁正常组织相比,其中2个位点(cg16155498与cg19433118)的甲基化水平在结肠癌中显著升高(图3).
2.4 结肠癌SDC4基因的组蛋白修饰情况
利用UCSC数据库,研究分析SDC4基因在结肠癌细胞(HCT-116)内的组蛋白修饰情况.结果表明,转录激活相关的H3K4Me1与H3K27Ac显著富集于SDC4基因的啟动子区域与第一内含子(图4).此结果表明,组蛋白修饰可能对结肠癌SDC4基因的转录表达起重要调控作用.
2.5 调控结肠癌SDC4基因的转录因子
通过Cistrome DB数据库的在线工具,分析在结肠癌中调控SDC4基因表达的转录因子.结果发现,ChIP-Seq或ChIRP-Seq实验结果显示在结肠癌细胞(HCT-116、HT29、V852或SNU175)中,SP1、TEAD4、JUND、FOSL1、NR1H3、PPARG、SRF与TFAP4共8个转录因子结合SDC4基因(图5A).例如在结肠癌HCT-116细胞中,ChIP-Seq实验检测结果显示SDC4基因的5'端上覆盖多个明显的SP1结合峰(图5B).此结果提示,以上8个转录因子可能在结肠癌细胞中调控SDC4基因表达.
2.6 调控结肠癌SDC4基因的miRNA
分别通过miRcode数据库、TargetScan数据库和miRDB數据库,预测能调控SDC4基因表达的miRNA.miRcode数据库、TargetScan数据库与miRDB数据库分别发现能调控SDC4基因表达的miRNAs有4个、4个与82个.其中这三个数据库均发现hsa-miR-194和hsa-miR-124调控SDC4基因的表达(图6A).本研究进一步分析hsa-miR-194和hsa-miR-124在结肠癌中的表达情况.结果显示,hsa-miR-194和hsa-miR-124在结肠癌中低表达(图6B).
2.7 结肠癌中SDC4基因的作用
为了研究分析结肠癌中SDC4基因的作用,本研究首先通过GEPIA2数据库、Ualcan数据库与HCMdb数据库(http://hcmdb.i-sanger.com/index),分析在结肠癌中与SDC4基因共表达的基因.为了提高分析结果的可靠性,本研究认为由这三个数据库共同分析得到的基因,才是在结肠癌中与SDC4基因共表达的基因.GEPIA2数据库、Ualcan数据库与HCMdb数据库分别发现在结肠癌中,有49个、104个与20个基因与SDC4基因共表达.其中SERINC3、DNTTIP1、ATP9A、CHMP4B、BCL2L1、STAU1、SYS1、YWHAB、OSBPL2、SLC35C2、TM9SF4这11个基因由这三个数据库共同分析发现(图7).本文认为这11个基因在结肠癌中与SDC4基因共表达.换句话说,本研究分析发现了一个结肠癌SDC4共表达基因集.接着,为了研究分析结肠癌SDC4基因的生物学作用.我们通过DAVID数据库对SDC4共表达基因集进行功能富集分析.结果发现,这些基因被富集于18个GO条目,其中包含细胞凋亡相关GO条目(GO:0097190;GO:2001233;GO:2001235)、细胞通讯调控相关GO条目(GO:0023056、GO:0010647)、物质运输、定位及其调控相关GO条目(GO:0044765、GO:0071705、GO:0016192、GO:0071702、GO:0046907、GO:0034613、GO:0060341、GO:1903827、GO:0090150)、细胞器组装及调控相关GO条目(GO:0033043、GO:0044802、GO:0007009)、病毒参与生物学过程相关GO条目(GO:0016032)(图8).
3 讨论
SDC4蛋白质能结合生长因子、细胞外基质组分、细胞骨架蛋白,调控细胞内RAC1活性、PKCα活性、黏着斑激酶磷酸化水平、Ca2+水平,在细胞骨架重组、细胞粘附、细胞移动、细胞增殖、细胞分裂、细胞极性形成等生物学过程中起重要的调控作用[1].这些SDC4蛋白质调控的细胞生物学过程与肿瘤进展密切相关.故SDC4蛋白质可能参与肿瘤的发生发展.据报道,SDC4基因在雌激素受体阴性的乳腺癌、胶质瘤、肝癌、黑色素瘤、肾癌等恶性肿瘤中高表达[7].与永生化结肠细胞(CCD-18Co)相比,SDC4 mRNA在高转移性的结肠癌细胞(KM1214、HCT116,KM12SM)中显著低表达[15].最近研究表明,SDC4蛋白质在结肠癌癌巢浸润前缘细胞高表达,特别是在肿瘤芽表达最强[16].本文发现,SDC4基因的表达水平与结肠癌临床分期和局部淋巴结转移正相关(图1).SDC4基因高表达的结肠癌患者预后不良(图2).这些证据表明,SDC4基因的表达水平与结肠癌发生发展密切相关.以往发现,缺氧条件能够诱导结肠癌细胞上调SDC4基因表达[17].靶向抗肿瘤药物曲妥珠单抗(Trastuzumab)与帕尼单抗(Panitumumab)能够下调肿瘤细胞SDC4基因表达[7].除此之外,至今SDC4基因在结肠癌表达的分子调控机制并不清楚.研究阐明肿瘤相关基因表达的分子调控机制,能为揭示肿瘤发生发展病理机制提供重要线索.为此,本文通过生物信息学方法,研究分析了结肠癌中SDC4基因表达的分子调控机制.
本文发现:SDC4基因启动子区包含6个甲基化位点.其中2个位点的甲基化水平在结肠癌组织显著升高(图3).H3K4Me1与H3K27Ac在SDC4基因的启动子区、第一内含子显著富集(图4).SP1等共8个转录因子在结肠癌细胞中调控SDC4基因表达(图5).hsa-miR-194和hsa-miR-124调控SDC4基因的表达(图6).一般来说,基因的启动子甲基化水平与其表达水平负相关[9].miRNA下调其靶基因的表达[13].H3K4me1、H3K27Ac与基因的转录激活正相关[9-11].转录因子既可上调基因表达,也可下调基因表达[12].本文发现,SDC4是hsa-miR-194和hsa-miR-124的靶基因.而hsa-miR-194和hsa-miR-124在结肠癌中低表达(图6B).因此,结肠癌中hsa-miR-194和hsa-miR-124的表达下调,对维持SDC4基因的高表达有利.此外,结肠癌中SDC4基因启动子区组蛋白修饰(H3K4Me1、H3K27Ac)显著富集,也对维持SDC4基因高表达有利.然而,结肠癌中SDC4基因启动子区甲基化水平上调,却对维持SDC4基因高表达不利.本文既发现了对结肠癌SDC4基因高表达的不利因素,又发现对其有利的因素.这表明结肠癌SDC4基因表达的分子调控机制十分复杂.甲基化、转录因子、组蛋白修饰、miRNAs均与结肠癌SDC4基因表达调控有关.在结肠癌中,这些调控因素可能以某种方式严密组合、相互作用,共同决定SDC4基因的表达.
據报道,肿瘤细胞内共表达的基因之间具有紧密相关的生物学功能[18-20].为了探索SDC4基因在结肠癌发生发展中的作用.本文发现,SERINC3、DNTTIP1、ATP9A、CHMP4B、BCL2L1、STAU1、SYS1、YWHAB、OSBPL2、SLC35C2、TM9SF4共11个基因在结肠癌中与SDC4基因共表达(图7).基因功能富集分析发现,这些基因参与18个生物学过程,其中包含3个细胞凋亡相关GO条目(图8).失巢凋亡是由于细胞与细胞外基质失去接触,而诱导的一种特殊的程序化细胞死亡形式[21-22].肿瘤细胞具有抗失巢凋亡的能力[23].据报道,在耐受失巢凋亡的模型细胞中,SDC4基因表达上调.敲低SDC4基因的表达,导致细胞增殖、侵袭和血管生成的能力下降[21-22].还发现,下调SDC4基因表达,可通过抑制Wnt/beta catenin信号通路的激活,促进甲状腺癌细胞凋亡[6].本文发现YWHAB、SERINC3、BCL2L1等3个与SDC4共表达的基因,被聚类于细胞凋亡相关的GO条目.这一发现为今后研究SDC4调控细胞凋亡的分子机制提供新线索.本文还发现,SDC4基因参与调控细胞通讯等生物学过程.这与已经报道的SDC4基因的生物学功能一致.本文还发现,SDC4基因可能参与病毒的传播、致病等病毒参与的生物学过程(GO:0016032).这是尚未报道的新发现,可能为研究拓展SDC4基因新的生物学功能提供线索.总之,本研究采用生物信息学方法揭示结肠癌SDC4基因高表达的分子调控机制与作用,为深入研究揭示结肠癌发生发展的病理机制奠定基础.
4 结论
本研究采用多种生物信息学数据库研究发现,在结肠癌中:SDC4基因高表达,而且其表达水平与肿瘤组织分期、淋巴结转移正相关,与患者预后负相关.SDC4基因的表达可能被甲基化,组蛋白修饰(H3K4Me1与H3K27Ac),转录因子(SP1、TEAD4、JUND、FOSL1、NR1H3、PPARG、SRF、TFAP4),miRNAs(hsa-miR-194和hsa-miR-124)调控.SDC4基因通过其共表达基因参与结肠癌细胞凋亡、细胞通讯、物质运输与定位等生物学过程.本研究为进一步阐明结肠癌SDC4基因表达调控机制与作用提供重要的新线索.
参考文献:
[1]Keller-Pinter A,Gyulai-Nagy S,Becsky D,et al.Syndecan-4 in Tumor Cell Motility[J].Cancers(Basel),2021,13(13):1-24.
[2]Zhang Y,Li J,Partovian C,et al.Syndecan-4 modulates basic fibroblast growth factor 2 signaling in vivo[J].Am J Physiol Heart Circ Physiol,2003,284(6):2078-2082.
[3]Lambert J,Makin K,Akbareian S,et al.ADAMTS-1 and syndecan-4 intersect in the regulation of cell migration and angiogenesis[J].J Cell Sci,2020,133(7):1-22.
[4]Neel D S,Allegakoen D V,Olivas V,et al.Differential Subcellular Localization Regulates Oncogenic Signaling by ROS1 Kinase Fusion Proteins [J].Cancer Res,2019,79(3):546-556.
[5]Corti F,Finetti F,Ziche M,et al.The syndecan-4/protein kinase Calpha pathway mediates prostaglandin E2-induced extracellular regulated kinase(ERK)activation in endothelial cells and angiogenesis in vivo[J].J Biol Chem,2013,288(18):12712-12721.
[6]Chen L L,Gao G X,Shen F X,et al.SDC4 Gene Silencing Favors Human Papillary Thyroid Carcinoma Cell Apoptosis and Inhibits Epithelial Mesenchymal Transition via Wnt/beta-Catenin Pathway [J].Mol Cells,2018,41(9):853-867.
[7]Onyeisi J O S,Lopes C C,Gotte M.Syndecan-4 as a Pathogenesis Factor and Therapeutic Target in Cancer[J].Biomolecules,2021,11(4):1-16.
[8]Chuang T J,Chiang T W.Impacts of pretranscriptional DNA methylation,transcriptional transcription factor,and posttranscriptional microRNA regulations on protein evolutionary rate [J].Genome Biol Evol,2014,6(6):1530-1541.
[9]唐德平,姚慧慧,唐金舟,等.癌癥中microRNAs和表观遗传之间的相互调控作用[J].生物技术通报,2020,36(8):194-200.
[10]马梅燕,冀慎英,张湘豫,等.基于生物信息学方法的人类GLTP在胰腺腺癌发生发展中的作用及其表观遗传调控机制分析[J].激光生物学报,2021,30(4):348-354.
[11]Beacon T H,Delcuve G P,Lopez C,et al.The dynamic broad epigenetic(H3K4me3,H3K27ac)domain as a mark of essential genes[J].Clin Epigenetics,2021,13(138):1-17.
[12]冯琳璎,张利绒.表达相关的转录因子相互作用模式[J].内蒙古大学学报(自然科学版),2018,49(5):476-486.
[13]路玉盼,董宪喆,王瑾,等.Micrornas调控胃癌相关基因的研究进展[J].中国药理学通报,2018,34(11):1481-1485.
[14]刘正,王锡山.国内外结直肠癌筛查的对比分析及启示[J].中华结直肠疾病电子杂志,2022,11(1):18-23.
[15]Park H,Kim Y,Lim Y,et al.Syndecan-2 mediates adhesion and proliferation of colon carcinoma cells [J].J Biol Chem,2002,277(33):29730-29736.
[16]Jechorek D,Haeusler-Pliske I,Meyer F,et al.Diagnostic value of syndecan-4 protein expression in colorectal cancer [J].Pathol Res Pract,2021,222:1-9.
[17]Koike T,Kimura N,Miyazaki K,et al.Hypoxia induces adhesion molecules on cancer cells:A missing link between Warburg effect and induction of selectin-ligand carbohydrates [J].Proc Natl Acad Sci USA,2004,101(21):8132-8137.
[18]李雪霞,邹焱堂,李炫坤,等.基于生物信息学数据库分析IER2在肿瘤中高表达及其作用机制[J].中国生物化学与分子生物学报,2020,36(11):1333-1345.
[19]Stuart J M,Segal E,Koller D,et al.A gene-coexpression network for global discovery of conserved genetic modules [J].Science,2003,302(5643):249-255.
[20]王梦男,韩明飞,刘炳辉,等.基于集成的共表达网络分析方法研究3种癌症的肿瘤相关模块[J].生物工程学报,2021,37(11):4111-4123.
[21]Onyeisi JOS,Pernambuco Filho PCA,Mesquita APS,et al.Effects of syndecan-4 gene silencing by micro RNA interference in anoikis resistant endothelial cells:Syndecan-4 silencing and anoikis resistance [J].Int J Biochem Cell Biol,2020,128:1-11.
[22]Carneiro B R,Pernambuco Filho P C,Mesquita A P,et al.Acquisition of anoikis resistance up-regulates syndecan-4 expression in endothelial cells [J].PLoS One,2014,9(12):1-23.
[23]Onyeisi JOS,Castanho de Almeida Pernambuco Filho P,de Araujo Lopes S,et al.Heparan sulfate proteoglycans as trastuzumab targets in anoikis-resistant endothelial cells [J].J Cell Biochem,2019,120(8):13826-13840.
The Study on the Expression Regulation Mechanism
and the Role of SDC4 Gene in Colon Cancer
Based on Bioinformatics Databases
TANG Zi-han1, YUAN Wei-si2, WU Ze-qiang1, ZHANG Yue-feng1, ZHAN Han1, WANG Chen-yao3, LI En-ming3, CHEN Zi-kai1, ZHOU Fei1*
(1. College of Life Sciences and Food Engineering, Hanshan Normal University, Chaozhou, Guangdong, 521041; 2. Department of Colorectal and Anorectal Surgery, Chaozhou Central Hospital, Chaozhou, Guangdong, 521041; 3. Shantou University Medical College, Shantou, Guangdong, 515041)
Abstract:To investigate the expression regulation mechanism and the role of SDC4 gene in colon cancer, GEPIA2 database, Ualcan database and Oncolnc database were used to study the expression of SDC4 gene in colon cancer and its effect on overall survival of the patients. Wanderer database, UCSC database, Cistrome DB database, miRcode database and miRDB database were used to study methylation and histone modification of the promoter region of SDC4 gene, and transcription factors and miRNAs for regulating the gene expression. GEPIA2 database, Ualcan database, HCMdb database and DAVID database were used to analyze genes co-expressed with SDC4 gene and the biological processes where these gene were involved in the colon cancer. The following results were found in colon cancer through the usage of the above bioinformatics database: The expression of SDC4 gene was significantly higher than that in adjacent normal tissues, and was positively correlated with tissue stage and lymph node metastasis, and negatively correlated with prognosis of patients in colon cancer. The methylation level of SDC4 gene promoter region was elevated in colon cancer. Histone modifications in transcriptional activation of H3K4Me1 and H3K27Ac were significantly enriched in the promoter of the SDC4 gene. A total of 8 transcription factors including SP1, TEAD4, JUND, FOSL1, NR1H3, PPARG, SRF, and TFAP4 might transcriptionally regulate the expression of SDC4 gene in colon cancer. Meanwhile, hsa-miR-194 and hsa-miR-124 might also regulate SDC4 gene expression. The expression of hsa-miR-194 and the expression of hsa-miR-124 were down-regulated in colon cancer. A total of 11 genes, namely SERINC3, DNTTIP1, ATP9A, CHMP4B, BCL2L1, STAU1, SYS1, YWHAB, OSBPL2, SLC35C2, and TM9SF4 were co-expressed with SDC4 gene in colon cancer. SDC4 gene was possibly involved in the regulation of biological processes such as apoptosis, cell communication, material transport and localization in colon cancer cells. The findings based on the bioinformatics database can provide important clues for further elucidating the regulatory mechanism and role of SDC4 gene expression in colon cancer.
Key words:bioinformatics; colon cancer; SDC4; expression regulation mechanism
責任编辑 周春娟
收稿日期:2022-09-28
基金项目:广东省科技创新战略专项资金(大学生科技创新培育)项目(项目编号:PDJH2023B0342);韩山师范学院教育教学改革项目(项目编号:粤韩师教[2021]148号);韩山师范学院科研项目(项目编号:XPY202106);广东省教育厅科研项目(项目编号:2021ZDZX2066).
作者简介:唐梓涵(1999-),男,广东汕头人,韩山师范学院生命科学与食品工程学院2020级学生.周飞为通讯作者.

