莪术醇对胃癌AGS细胞增殖、凋亡的影响及机制研究
周桂香 邓帅 班江文 陈雯雯 谭宝
胃癌已经成为世界范围内的常见恶性肿瘤之一,其高发病率与死亡率不仅严重危害国民的生命健康,并且在很大程度上也给国家及社会的进步和发展带来沉重的疾病负担[1]。近年来,随着中草药不断进入人们的视野,越来越多的中草药及中药单体被发现在抗肿瘤中具有独特的作用和显著的优势,在抑制肿瘤增长的同时可以提高机体的免疫力,还可以增敏减毒,与化疗药配合使用起到协同增效的作用[2]。
莪术,又称黑心姜、乌姜、姜七,为姜科姜黄属植物,功擅破血行气,消积止痛[3],主开胃消食,破积聚,行血瘀,除腹痛。现代药理研究发现,莪术挥发油具有抗菌、抗炎、抗病毒及抗肿瘤的功效[4],课题组前期实验已经证实莪术挥发油能够通过诱导细胞凋亡和周期阻滞来发挥抗肿瘤的功效[4]。因此,本实验以莪术挥发油中所占含量比最多的单体成分莪术醇为实验对象,选取磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路为研究切入点,通过探讨莪术醇作用于胃癌AGS细胞后对该信号通路的影响,以期进一步阐明莪术醇抗肿瘤作用可能的机制,为今后的临床疾病治疗及新药开发提供相关实验数据。
1 材料与方法
1.1 实验细胞
胃腺癌AGS细胞株,购于上海生命科学院细胞库。
1.2 细胞培养
将复苏后的胃癌AGS细胞在完全培养基中(含10%FBS、1%青-链霉素双抗)培养,放入5% CO2、37℃的恒温饱和湿度的培养箱,观察细胞生长情况,根据生长状态进行换液,细胞约铺满培养瓶底85%左右时,用0.25%的胰酶进行消化传代。
1.3 主要药物与试剂
莪术醇购于成都曼斯特生物科技有限公司(批号:MUST-20060802,质量标准为99.76%),将其溶于二甲基亚砜中,然后用全培进行稀释,使稀释后的二甲基亚砜终浓度≤5‰;顺铂注射液(江苏豪森药业集团有限公司,批号:601210605,规格:6 mL∶30 mg);胎牛血清(杭州四季青有限公司,批号:21090706);DMEM培养基(批号:MA0212)、0.25%胰酶(批号:MA0232)、PBS溶液(批号:MA0015)、Annexin V-FITC细胞凋亡检测试剂盒(批号:Jan-18G)均购于大连美仑生物技术有限公司;细胞周期试剂盒(批号:A10734)购于联科生物公司;CCK-8检测试剂盒(批号:SC119-02)购于大连美仑生物技术有限公司;B淋巴细胞瘤-2蛋白(B-cell lymphoma-2,Bcl-2)抗体(批号:3560006120)、Bcl-2相关X蛋白(Bcl-2-associated X,Bax)抗体(批号:3560138106)、β-actin抗体(批号:2021040708)购于武汉ABclonal公司;PI3K抗体(批号:ab151549)、p-Akt抗体(批号:AF0908)、p-mTOR抗体(批号:CST-5536)和半胱氨酸天冬氨酸蛋白酶3(cysteinyl aspartate specific proteinase-3,Caspase-3)抗体(批号:GB11767c)均购于武汉塞维尔生物科技有限公司;增强型RIPA裂解液(批号:16128C02)、BCA蛋白浓度测定试剂(批号:16H10A46)、SDS-PAGE蛋白上样缓冲液(批号:16J20B12)、SDS-PAGE凝胶制备试剂盒(批号:16J27C38)均购于博士德生物有限公司。
1.4 实验仪器
超净工作台、细胞培养箱和-80℃低温冰箱(美国Thermo公司);酶标仪(美国Molecular Devices公司);倒置相差显微镜、荧光显微镜(ZEISS公司);低速离心机(中科中佳有限公司);流式细胞仪(Beckman Coulter公司);WB显影仪(Protein Simple公司);水平摇床、电泳仪(北京六一生物科技有限公司);电泳槽、转膜仪(美国BIO-RAD公司);各种量程手动移液器(大龙兴创实验仪器股份公司)。
1.5 实验方法与指标检测
1.5.1 CCK-8法检测细胞增殖抑制率 将用0.25%胰酶消化后的胃癌AGS细胞调整至浓度约为5×104个/mL的细胞悬液,选取96孔板进行种板。设空白对照组、莪术醇低浓度组、莪术醇中浓度组、莪术醇高浓度组和阳性对照组,每组设6个复孔,每孔100 μL细胞悬液。
种板结束后将96孔板放入培养箱中进行培养,培养至细胞贴壁后将预先用全培稀释好的莪术醇依次加入。莪术醇低、中、高浓度组浓度分别为12.5、25、50 μg/mL;空白对照组加入稀释浓度为5‰二甲基亚砜的完全培养基;阳性对照组加入5 μg/mL的顺铂,将96孔板放回培养箱继续培养24、48小时。
将96孔板从培养箱中取出,弃去孔内的旧含药培养基,加入CCK-8混合工作液110 μL,孵育1小时左右时,在酶标仪450 nm波长条件下测定各个孔的吸光度(OD值),每组OD值舍弃最大和最小值,选取4个复孔,根据OD值计算细胞存活率。细胞存活率=(实验孔-空白孔)/(对照孔-空白孔)×100%。
1.5.2 细胞凋亡检测 胃癌AGS细胞以1×105个/mL接种于6孔板内,设空白对照组、莪术醇低、中、高浓度组,每组选取3个复孔,每孔接种2 mL细胞悬液,过夜细胞贴壁后将旧培养基弃掉。莪术醇低、中、高浓度组依次加入浓度为12.5、25、50 μg/mL的莪术醇进行干预,空白对照组加入新鲜全培作对照。继续培养24、48小时,药物干预结束后分组将孔板内的细胞上清液收集,再用不含EDTA的胰酶消化细胞,全培终止消化后按顺序依次移入事先装有上清液的离心管中,上机离心后(1 000r/min,离心力179 g,离心5分钟)弃掉上清液,PBS(-20℃预冷)轻柔吹打洗涤两次,离心弃去PBS,用稀释后的1×Binding buffer工作液重悬细胞,浓度约为1×106个/mL。将重悬后的细胞移至流式管中,每管约100 μL,然后加入双染试剂(Annexin V-FITC和PI)各5 μL和10 μL,充分混匀后室温下避光孵育20分钟左右,然后每管再次加入400-600 μL的1×Binding buffer工作液,混匀后上流式细胞仪检测(一般要求在1小时内上机为佳)。实验重复3次。
1.5.3 细胞周期检测 将离心后的胃癌AGS细胞沉淀重悬为1×105个/mL的重悬液接种于6孔板内,设空白对照组、莪术醇低、中、高浓度组,每组设3个复孔,每个复孔2 mL细胞重悬液,待细胞在培养箱中贴壁后加药,莪术醇低、中、高浓度组依次加入浓度为12.5、25、50 μg/mL的莪术醇进行干预,空白对照组更换为不含药物的全培。加药后允许细胞继续生长24、48小时,干预时间完成后用0.25%的胰酶进行消化,全培终止后轻轻吹打培养板底部的细胞,然后用移液器移入离心管上机离心(1 000r/min,离心力179 g,离心5分钟)。弃掉上清液,加入室温下PBS(约1 mL)重悬,然后将混悬液一边高速搅拌一边缓缓加入约3 mL的无水乙醇中(-20℃预冷),-20℃固定过夜保存。上机检测时,将在-20℃固定的细胞先离心弃掉乙醇固定液,然后加入PBS水化细胞(室温条件下3-5 mL),室温下水化5分钟左右,然后移至流式管中,再次离心弃上清。加入1 mL的DNA staining solution试剂进行细胞染色,涡旋机混匀后室温下避光孵育约30分钟,上机检测细胞的周期分布。实验重复3次。
1.5.4 Wound healing检测胃癌AGS细胞的迁移、修复能力 将胃癌AGS细胞重悬为约1×105个/mL的浓度进行种板,6孔板每孔接种1.5 mL悬液,设空白对照组、莪术醇低、中、高浓度组,每组3个复孔。铺板结束后在培养箱中培养,观察细胞生长情况,待细胞在6孔板底部形成单细胞层时,用10 μL的移液器枪头尖端在各个孔底垂直画一条直线,操作过程要保证枪头垂直,用无菌PBS将脱落的细胞清洗三次,然后将空白组加入无血清的培养基,莪术醇低、中、高浓度组分别加入用无血清培养基稀释的浓度为12.5、25、50 μg/mL的莪术醇;药物干预48小时后,每组分别在药物干预前、后选择三个不同的视野进行拍照,用Image J软件分析干预前后的划痕面积,根据划痕面积差异计算划痕愈合率。
伤口划痕愈合率=[(划痕面积0小时-划痕面积48小时)/划痕面积0小时]×100%
1.5.5 蛋白免疫印迹法检测相关蛋白的表达 将生长状态良好的胃癌AGS细胞消化离心后,以1×105个/mL浓度于6孔板中种板,每孔约2 mL悬液。设空白对照组、莪术醇低、中、高浓度组和阳性对照组,每组设3个复孔。细胞贴壁后弃掉孔内旧培养基,空白对照组更换新鲜全培,莪术醇低、中、高浓度组加入浓度分别为12.5、25、50 μg/mL的莪术醇干预,阳性对照组加入5 μg/mL的顺铂。在培养箱中培养48小时后去除孔板内原有培养基,用PBS清洗各孔,然后每孔加入200 μLRIPA裂解液,晃动6孔板,使裂解液与细胞完全接触,孔板在冰上裂解10分钟左右,将经过裂解的细胞移入EP管中,继续在冰上进行裂解,然后涡旋震荡3次,每次间隔10分钟,结束后4℃低温离心机离心(12 000 r/min,离心15分钟),提取总蛋白。然后用BCA试剂盒进行样本总蛋白浓度定量,将EP管中取样定量后剩余的蛋白高温变性,-20℃冰箱保存。每组等量的蛋白质(每孔15 μg蛋白)进行SDS-PAGE凝胶电泳分离、转膜、5%脱脂牛奶4℃冰箱封闭过夜,TBST洗膜后,加一抗PI3K、p-Akt、p-mTOR、Caspase-3、Bcl-2、Bax及β-actin(按比例进行稀释),4℃冰箱孵育过夜后弃去一抗,加二抗(羊抗兔IgG-HRP,1∶5 000),室温下孵育2小时,结束后再次用TBST洗膜3次,每次大约10分钟,滴加ECL发光液,凝胶成像系统进行显影、拍照。选取β-actin为实验的内参蛋白,用Image J软件进行目标蛋白条带灰度值的统计分析,通过目标蛋白的条带灰度值表达差异来计算各个蛋白的相对表达量。
1.6 数据处理

2 结果
2.1 莪术醇对胃癌AGS细胞生长活力的影响
用不同浓度的莪术醇干预胃癌AGS细胞24小时后,胃癌AGS细胞活力从89.32%下降到51.21%;干预48小时后,胃癌AGS细胞活力从65.03%下降到19.14%,经计算得出莪术醇干预24小时和48小时的半抑制浓度(halfmaximal inhibitory concentration,IC50)值分别为50.04 μg/mL和19.91 μg/mL。因此,莪术醇浓度不同,干预时间不同,其增殖抑制率有明显差别。根据实验结果可知,莪术醇对胃癌AGS细胞增殖抑制作用呈现出良好的浓度-时间依赖性。见表1,图1。

图1 莪术醇干预胃癌AGS细胞24小时和48小时的IC50值

表1 莪术醇对AGS细胞活力的影响
2.2 莪术醇对胃癌AGS细胞凋亡的影响
莪术醇干预胃癌AGS细胞24、48小时后,采用Annexin V-FITC和PI双染法将凋亡细胞和正常细胞区分,上机用流式细胞仪检测不同浓度和不同干预时间的细胞凋亡率。结果显示,莪术醇干预胃癌AGS细胞24小时后,细胞凋亡率从22.7%上升到52.43%;干预48小时后,凋亡率从37.17%上升到64.37%。不同浓度的莪术醇干预胃癌AGS细胞后,随着时间的延长凋亡率逐渐增加,呈现出良好的时效-量效关系。见表2、图2、表3、图3。

注A 空白对照组;B 莪术醇低浓度组;C 莪术醇中浓度组;D 莪术醇高浓度组。图2 莪术醇干预24小时对胃癌AGS细胞凋亡的影响

注A 空白对照组;B 莪术醇低浓度组;C 莪术醇中浓度组;D 莪术醇高浓度组。图3 莪术醇干预48小时对胃癌AGS细胞凋亡的影响

表2 莪术醇干预24小时对胃癌AGS细胞凋亡的影响

表3 莪术醇干预48小时对胃癌AGS细胞凋亡的影响
2.3 莪术醇对AGS细胞周期的影响
流式细胞仪检测胃癌AGS周期分布结果可知,莪术醇干预胃癌AGS细胞24小时后,出现细胞的G2/M期周期阻滞,干预后处于G2/M期的细胞由3.95%上升到17.03%,并且药物浓度越高细胞G2/M期周期阻滞比率越高;莪术醇干预48小时后,细胞出现明显的G0/G1期阻滞,细胞所占比由52.34%增加到72.04%,周期阻滞作用呈现出药物浓度依赖性。由此可知,在莪术醇浓度相同的情况下,可能由于干预时间的差异,使得AGS细胞的周期阻滞作用出现差异。见表4、表5,图4、图5。

注A 空白对照组;B 莪术醇低浓度组;C 莪术醇中浓度组;D 莪术醇高浓度组。图4 莪术醇干预24小时对胃癌AGS细胞周期的影响

注A 空白对照组;B 莪术醇低浓度组;C 莪术醇中浓度组;D 莪术醇高浓度组。图5 莪术醇干预48小时对胃癌AGS细胞周期的影响

表4 莪术醇干预24小时对胃癌AGS细胞周期分布的影响

表5 莪术醇干预48小时对胃癌AGS细胞周期分布的影响
2.4 莪术醇对AGS细胞迁移和修复能力的影响
与空白对照组相比,不同浓度的莪术醇干预AGS细胞48小时后各组的伤口愈合率呈明显下降趋势,伤口愈合率从对照组的78.05%下降到17.51%。同时,随着莪术醇浓度的梯度递增,伤口的愈合率明显下降,表明莪术醇能够抑制胃癌AGS细胞的迁移,降低伤口的修复能力。见图6,表6。

图6 各组胃癌AGS细胞划痕实验愈合情况

表6 莪术醇对胃癌AGS细胞划痕愈合率的影响
2.5 莪术醇对PI3K/Akt/mTOR信号通路的影响
胃癌AGS细胞经不同浓度的莪术醇及阳性药顺铂干预48小时后,与空白对照组相比,各给药组PI3K、p-Akt、p-mTOR表达均显著下调(P<0.05);与莪术醇高浓度组相比,阳性对照组的PI3K、p-Akt、p-mTOR蛋白表达差异无统计学意义(P>0.05),说明莪术醇的干预可使PI3K/Akt/mTOR信号通路蛋白表达下降,但高浓度莪术醇和顺铂抑制效果相差不大。
与空白对照组相比,各药物组Bax蛋白表达水平呈上调趋势,Bcl-2蛋白表达水平下调,Caspase-3蛋白表达出现上调(均P<0.05),说明莪术醇可能通过改变Bax和Bcl-2蛋白两者之间的表达比例,激活Caspase-3蛋白,使其执行凋亡功能,实现促凋亡作用。见表7、表8,图7。
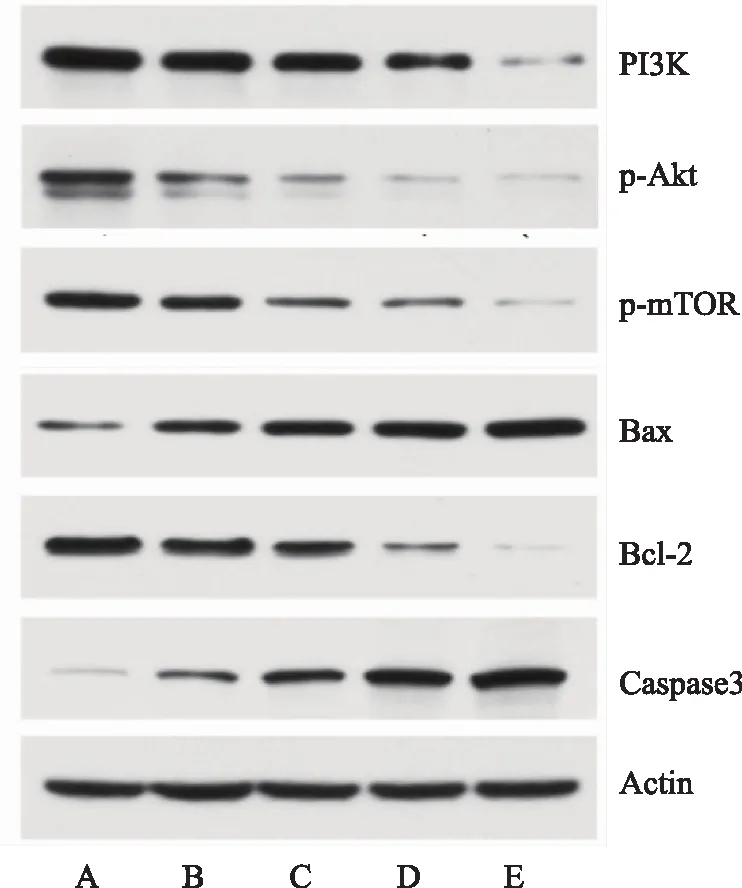
注A 空白对照组;B 莪术醇低浓度组;C 莪术醇中浓度组;D 莪术醇高浓度组;E 阳性对照组。图7 莪术醇对PI3K/Akt/mTOR信号通路蛋白及Bax、Bcl-2、Caspase-3蛋白表达的影响

表7 莪术醇对PI3K/Akt/mTOR信号通路蛋白表达的影响

表8 莪术醇对Bax、Bcl-2、Caspase-3蛋白表达的影响
3 讨论
生命活动的正常完成及机体内部平衡和稳态的维持,离不开细胞的有序增殖、分化及凋亡[5]。越来越多的研究发现,肿瘤的发生、发展与细胞凋亡和细胞周期的紊乱有密切关系[6],肿瘤细胞能够逃逸周期检查点而无限制地增殖,导致凋亡减少。因此,如果能够通过药物来打破这种失控的增殖现象,则可在一定程度上减缓肿瘤的进展。本实验发现莪术醇呈现出浓度-时间依赖性地抑制胃癌AGS细胞的增殖活性,促进胃癌AGS细胞凋亡,诱导胃癌AGS出现G2/M期、G0/G1期的周期阻滞,并且可以抑制细胞的迁移和修复。据此可推断莪术醇对胃癌AGS细胞的生长活性的抑制作用可能是通过促进凋亡、抑制迁移和修复以及诱导周期阻滞而实现。
细胞凋亡是细胞程序性死亡的形式之一,使受损细胞被有效清除[7],维持正常新陈代谢。目前已经发现越来越多的疾病与凋亡异常有关,癌症为其中的一种。本实验用莪术醇干预胃癌AGS细胞后呈现出时效-量效依赖性地增加细胞凋亡率。同时,为了探究诱导凋亡发生的可能原因,本研究检测了Caspase-3、Bax和Bcl-2三个经典凋亡蛋白的表达,发现经莪术醇干预后Bax和Caspase-3蛋白水平明显上调,Bcl-2蛋白水平明显下调。Bcl-2蛋白家族在调控细胞的存活和凋亡中起着重要作用,Bcl-2是抗凋亡蛋白,Bax是促凋亡蛋白[8]。二者可以在细胞内形成异质二聚体而失活,当两者相对的比例失衡时,会导致线粒体膜的完整性被破坏,增加线粒体自身的通透性,造成细胞膜内外Ca2+失衡,损伤外膜,释放出细胞色素C。当细胞色素C进入胞质内后,激活Caspase家族的级联反应,最终激活凋亡执行蛋白Caspase-3,引起细胞凋亡进程的改变[9-10]。
PI3K/Akt/mTOR信号通路在细胞以及多种肿瘤实体的存活、增殖、分化及促血管生成等多方面起着重要作用[11-12],是一条经典的抗凋亡、促增殖信号通路[13]。该信号通路组成复杂,生物功能广泛,在胃癌、肺癌、肝癌、肾癌、卵巢癌等多种癌症中均可见其调控功能异常[14-17],是临床上很多疾病治疗药物筛选的靶点。研究发现在胃癌组织中Akt信号通路异常活化,活化后的信号通路影响细胞的正常增殖、凋亡及迁移进程,并且活化的Akt还会进一步将信号向下传导转化底物,激活下游的众多靶蛋白包括mTOR,调控细胞的生长、增殖和分化[18]。因此,PI3K/Akt/mTOR信号通路被作为研究胃癌进展的重要靶点。同时有研究证实,Akt是一个重要的抗凋亡因子,当抑制PI3K/Akt信号通路时,可以抑制肿瘤细胞中Bcl-2蛋白的表达,促进Bax和Caspase-3蛋白表达,从而促进癌细胞的凋亡[19-20]。本实验发现莪术醇可以显著抑制胃癌AGS细胞中PI3K/Akt/mTOR信号蛋白的磷酸化水平,上调细胞凋亡蛋白Caspase-3和Bax的表达,下调抗凋亡蛋白Bcl-2的表达。因此,莪术醇可能通过失活PI3K/Akt/mTOR信号通路来抑制胃癌AGS细胞的生长,诱导细胞的凋亡。
综上所述,莪术醇可以通过抑制生存信号通路PI3K/Akt/mTOR的表达来诱导胃癌AGS细胞凋亡增加,阻滞受损细胞的异常增殖,对肿瘤的发生和进展产生明显的延缓作用,为莪术醇用于胃癌的治疗提供了实验依据。同时,实验的不足之处为尚未通过体内实验验证莪术醇对胃癌AGS细胞的作用是否与体外实验相一致,以及在莪术醇的作用下PI3K/Akt/mTOR信号通路的作用是否与其他信号通路交互影响。关于莪术醇对胃癌抗肿瘤作用的具体疗效及更深入机制还需要从基因等方面进行探讨与证实。

