葛根素通过mTOR信号通路抑制小胶质细胞活化治疗慢性术后痛实验研究
陆培春,潘鹏
昆山市中医医院麻醉科,江苏 昆山215300
慢性术后疼痛已被描述为一个主要的公共问题[1],患病率在5%~85%[2],该比率取决于手术类型和测量工具[3]。但目前来看,慢性术后疼痛的管理,仍无法得到满意的效果,越来越多的工作正在努力探索新的潜在目标或镇痛策略。中枢神经系统的胶质细胞发生表型和功能的改变,导致了慢性痛的产生和发展[4]。小胶质细胞(MG)活化后具有M1 和M2两种表型,分别有促炎、抑炎不同的功能[5]。但通过调节MG 表型转化,哺乳动物雷帕霉素靶蛋白(mTOR)通路可发挥其潜在的抑制中枢炎性反应的作用[6]。葛根素是葛根的主要成分,已被证明在多种疾病中有效抑制促炎细胞因子的产生和(或)胶质细胞的激活[7-8]。笔者推测葛根素可以通过mTOR 抑制MG 活化,本研究旨在通过建立慢性术后疼痛模型来研究葛根素对慢性疼痛的作用及其相关的作用机制。
1 材料与方法
1.1 实验动物及分组雄性Sprague-Dawley(SD)大鼠由南通大学实验动物中心提供,伦理委员会批准(编号:S2022118-009),体质量200~250 g,鼠龄8~10 周。50 只大鼠被随机分成对照组、假手术组、模型组、葛根素组、mTOR 抑制剂组5组,每组10 只。大鼠都被饲养在适宜的环境当中。
1.2 大鼠皮肤/肌肉切口牵拉(SMIR)模型的制备及处理按照Flatters SJ[9]的方法建立大鼠SMIR 模型,对照组:不做任何处理。假手术组:戊巴比妥钠30 mg/kg 麻醉大鼠后,无菌条件下在右后肢隐静脉内侧3~4 mm处,切割皮肤1.5~2 cm 后缝合。模型组:在假手术组基础上暴露浅层肌肉,避开隐神经,将撑开器头部放入浅层肌肉下撑开至2 cm,暴露内收肌筋膜,持续1 h(见图1A)后缝合。葛根素组:在模型组基础上,参照文献[10]自建模第1 天开始腹腔注射葛根素(100 mg/kg),连续给药7 d。mTOR 抑制剂组:在模型组基础上,连续7 d 腹腔注射mTOR 抑制剂(雷帕霉素,1 mg/kg[11])。
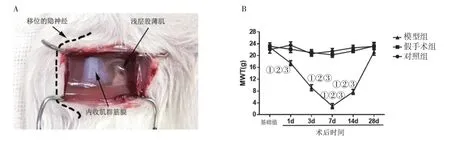
图1 SMIR 后不同时间点MWT
1.3 机械性刺激缩爪阈值(MWT)检测按照Dixon WJ[12]方法测定MWT,von Frey filament 纤毛刺激仪(美国North Coast Medical 公司)按照刚度力的递增顺序(0.16~26 g)垂直刺激术侧后爪的足底中部区域,以von Frey 轻微弯曲并保持约6~8 s 作为标准,出现缩爪、舔爪及爪子急剧撤回等现象视为阳性反应,否则为阴性。从0.16 g 开始,升降法记录5次,有2 次或2 次以上的反应视为机械性触诱发痛。若无则用相邻的大1 级力度刺激,如出现2 次及以上的阳性反应则给予相邻小1 级力度的刺激,再连续测定5次,间隔30 s。对照阈值表查阈值,单位为“g”。
1.4 蛋白质印迹(Western blot)检测mTOR、pmTOR 蛋白表达麻醉后收集术后第7 天L3~5腰膨大,全细胞裂解试剂盒(上海生工公司)用于组织样品蛋白提取。将100 μg 总蛋白加载到相应浓度的凝胶泳道上(上海生工公司)进行分离。然后用转移系统(美国伯乐公司)将蛋白转移到0.45 mm PVDF 膜上。在室温下将膜放在含有5.0%脱脂奶粉的Tris 缓冲盐水和Tween-20 封闭溶液中孵育2 h,然后在一抗封闭溶液中4.0 ℃下孵育过夜:mTOR(1∶1 000,美国CST 公司)、p-mTOR(1∶1 000,美国CST 公司)和GAPDH(1∶5 000,美国Sigma 公司)。用Tris缓冲盐水和Tween 20(10 min/次)洗膜3次,室温下用羊抗兔二抗(1∶5 000,美国Jackson 公司)孵育2 h。洗涤后,使用Tanon 2500 凝胶成像系统和超敏ECL 化学发光检测试剂盒(爱必信生物科技公司)检测。使用Image J 分析结果,计算条带的灰度值,GAPDH 作为内参。
1.5 免疫荧光染色法观察mTOR 定位及MG 激活选取术后第7 天大鼠麻醉后,收集L3~5腰膨大,4%多聚甲醛固定,蔗糖溶液脱水。切成6 μm 的厚度冰冻切片。室温下用磷酸盐缓冲液(PBS)洗涤,1%TritonX-100 通透1 h,5%牛血清封闭2 h,用1%血清稀释一抗。切片与mTOR(1∶100,美国CST 公司)、NeuN(1∶100,美国CST 公司)、GFAP(1∶100,美国CST 公司)和Iba1(1∶100,英国abcam 公司)孵育。4.0 ℃过夜,用PBS 洗涤10 min×3 次。用PBS稀释二抗,Cy3-山羊抗兔IgG(1∶1 000,美国Jackson公司)和FITC-山羊抗小鼠IgG(1∶1 000,美国Jackson 公司)。室温下避光孵育2 h,PBS 冲洗15 min×3次,封片。荧光显微镜进行拍照。
1.6 统计学方法采用SPSS22.0 软件分析实验数据,数据以均数±标准差()表示。行为学数据采用重复测量方差分析。Image J 软件分析蛋白质印迹特异性条带密度以及免疫荧光强度值,多组间比较采用单因素方差分析,先进行正态性与方差齐性检验。若方差齐,两两比较采用LSD 法。若方差不齐,先行Welch(W)校正检验,然后用Dunnett′s T3法。P<0.05 为差异有统计学意义。所有实验至少重复3 次。
2 结果
2.1 SMIR 后不同时间点MWT见图1。按照Flattes SJ等[9]方法成功复制和建立了SMIR 模型(图1A),检测MWT。对照组、假手术组、模型组术前MWT 基础值分别为(23.42±1.12)g、(23.16±1.14)g和(22.76±0.87)g,差异无统计学意义(P>0.05)。与基础值比较,假手术组痛阈无明显变化,而模型组在术后第1、3、7、14 天痛阈呈进行性下降(P<0.05);与对照组和假手术组比较,模型组显著降低(P<0.05)(图1B)。
2.2 蛋白质印迹检测大鼠脊髓中mTOR、p-mTOR蛋白表达见图2。与对照组相比,假手术组和模型组术后7 d 脊髄中mTOR 表达无升高,差异无统计学意义(P>0.05)。与对照组、假手术组相比,模型组术后7 d 脊髄中p-mTOR 表达增加(P<0.05)。

图2 大鼠腰段脊髓背角mTOR、p-mTOR 蛋白表达
2.3 免疫荧光检测mTOR 蛋白在大鼠脊髓中定位见图3。为研究mTOR 在大鼠脊髓中具体表达于哪些细胞中,选取模型组术后第7 天的脊髓组织切片,将mTOR 分别与脊髓中各类细胞标记物进行免疫荧光双标。结果显示:mTOR 与Iba1 共定位,与GFAP和NeuN 不定位。
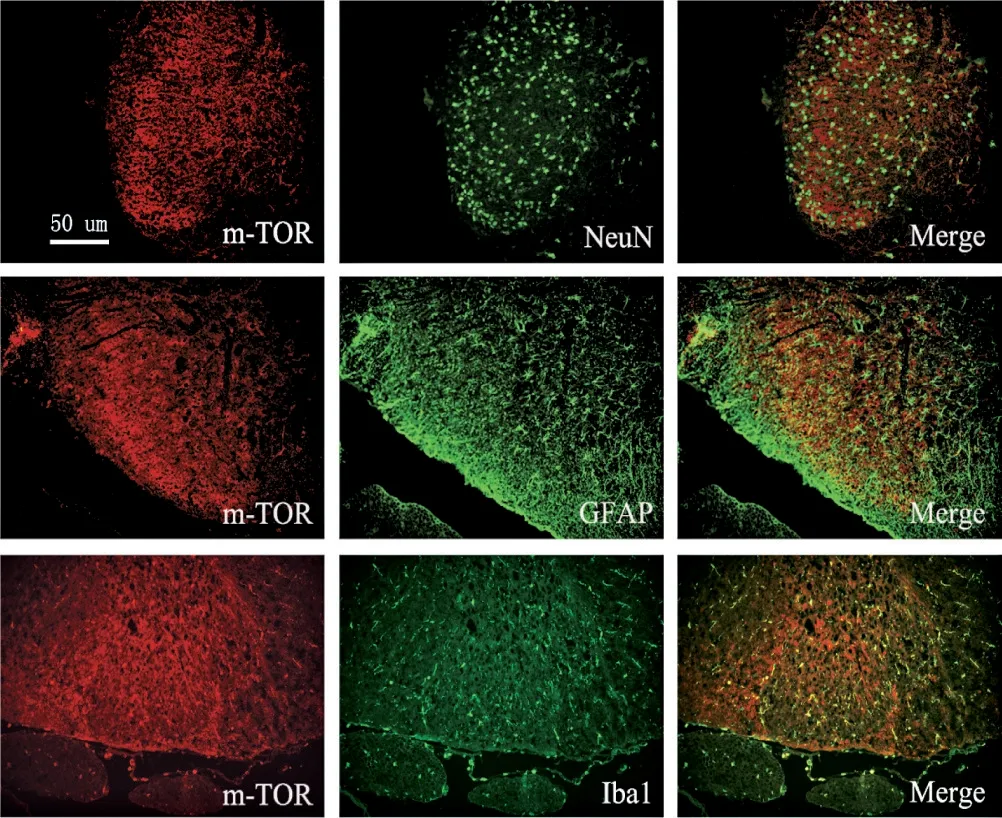
图3 mTOR 在脊髓中定位(×200,标尺50 μm)
2.4 腹腔注射葛根素、雷帕霉素后大鼠行为学变化见图4。葛根素、雷帕霉素给药后检测MWT。假手术组、模型组、葛根素组和抑制剂组术前MWT基础值分别为(23.16±1.14)g、(22.76±0.87)g、(23.24±1.02)g 和(22.58±0.64)g,差异无统计学意义(P>0.05)。与模型组术后3 d、7 d、14 d 比较,葛根素组和抑制剂组MWT 显著升高(P<0.05);表明葛根素、雷帕霉素可提高SMIR 大鼠痛觉阈值,缓解机械性痛觉过敏。

图4 腹腔注射葛根素、雷帕霉素后大鼠行为学变化
2.5 腹腔注射葛根素后mTOR、p-mTOR 蛋白表达变化见图5。与假手术组、模型组相比,葛根素组术后7 d 脊髄中mTOR 表达无升高,差异无统计学意义(P>0.05)。与假手术组、模型组相比,葛根素组术后7 d 脊髄中p-mTOR 表达降低(P<0.05),提示葛根素可以降低mTOR 磷酸化。

图5 腹腔注射葛根素后mTOR、p-mTOR 蛋白表达变化
2.6 腹腔注射葛根素、雷帕霉素抑制脊髓中MG 活化见图6。免疫荧光染色方法检测MG 特异性标记物Iba1 的表达。与假手术组相比,模型组大鼠脊髓背角Iba1 阳性面积显著增加(P<0.05);与假手术组比较,葛根素组、mTOR 抑制剂组Iba1 阳性面积增加(P<0.05)。与模型组相比,葛根素组、mTOR 抑制剂组Iba1 阳性面积显著降低(P<0.05)。
3 讨论
慢性疼痛在治疗上的选择有限,是值得学者们重点研究的问题。阿片类药物仍然是慢性疼痛的常规治疗方法,但长时间暴露于阿片类药物治疗会产生耐受和痛觉过敏。中医药以其疗效确切、副作用少等优势逐渐受到人们的关注。有文献[13]表明,鞘内给药葛根素可以通过抑制神经炎性过程和胶质细胞的激活,在坐骨神经慢性压迫损伤模型和糖尿病引起的神经性疼痛中产生剂量依赖性抗伤害效应[14],并且葛根素还可通过抑制促炎介质减轻完全氟氏佐剂诱导的炎症动物模型中的疼痛[15]。这些研究结果提示葛根素对各种因素引起的慢性疼痛有缓解作用,但其对慢性术后痛的作用及作用机制研究尚少,哪些重要的分子参与整个过程有待深入的研究。
本实验构建SMIR 慢性术后痛模型,分别检测各组大鼠的MWT 发现,建模后7 d 模型组大鼠痛阈显著下降至建模后28 d 逐渐恢复,与既往研究结果一致[16],表明SMIR 模型建立成功;葛根素组在经过葛根素治疗7 d 以后,可明显缓解大鼠疼痛,提高机械痛阈,表明葛根素对慢性术后痛也具有一定的疗效。葛根素是从天然植物葛根中提取的一种C-糖基化大豆异黄酮,具有抗炎、抗氧化和抗凋亡的作用,目前较广泛的应用于治疗心血管系统的疾病。近年的研究发现葛根素对各种慢性疼痛有缓解作用[17-18]。该实验进一步发现葛根素可能通过抑制mTOR 通路治疗慢性术后痛。
mTOR 是一种丝氨酸/苏氨酸蛋白激酶,大多数研究mTOR 在疼痛中作用的研究都集中在脊髓水平,在背角浅层和背根神经节中发现mTOR 的表达[19]。发现在癌症相关炎症和神经病理性疼痛包括脊髓损伤时,在背角和背根节的mTOR 的磷酸化水平会增加。此外,在炎症性和神经病理性疼痛的动物模型当中,使用mTOR 抑制剂雷帕霉素可降低背角神经元的过度兴奋性和抗伤害性[20]。笔者发现大鼠脊髓中mTOR 蛋白表达在建模及葛根素治疗后无明显变化,但p-mTOR 在建模后表达升高,而在葛根素治疗后表达减低,表明慢性术后痛可使mTOR 磷酸化水平增高,而葛根素可降低mTOR 磷酸化水平。并且脊髓p-mTOR 的蛋白表达变化伴随着大鼠痛觉阈值变化,提示mTOR 磷酸化可能参与慢性术后痛的发生以及发展。而在结节性硬化症复杂脑损伤中发现了mTOR 磷酸化与MG 促炎激活之间有直接联系,mTOR 磷酸化导致促炎MG 活化[21],笔者发现注射mTOR 抑制剂雷帕霉素后大鼠疼痛缓解,而脊髓背角MG 激活减弱,这进一步揭示了在SMIR 模型中mTOR 磷酸化和MG 的联系。
有报道腹腔注射葛根素可抑制脊髓胶质细胞的活化和炎症反应[22]。在中枢神经系统中,本实验发现mTOR 在脊髓背角中主要表达在MG中,另外发现大鼠建模后机械痛阈下降,mTOR 磷酸化水平增高,同时脊髓背角MG 特异性细胞标记物Iba1 荧光阳性面积增加,MG 显著激活;而葛根素治疗后大鼠机械痛阈升高,mTOR 磷酸化水平降低,同时脊髓背角MG激活减弱,特异性细胞标记物Iba1 荧光阳性面积减少,表明葛根素可显著抑制MG 活化。
综上所述,本实验通过构建SMIR 慢性术后痛模型,观察葛根素对其疗效及大鼠脊髓背角内mTOR、p-mTOR 的变化和MG 激活情况,初步探究了慢性术后疼痛的相关分子变化,葛根素可通过抑制mTOR磷酸化减少MG 活化从而缓解慢性术后痛。
——雷帕霉素

