初级体感皮层星形胶质细胞参与电针治疗炎性痛的实验研究
谢创波,艾娟,李向宇,赵高峰,许能贵
1.广州中医药大学第二附属医院,广东 广州510006
2.广州中医药大学针灸康复临床医学院华南针灸研究中心,广东 广州510006
电针(EA)镇痛效果确切,临床应用广泛,但其机制仍未完全阐明。一直以来,研究者们认为电针镇痛主要与疼痛神经传导通路上相关神经元的活动变化有关[1-2]。近年来,星形胶质细胞在疼痛的发生和调控中的作用被越来越多的研究者所报道[3-5]。多项研究表明,电针可以通过抑制脊髓星形胶质细胞的活化而发挥镇痛作用[6-8]。在疼痛传入通路的大脑皮层感觉区域——初级体感皮层中,星形胶质细胞也参与了疼痛的形成[9]。然而,初级体感皮层星形胶质细胞是否在电针镇痛中发挥作用仍未见报道。本研究旨在通过观察初级体感皮层星形胶质细胞在电针治疗炎症性疼痛中的作用,探讨初级体感皮层星形胶质细胞是否参与电针镇痛,探索电针镇痛的可能机制。
1 材料与方法
1.1 实验动物选取健康SPF 级8~12 周雄性C57小鼠80只,体质量(25±3)g,购自广东至远生物医药科技有限公司,合格证号为SCXK(粤)2021-0057。饲养于光照与黑暗各12 h 循环交替,温度控制在(23±1)℃的环境中,自由摄食和饮水。本动物实验经广州中医药大学实验动物伦理委员会批准(No.20220629001),在广州中医药大学华南针灸研究中心完成。
1.2 实验分组与造模本研究分3 部分实验。实验一为电针治疗炎性痛效果的观察,将实验小鼠随机分为4 组(每组8 只):空白对照组(ShamCFA 组)、模型组(CFA 组)、假电针组(CFA+ShamEA 组)和电针组(CFA+EA 组)。除ShamCFA 组外,其余3 组均在异氟烷麻醉下于左后足底缓慢注射完全弗氏佐剂(CFA)20 μL。ShamCFA 组以相同方法注射等体积0.9%氯化钠溶液。实验二为观察抑制星形胶质细胞对小鼠痛阈及电针镇痛效果的影响,将实验小鼠随机分为4 组(每组8 只):模型组(CFA+aCSF 组)、星形胶质细胞抑制组(CFA+L-α-AAA 组)、电针组(CFA+aCSF+EA 组)和星形胶质细胞抑制复合电针组(CFA+L-α-AAA+EA 组),各组CFA 造模方法同实验一。实验三为观察激活星形胶质细胞对电针镇痛效果的影响,将实验小鼠随机分为2 组(每组8 只):化学遗传激活组(CFA+EA+CNO 组)和化学遗传对照组(CFA+EA+Saline 组),2 组均需造模,方法同实验一。
1.3 穴位选取及电针本实验中电针穴位为左下肢“环跳”穴和“阳陵泉”穴,按照中国中医药出版社《实验针灸学》定位,分别为后肢髋关节上缘0.3 cm 处和后肢腓骨小头前下方凹陷处。电针时将华佗牌无菌针灸针(苏州医疗用品厂有限公司,规格:0.25 mm×13 mm)刺入皮肤2~3 mm,电针参数为频率2 Hz、电流1 mA,每次30 min,连续7 d。实验一中空白对照组和模型组不进行电针,假电针组仅将针灸针刺入皮下,不通电。实验一和实验三小鼠在造模后第2 天进行电针治疗。实验二所有小鼠在药物注射3 d 后进行电针治疗。
1.4 立体定位注射与化学遗传操纵实验二中所有小鼠在CFA 造模后第2 天进行脑区药物注射。在异氟烷麻醉下,CFA+L-α-AAA 组和CFA+L-α-AAA+EA 组注射星形胶质细胞选择性胶质毒素L-α-氨基己二酸(L-α-AAA)(上海西格玛奥德里奇贸易有限公司,货号A7275),使用人工脑脊液(aCSF)配制为0.1 mol/L,注射区域为初级体感皮层后肢区(S1HL),坐标为(AP-0.5 mm,ML-1.75 mm),注射深度为硬脑膜下0.65 mm,注射量为1 μL,CFA+aCSF 组和CFA+aCSF+EA 组仅注射等量人工脑脊液。
实验三中所有小鼠在CFA 造模前3 周进行病毒注射。2 组小鼠均在异氟烷麻醉下注射化学遗传激活病毒rAAV-GfaABC1D-hM3D(Gq)-mCherry,AAV2/5(武汉枢密脑科学技术有限公司,批次5-1169-K210810,滴度5.31E+12 vg/mL)。注射区域和深度同实验二,病毒注射量为200 nL,注射速度40 nL/min。CFA+EA+CNO 组在每次电针前40 min 按1 mg/kg 腹腔注射N-氧化氯氮平(CNO)(武汉枢密脑科学技术有限公司,批次CNO-220412)以特异性激活初级体感皮层星形胶质细胞。CFA+EA+Saline 组电针前40 min腹腔注射等量0.9%氯化钠溶液。
1.5 疼痛阈值检测本实验分别使用VonFrey 电子测痛仪(深圳市瑞沃德生命科技有限公司)和红外热痛测试仪(深圳市瑞沃德生命科技有限公司)进行机械痛阈值(PWT)和热痛阈值(TL)检测。分别于造模前1 天(Baseline)、造模后1 天(Model)和电针第1、3、5、7 天(Day1、Day3、Day5、Day7)进行检测,共6 次。每次痛阈检测重复3次,每次间隔大于5 min,取平均值作为该次测量值。
1.6 病毒表达位置验证及免疫荧光检测最后一次疼痛阈值检测后在麻醉下将实验小鼠进行心脏灌注和断头取脑,4%PFA 固定后分别使用15%和30%蔗糖溶液进行梯度脱水。小鼠脑组织在30%蔗糖溶液中沉底后,按照第4 版脑立体定位图谱,使用冰冻切片机进行大脑切片,厚度40 μm。分别使用兔源胶质纤维酸性蛋白(GFAP)多克隆抗体(一抗,广州昂科生物科技有限公司,批号WF3312325C)、驴抗兔IgG,Alexa Fluor 488 抗体(二抗,广州昂科生物科技有限公司,批号2286294)和4′,6-二脒基-2-苯基吲哚(DAPI,碧云天生物技术有限公司)对小鼠脑片进行免疫荧光染色。标本制备完成后,使用共聚焦显微镜(尼康,日本)拍摄荧光图片。
1.7 统计学方法所有实验数据使用SPSS20.0 软件进行统计分析,计量资料以均数±标准差()表示。采用Shapiro-Wilk 检验进行正态性检验。各组不同时间点疼痛阈值的比较,符合正态分布时采用两因素重复测量资料的方差分析,两两比较采用Bonferroni 事后检验。不符合正态分布时采用秩和检验。P<0.05 表示有显著性差异。
2 实验结果
2.1 电针治疗对炎性痛小鼠疼痛阈值的影响见图1。造模24 h后,除ShamCFA 组外,各组小鼠PWT 和TL 与基线值相比均显著下降(P<0.05),提示造模成功。与CFA 组比较,CFA+EA 组电针治疗第3、5、7 天PWT 均显著上升(P<0.05);而CFA+ShamEA 组各时间点PWT 与CFA 组均无明显差异(P>0.05)。与CFA 组比较,CFA+EA 组TL 在电针治疗第3、5、7 天均显著上升(P<0.05);而CFA+ShamEA 组各时间点TL 与CFA 组均无明显差异(P>0.05)。
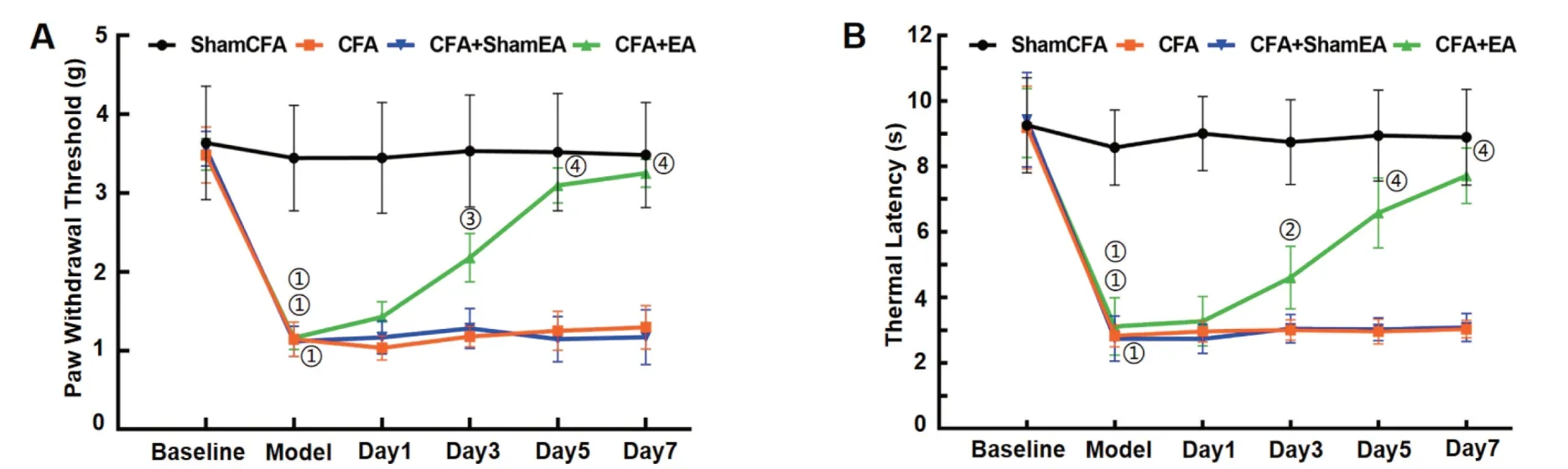
图1 各组小鼠疼痛阈值检测结果比较
2.2 抑制初级体感皮层星形胶质细胞对炎性痛小鼠疼痛阈值及电针镇痛效果的影响见图2。与CFA+aCSF 组比较,CFA+L-α-AAA 组在造模后抑制了初级体感皮层的星形胶质细胞,显著提高了炎性痛小鼠的PWT 和TL(P<0.05),并可维持到电针第7 天的时间点。与CFA+aCSF+EA 组比较,CFA+L-α-AAA+EA 组在电针第1、3 天PWT 显著提高(P<0.05);而在电针第5、7天,2 组PWT 无显著差异(P>0.05)。与CFA+aCSF+EA 组比较,CFA+L-α-AAA+EA 组在电针第1、3 天TL 显著提高(P<0.05);而在电针第5、7天,2 组TL 无显著差异(P>0.05)。另外,与CFA+L-α-AAA 组比较,CFA+Lα-AAA+EA 组在电针第7 天PWT 和TL 均显著提高(P<0.05)。
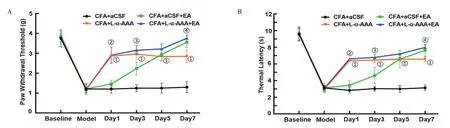
图2 各组小鼠疼痛阈值检测结果比较
2.3 化学遗传操纵病毒转染初级体感皮层星形胶质细胞的情况见图3。本研究使用带有星形胶质细胞特异性启动子GfaABC1D 的重组腺相关病毒(rAAV)来转染S1HL 脑区星形胶质细胞,在细胞膜表面表达化学遗传激活的元件——hM3Dq(一种G 蛋白偶联受体,可被外源性药物CNO 特异性激活)。图3B 展示了病毒转染的范围,病毒表达报告蛋白——mCherry(红色)的范围指示了hM3Dq 准确表达于S1HL脑区。图3C 中CFA+EA+Saline 组和CFA+EA+CNO组的化学遗传病毒均可准确与星形胶质细胞特异性标记物——GFAP 共标,提示2 组病毒均转染皮层星形胶质细胞并星形胶质细胞表达化学遗传操纵元件。

图3 星形胶质细胞化学遗传病毒注射位点示意图及病毒表达情况
2.4 化学遗传激活初级体感皮层星形胶质细胞对电针镇痛效果的影响见图4。与造模24 h 后PWT 比较,CFA+EA+Saline 组电针第3、5、7 天的PWT 显著提高(P<0.05)。与CFA+EA+Saline 组比较,CFA+EA+CNO 组电针第3、5、7 天的PWT 均显著降低(P<0.05)。与造模24 h 后TL 比较,CFA+EA+Saline 组电针第3、5、7 天的TL 显著提高(P<0.05)。与CFA+EA+Saline 组比较,CFA+EA+CNO 组电针第3、5、7 天的TL 均显著降低(P<0.05)。
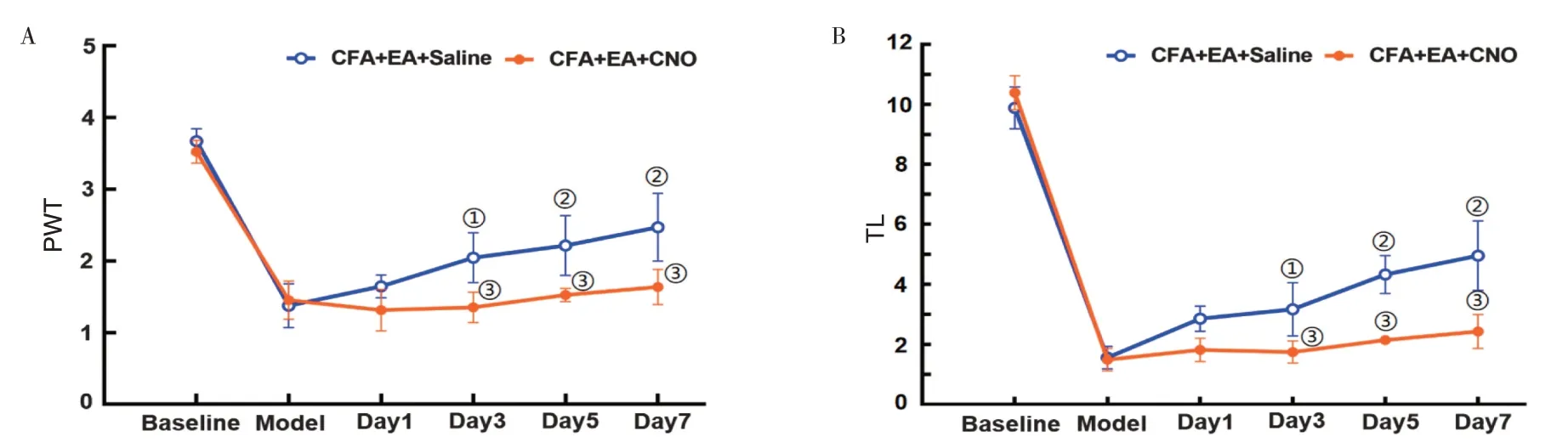
图4 2 组小鼠疼痛阈值检测结果比较
3 讨论
炎症性疼痛是指由创伤、手术以及感染等引起的外周组织损伤并导致炎症时所产生的疼痛,是临床常见的疼痛类型。本研究中,我们选用了国内外较为公认的炎症性疼痛模型—CFA 模型[10]研究。在造模24 h后,小鼠机械痛阈值和热痛阈值的检测均表明了造模成功。电针镇痛是广为认可的治疗疼痛的有效手段之一。据报道,电针可以有效治疗炎症性疼痛[11-12]。参照相关文献[1-2],本研究选取了环跳穴和阳陵泉穴作为电针干预穴位。本研究结果表明,CFA+EA 组在电针治疗第3 天开始出现明显的镇痛效果,随着电针次数的增加,疼痛阈值逐渐升高,说明了电针环跳穴和阳陵泉穴可以有效治疗CFA 诱导的炎性痛,并且存在累积效应。
星形胶质细胞是中枢神经系统中数量最多的一类胶质细胞,主要分布于中枢神经系统神经元周围。在脊髓与初级体感皮层中,疼痛的发生均伴随星形胶质细胞的激活[6-7,9]。电针可以抑制脊髓星形胶质细胞的活性而发挥镇痛作用[6-8]。由此可以推测,电针也可能通过对初级体感皮层星形胶质细胞产生抑制作用而发挥镇痛作用。本研究中,使用星形胶质细胞选择性胶质毒剂——L-α-AAA[13]对初级体感皮层星形胶质细胞进行抑制,并观察抑制星形胶质细胞对炎性痛小鼠疼痛阈值的影响,结果发现,与电针治疗的效果类似,抑制星形胶质细胞可以提高炎性痛小鼠的疼痛阈值。与电针治疗的累积效应不同的是,直接抑制星形胶质细胞的CFA+L-α-AAA组在电针第1 天的时间点就呈现出提高痛阈的效果,并维持到第7 天。在电针治疗的第1 天和第3天,CFA+L-α-AAA+EA 组小鼠的疼痛阈值显著高于CFA+EA组,这可能是由于L-α-AAA 对星形胶质细胞的抑制程度强于这两个时间点电针所能达到的效应。值得注意的是,虽然L-α-AAA 对星形胶质细胞的抑制可以显著提高疼痛阈值,但是在电针治疗的第5 天和第7天,CFA+L-α-AAA+EA 组小鼠的疼痛阈值与CFA+EA 组无明显差异,提示我们电针治疗炎性痛的机制可能包含了对星形胶质细胞的抑制,即星形胶质细胞参与了电针镇痛。在电针治疗第7天,CFA+L-α-AAA+EA 组小鼠的疼痛阈值显著高于CFA+L-α-AAA组,这提示星形胶质细胞的参与只是电针治疗炎性痛的部分机制。
为了进一步证明星形胶质细胞参与电针治疗炎性痛,本研究使用化学遗传学的方法激活初级体感皮层星形胶质细胞,并观察其对电针镇痛的影响。本研究结果表明,在电针治疗时激活初级体感皮层的星形胶质细胞可以翻转电针的镇痛作用。这与通过间接活化星形胶质细胞翻转电针镇痛效应的研究结果类似[14]。该研究中,研究者通过鞘内注射选择性腺苷A1 受体抑制剂引起了脊髓L4~6节段星形胶质细胞的活化,逆转了电针的镇痛效果,从而证明了脊髓星形胶质细胞参与了电针镇痛作用[14]。
Sun Kwang K等[9]研究发现,激活初级体感皮层星形胶质细胞代谢性谷氨酸受体5(mGluR5)信号通路可以诱发长时间的痛觉过敏,而阻断星形胶质细胞mGluR5 信号通路则可以抑制机械痛觉过敏。阻断星形胶质细胞谷氨酸信号通路也可能是本研究中抑制星形胶质细胞和电针治疗提高疼痛阈值的潜在原因。对“三联突触”(由突触前膜、突触后膜及包绕在其周围的星形胶质细胞三部分共同组成)的研究表明星形胶质细胞可以感知和调控神经元活动[15]。大脑皮层神经元和星形胶质细胞的交互作用与疼痛的发生有关[4,9]。Yin W等[4]研究者发现,前扣带回皮层星形胶质细胞与神经元之间的乳酸转运与CFA 诱导的炎症性疼痛密切相关。抑制糖异生和乳酸释放可以阻断CFA 诱导的持续疼痛,而外源性L-乳酸可以逆转这种效应。初级体感皮层星形胶质细胞参与电针治疗炎性痛的机制也可能是由于电针抑制了皮层星形胶质细胞与神经元之间的代谢物质转运。本研究仅从初级体感皮层星形胶质细胞的抑制和激活对电针治疗炎症性疼痛的影响这一角度说明初级体感皮层星形胶质细胞参与了电针镇痛。电针如何影响初级体感皮层星形胶质细胞的活性,以及神经元与星形胶质细胞如何相互作用并最终影响电针镇痛效果仍需要进一步的研究。另外,初级体感皮层星形胶质细胞是否在电针治疗其他类型的疼痛发挥作用仍有待探讨。
总之,本研究结果表明电针环跳穴和阳陵泉穴可以有效治疗CFA 诱导的炎症性疼痛,而初级体感皮层星形胶质细胞参与电针治疗炎性痛。对初级体感皮层星形胶质细胞的干预可能是电针镇痛的机制之一,也可能是炎症性疼痛治疗的靶点。

