痛风舒片治疗痛风的作用机制和疗效研究
孙晓慧,马晶,柳杰
哈尔滨市第一医院内分泌科一病房,黑龙江哈尔滨 150001
痛风病变为单钠尿酸盐沉积造成的晶体相关性关节病变,典型诱因为大量食用嘌呤高食物[1]。痛风病变在典型症状表现,一般是可见突然性关节疼痛不适,且关节部位见疼痛、水肿以及炎症,而若是关节腔间尿酸盐大量沉积则造成急性关节疼痛不适,正常生活及工作因此受到巨大影响,所以也强调及早做对应性干预。常规抗痛风药是一类通过抑制尿酸的合成、抑制尿酸在肾小管的重吸收或促进尿酸排泄而产生治疗作用的药物,且在临床应用中存在一定的药物依赖性[2]。急性痛风属于中医学之痹证;其病因病机为肾虚,湿邪阻滞,热毒攻于手足;以湿热蕴结为主要证型;治疗以清热利湿为主,方多为四妙散加减;针灸治疗以循经取穴针刺和局部围刺放血为主;中药外敷多以大黄、黄柏等清热泻火解毒药敷于关节痛处;中医药治疗急性痛风不良反应少。因而中药作为改善患者预后的方法,以痛风舒片为代表的药物,在临床实践中凸显了明显的优势[3]。本文为研究痛风舒片治疗痛风的作用机制和疗效,特选择2022年1—6 月正常成年SD 雄性大鼠40 只进行处理,现报道如下。
1 材料与方法
1.1 材料来源
选取正常成年SD 雄性大鼠,清洁级,共40 只,体质量180~265 g,平均(220±20)g。均给予普通的饲料喂养,自由饮水。本研究经动物伦理委员会的批准(伦理号:HJ28415365)。
1.2 方法
1.2.1 主要试剂 痛风舒片(国药准字Z20080410;规格:0.3 g×12 片×2 板);双氯芬酸钠肠溶片(国药准字H11021640;规格:25 mg×30 片);5-羟色胺(5-HT)、钾离子(K+)、多巴胺(DA)、去甲肾上腺素标准品及尿酸钠结晶均购自Sigma 公司。
1.2.2 尿酸溶液制备 194 mL 蒸馏时加6 mL NaOH(1 mol∕L),在煮沸后加入1 g 的尿酸,使用1 mol∕L HCL,调节pH 值为7.2,充分搅拌后冷却,之后贮藏到4℃冰箱中保存24 h,获取上清液借助滤纸吸干沉淀物的水分,充分干燥后获得尿酸钠结晶。取1 250 mg 尿酸钠结晶加45 mL 生理盐水,加热搅拌配制成50 mL 尿酸钠溶液。
1.2.3 动物分组 实验小鼠分成正常组(不做任何处理)、模型组(用6 号注射针在受试大鼠右侧踝关节背侧从45°方向插入胫骨肌肌腱内侧,将0.2 mL尿酸钠溶液,浓度为2.5 g∕100 mL,注入踝关节腔)、双氯芬酸组(用6 号注射针在受试大鼠右侧踝关节背侧从45°方向插入胫骨肌肌腱内侧,将0.2 mL 双氯芬酸溶液注入踝关节腔)、痛风舒片组(用6 号注射针在受试大鼠右侧踝关节背侧从45°方向插入胫骨肌肌腱内侧,将0.2 mL 痛风舒片同1 mL 生理盐水混合液注入踝关节腔),每组10 只。选取模型动物,主要是在关节周围,见软组织的明显充血∕水肿表现,关节滑膜细胞,见线粒体、内质网细胞器肿胀表现,将其判定顺利完成造模工作。尿酸钠(Sodium urate, MSU)可诱导巨噬细胞高表达MRP8;MRP8 siRNA 转染能有效干扰巨噬细胞中髓样相关蛋白8(MRP8)的表达。
1.2.4 尿酸水平、大鼠步态测定 通过体外细胞模型筛选中药提取物及标准品对MSU 刺激的体外急性痛风模型的抗炎作用;通过超高效液相色谱-质谱∕质谱(UPLC-MS∕MS)的方法监测黄嘌呤氧化生成尿酸的含量,反应中药提取物及标准品对XOD 的抑制作用。以痛风舒片的有效成分为测定指标,采用体外扩散池法,利用新鲜大鼠离体皮肤,分别于透皮的1、2、3、4 h 采取5 mL 接受液。用TLC 定性法及薄层扫描定量法测定内含的桂皮醛是可以透过大鼠皮肤的,其量随给药时间延长而增多。
1.3 观察指标
①借助分光光度仪分析法,分析巨噬细胞中髓样相关蛋白8(myeloid associated protein 8 in macrophages, MRP8)对核因子κB(nuclear factor kappa-B,NF-κB)的影响,以图示予以对比。②关节肿胀测量。干预前及干预后5 d,借助无弹性软尺测定关节周径,观察治疗前后各组大鼠受试关节周径变化。③止痛物质含量测定。大鼠处死后选择受试关节周围软组织,比色法测定钾离子(K+)含量,荧光光度法测定多巴胺(dopamine, DA)、5-羟色胺(5-hydroxytryptamine, 5-HT)含量。
1.4 统计方法
使用SPSS 21.0 统计学软件进行分析,计量资料经检验符合正态分布,以(±s)表示,组间差异比较采用t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 MPR8 对NF-κB 等的影响
MPR8 沉默后巨噬细胞中IL-1β 的分泌降低,NF-κB 表达下调,I-κB 表达上调。见图1。
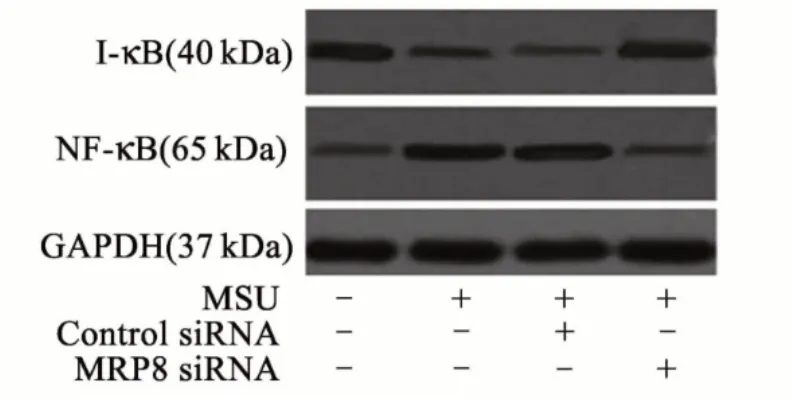
图1 MPR8 对NF-κB 等的影响
2.2 4 组大鼠受试关节周径比较
正常组用药前后受试关节周径比较,差异无统计学意义(P>0.05),模型组、双氯芬酸组、痛风舒片组在用药后5 d 的受试关节周径较用药前增加,差异有统计学意义(P<0.05),见表1。
表1 4 组大鼠受试关节周径变化对比[(±s),cm]
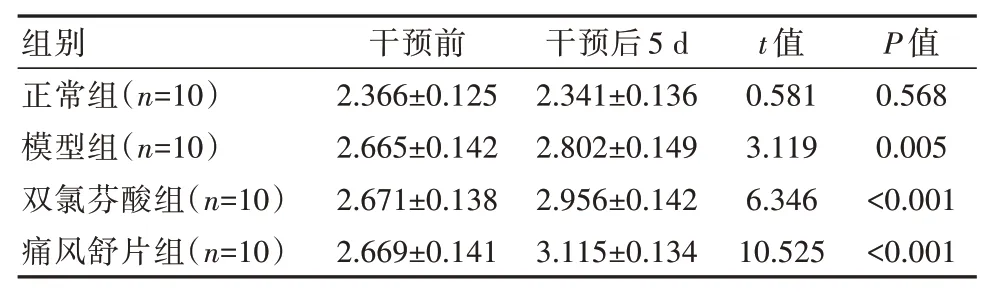
表1 4 组大鼠受试关节周径变化对比[(±s),cm]
组别正常组(n=10)模型组(n=10)双氯芬酸组(n=10)痛风舒片组(n=10)干预前2.366±0.125 2.665±0.142 2.671±0.138 2.669±0.141干预后5 d 2.341±0.136 2.802±0.149 2.956±0.142 3.115±0.134 t 值0.581 3.119 6.346 10.525 P 值0.568 0.005<0.001<0.001
2.3 4 组大鼠受试关节周围止痛物质含量比较
正常组受试关节周围K+、DA、5-HT 水平高于其他3 组,痛风舒片组、双氯芬酸组低于模型组,差异有统计学意义(P<0.05)。见表2。
表2 4 组大鼠受试关节周围止痛物质含量比较(±s)

表2 4 组大鼠受试关节周围止痛物质含量比较(±s)
注:与正常组比较,aP<0.05;与模型组比较,bP<0.05
组别正常组(n=10)模型组(n=10)双氯芬酸组(n=10)痛风舒片组(n=10)F 值P 值K+(mmol∕mg)7.415±0.562(6.021±1.254)a(5.213±0.715)ab(4.562±0.625)ab 21.667<0.001 DA(μg∕mL)9.154±0.826(7.895±1.415)a(5.562±0.802)b(5.246±0.786)b 36.623<0.001 5-HT(μg∕mg)14.425±1.152(11.625±2.415)a(9.336±1.562)ab(8.614±1.284)b 24.400<0.001
3 讨论
中医认为痛风可分为“湿热蕴结”“瘀热阻滞”“痰浊阻滞”“肝肾阴虚”几种证型,辨证治疗可收到显著的效果[4-6]。痛风舒片作为治疗湿热蕴结患者的可行性方法,已在本研究中得到了充分的证实。痛风舒片的主要成分为大黄、车前子、泽泻、川牛膝、防己等。方中大黄有攻积导滞、泻火凉血、逐瘀通经的功效[7],能够更好地抑制MSU 诱导的炎症和抑制XOD 活性,这与其含有的主要活性成分多糖类、鞣质类与蒽醌类相关。虽然大黄攻下较猛,奏效迅速,但易伤正气。在治疗湿热痰阻所致的痛风病患者时,大黄泻下攻积、泻火解毒、活血祛瘀、清泄湿热;车前子主治小便不利,淋浊带下,水肿胀满,暑湿泻痢,目赤障翳,痰热咳喘;泽泻长于利水渗湿,泄热,用于小便不利,水肿胀满;诸药合用,发挥出药物典型性优势[8]。
本次研究中,模型组、双氯芬酸组、痛风舒片组在用药后5 d 的受试关节周径为(2.802±0.149)、(2.956±0.142)、(3.115±0.134)cm,较用药前增加(P<0.05),此外在关节周围止痛物质含量低于正常组与模型组,表明痛风舒片对于大鼠痛风的关节肿胀改善好,并且对疼痛缓解有良好效果。这与曾祥永等[9]的研究保持一致,其研究中显示:用药后痛风舒浸膏粉组、双氯芬酸组受试关节周径为(2.432±0.140)、(2.478±0.140)cm,均比用药前增加(P<0.05)。说明其具有一定的镇痛和抗炎作用。总之,痛风舒片具有清热、利湿、解毒的作用[10]。
痛风舒片清热解毒效用突出,对于湿热所致疼痛不适具备良好的缓解效果。痛风舒片可有效解决高尿酸血症,有效改善痛风石,纠正嘌呤代谢紊乱,分解尿酸,恢复肝肾尿酸代谢功能,使血尿酸浓度降至正常值,痛风石逐渐软化、溶解、排出,使关节逐渐灵活自由,全身舒适[11]。然而,单靠该药根治痛风并不容易,因为痛风比较顽固,而且持续时间比较长[12],治疗时可以结合针灸疗法,还有饮食疗法。疼痛严重时可以加上止疼药缓解。
痛风患者服用痛风舒片后,能够抑制近端肾小管对尿酸盐的重吸收,从而增加尿酸排泄,降低尿酸水平,适合肾功能良好者[13]。建议痛风舒片剂量为0.96 g,3次∕d,饭后口服。用药期间少吃海鲜、动物内脏等食品;忌啤酒和白酒。每日还要大量饮水,量约2 000~3 000 mL,加速排尿,也能降低尿酸浓度[14]。痛风舒可用于痛风关节炎的消炎、消肿、止痛,但是不能从根本上控制痛风病变的进展[11]。治疗痛风最根本的还是控制血尿酸在相对正常的水平,降低血尿酸主要包括抑制尿酸合成,促进尿酸排泄和加呋塞米酸分解,痛风患者最好要在专科医生的指导下应用药物治疗,在临床上常用的西药包括别嘌醇、非布司他、苯溴马隆等。非布司他,是目前比较新的能治疗痛风的药物,效果比较好,具有抑制尿酸生成的作用,又能够促进尿酸排泄,不良反应比别嘌醇、苯溴马隆等传统的药物要小;因而治疗痛风病可以综合疗法来达到很好的疾病控制效果[15]。
综上所述,痛风舒片应用于动物试验的治疗实践中,对强化药物疗效,促进药物吸收,加速控酸具有显著的效果,在因痛风引起的湿热性疾病的治疗中具有极高的疗效,抗炎和镇痛效果突出,值得临床应用实施。

