探讨低氧环境下SDF-1 复合PLGA/胶原三维支架对间充质干细胞增殖和迁移的影响
姜杨,侯继野,徐桂清,郭林娜,李永涛,沈雷,姚立杰
1.齐齐哈尔医学院解剖教研室,黑龙江齐齐哈尔 161006;2.齐齐哈尔市建华医院介入科,黑龙江齐齐哈尔 161006
随着体育运动常见化,肌腱损伤也变得常见化。肌腱处于低氧微环境中,缺少血管滋养,组织再生能力较差[1],传统手术不理想,如何修复损伤肌腱,是医学领域需要主要解决的问题[2],许多学者制备复合肌腱材料来修复肌腱损伤[3]。聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid), PLGA]为良好生物相容性和生物降解性可控的材料[4],但细胞粘附力低。胶原可被人体吸收,但力学性能较差,两者结合有良好生物相容性和力学性能[5]。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是肌腱组织工程常用的种子细胞之一[6]。基质细胞衍生因子-1(stromal cell derived factor,SDF-1)在损伤部位上调SDF-1 可募集循环系统或损伤部位的间充质干细胞和前体细胞到达损伤部位,修复受损组织[7-8]。本研究于2021年6 月—2022年6 月齐齐哈尔医学院分子生物学实验室制备PLGA∕胶原三维支架,在低氧环境下SDF-1 复合PLGA∕胶原三维支架诱导BMSCs 增殖和迁移,为阐明低氧环境下三维培养BMSCs 在肌腱组织工程应用提供实验研究基础。现报道如下。
1 对象与方法
1.1 研究对象
选取大鼠骨髓间充质干细胞进行试验,随机分为4 组,分别37℃,1%O2低氧箱内培养骨髓间充质干细胞为低氧对照组;37℃,1%O2低氧箱内PLGA∕胶原支架培养骨髓间充质干细胞为低氧P∕C 支架组;37℃,1%O2低氧箱内SDF-1 复合PLGA∕胶原支架为低氧S-P∕C 支架组;37℃,5%CO2培养箱培养为正常对照组。
1.2 实验材料
材料:胎牛血清;DMEM 培养基;青链霉素;胰蛋白酶;4%多聚甲醛;大鼠骨髓间充质干细胞;大鼠SDF-1;PLGA;新鲜牛肌腱。
器材:超净工作台;二氧化碳恒温细胞培养箱;三气培养箱;倒置显微镜;SU3500 扫描电子显微镜;Transwell 小室;CCK-8 试剂盒;Emax 酶标仪;高速离心机;震荡仪;静电纺丝机(型号SS-2535DC)。
1.3 方法
①胶原的制备:采用李晓寅等[9]方法,将购买新鲜的牛肌腱作为原料,剔除周围的肌肉、筋膜、血管、神经等结构,放入冰箱-10℃冷冻硬化,手术刀清理去除肌腱表面上残余筋膜,洗净后,切成薄块,约1 cm,使用0.05 mol∕L Tirs 缓冲液浸泡24 h,收集沉淀物,含胃蛋白酶的醋酸消化后取上清液,加入3.5 mol∕L NaCl 溶液,收集盐析沉淀,4℃去离子水透析5 d,测定浓度为4.5%。
②PLGA∕胶原三维生物材料支架的制备:PLGA和胶原按照75∶25 的质量比例溶解于六氟异丙醇(1,1,1,3,3,3-hexafluoroisopropanol, HFIP),室温下磁力棒搅拌约24 h,配比制成10%的静电纺丝液,设置静电纺丝技术参数,正向电压设置24 kV,喷丝毛细管口径0.5 mm,针口距接收器距离12 cm,纺丝速度0.6 m∕s,纺丝环境的温度和湿度分别为(26.0±0.5)℃和(40.0±0.7)%,接收装置覆盖铝箔纸接收,喷射后得到固化PLGA∕胶原三维生物材料放入真空干燥箱内干燥24 h,扫描电子显微镜下观察支架超微形态结构,等待实验备用。
③骨髓间充质干细胞种植PLGA∕胶原三维生物材料支架:将PLGA∕胶原三维生物材料支架剪成圆片,直径大小约为3 cm,放入培养皿中,在紫外线下消毒1~2 h,培养皿中加入青链霉素。加入壳聚糖缓释的100 ng∕mL 浓度SDF-1,在紫外线下消毒1~2 h。将4×105个BMSCs 滴加到SDF-1 复合PLGA∕胶原三维生物材料支架上,于37℃,5%CO2和1%O2细胞培养箱中分别培养,激光共聚焦显微镜观察。
④CCK-8 实验检测各组骨髓间充质干细胞增殖情况:按照以上细胞实验分组,0.9×104cells∕孔BMSCs 种植96 孔细胞培养板,在培养第7 天利用CCK-8 试剂盒检测BMSCs 增殖情况。按照CCK-8试剂盒说明,使用酶标仪450 nm 测定各组吸光度值(A 值),设置每组为5 个复孔。
⑤Transwell 实验检测各组骨髓间充质干细胞迁移情况:按照Transwell 试剂盒(8 μm 大小孔径)说明书进行操作,将大鼠骨髓间充质干细胞用0.25%胰蛋白酶消化1~2 min,细胞计数器调整骨髓间充质干细胞密度约3×105个∕mL,将Transwell 小室置于24 孔板中,将制备的支架放入小室底面的通透膜上,取细胞悬液200 μl 加入无血清DMEM 的Transwell 小室的上室,在Transwell 小室下室中,对照组为500 μl 的DMEM 培养液,另外3 组分别为500μl DMEM 含120 ng∕mL 浓度SDF-1 因子复合PLGA∕胶原上清液的培养液和含PLGA∕胶原上清液的培养液,每组设3 个复孔,37℃,放入5% CO2培养箱和1% O2专用低氧箱内培养12 h,去除纤维支架,用无菌纱布擦去小室内底面的细胞,4%多聚甲醛固定20 min,0.1%结晶紫染色20 min,PBS 清洗两次,在倒置显微镜下观察,每个复孔随机选取5 个视野进行拍照统计穿膜细胞数,取平均值,重复实验3 次。
1.4 观察指标
①检测PLGA∕胶原三维生物材料支架微观形态结构;②检测各组骨髓间充质干细胞的增殖情况;③检测各组骨髓间充质干细胞的迁移情况。
1.5 统计方法
采用SPSS 24.0 统计学软件进行数据处理,符合正态分布的计量资料以(±s)表示,组间差异比较采用t检验;计数资料以[n(%)]表示,组间差异比较采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 PLGA/胶原三维生物材料支架微观结构观察
扫描电镜显示PLGA∕胶原三维生物材料支架纤维表面光滑,纵横交错、粗细均匀、连续无断裂,无颗粒串珠,空隙清晰规则,相互贯通,纤维直径约为(680.10±3.54)nm,空隙直径约为(3 160.50±6.89)nm,见图1。
2.2 BMSCs 在PLGA/胶原三维生物材料支架生长情况
激光共聚焦显微镜观察可见DiL 标记的BMSCs在PLGA∕胶原三维生物材料支架生长情况良好,纤维支架表面和间隙内均可见BMSCs,见图2。

图2 BMSCs 在PLGA/胶原三维生物材料支架生长情况
2.3 各组骨髓间充质干细胞活性比较
各组间骨髓间充质干细胞活性(吸光度值)比较,差异有统计学意义(P<0.05),见表1。
表1 各组骨髓间充质干细胞活性(吸光度A 值)比较(±s)

表1 各组骨髓间充质干细胞活性(吸光度A 值)比较(±s)
注:在培养第7 天,低氧对照组与正常对照组比较,差异有统计学意义(t=2.724,P=0.027);低氧P∕C 支架组与低氧对照组比较,差异有统计学意义(t=2.909,P=0.020);低氧S-P∕C 支架组与低氧P∕C 支架组比较,差异有统计学意义(t=2.486,P=0.038)
组别正常对照组(n=5)低氧对照组(n=5)低氧P∕C 支架组(n=5)低氧S-P∕C 支架组(n=5)A 值1.07±0.12 1.26±0.10 1.50±0.15 1.71±0.13
2.4 各组细胞骨髓间充质干细胞迁移数量比较
各组间比较,差异有统计学意义(P<0.05),见表2。
表2 各组细胞骨髓间充质干细胞迁移数量比较[(±s),×103个]
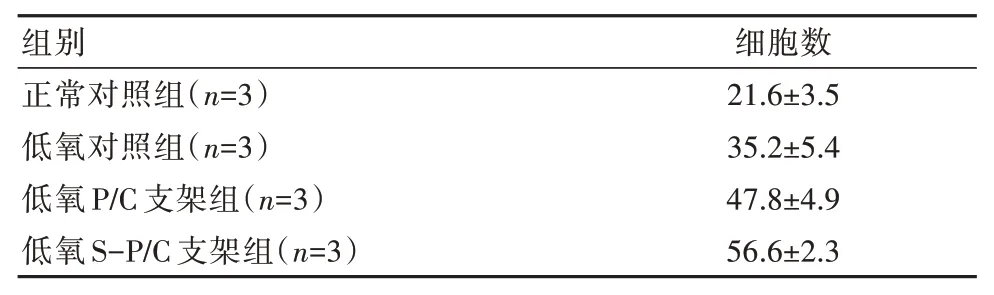
表2 各组细胞骨髓间充质干细胞迁移数量比较[(±s),×103个]
注:低氧对照组与正常对照组比较,差异有统计学意义(t=3.661,P=0.022);低氧P∕C 支架组与低氧对照组细胞比较,差异有统计学意义(t=2.993,P=0.040);低氧S-P∕C 支架组与低氧P∕C 支架组比较,差异有统计学意义(t=2.816,P=0.048)
组别正常对照组(n=3)低氧对照组(n=3)低氧P∕C 支架组(n=3)低氧S-P∕C 支架组(n=3)细胞数21.6±3.5 35.2±5.4 47.8±4.9 56.6±2.3
3 讨论
随着社会的快速发展,全球体育运动的兴起,许多人都加入体育运动中。但是,许多人由于体育运动方式的不恰当或老龄化等因素导致肌肉损伤、断裂等运动系统疾病。肌腱损伤是常见的运动系统疾病之一,据统计,全球每年约有3 000 万例的肌腱损伤的病例[10],手术治疗后容易发生再次断裂[11]。肌腱组织工程给肌腱损伤治疗带来了希望。
3.1 肌腱组织工程支架材料
支架材料包括天然高分子材料、人工合成高分子材料、复合材料。天然高分子材料主要有胶原、蚕丝、小肠黏膜下层,具有可降解性、无毒,亲水性和细胞粘附性好的优点,缺点为力学性能差、降解速度快、加工性差。人工合成高分子材料主要有聚乳酸(polylactic acid, PLA)、聚羟基乙酸(polyglycolic acid, PGA)、聚乳酸-聚羟基乙酸共聚物(PLGA)3种,优点是来源广泛、易加工、可降解,缺点为细胞亲水性差、细胞粘附性差。复合材料由天然材料和人工合成材料复合而成,取两者的优点,具有力学性能好、降解性好、细胞粘附性好等特性。本研究扫描电镜结果显示PLGA∕胶原三维支架纤维粗细均匀、光滑无结节、孔隙率高、且相互连通。激光共聚焦显微镜下可见细胞在支架材料生长情况良好,在纤维空隙内和表面可见细胞黏附,细胞和三维支架相容性良好。
3.2 基质细胞衍生因子-1
基质细胞衍生因子-1(SDF-1)作为趋化因子,即CXCL12,CXCR4 作为趋化因子CXC 受体,两者亲和力极高,SDF-1 和CXCR4 结合后可以产生定向迁移的作用,能趋化骨髓间充质干细胞、造血干细胞、内皮祖细胞、肿瘤细胞等。上调SDF-1 有效的召集间循环系统或损伤部位间充质干细胞和前体细胞到达损伤部位,修复损伤部位[12]。
3.3 肌腱组织工程支架性能
CCK8 实验表明,在细胞培养第7 天,正常对照组吸光度值为(1.07±0.12)、低氧对照组吸光度值为(1.26±0.10)、低氧PLGA∕胶原支架组吸光度值为(1.50±0.15)、低氧SDF-1 复合PLGA∕胶原支架组吸光度值为(1.71±0.13),姜杨等[13]研究低氧PLGA∕胶原支架组是低氧对照组的(1.350±0.545)倍,低氧对照组是正常对照组的(1.417±0.55)倍,同时与王洋等[14]认为CXCL12∕CXCR4 轴增加BMSCs 生存活性及增殖等作用相一致,在第7 天吸光度值低氧S-P∕C 支架组为最大。Transwell 实验结果可见,与正常对照组比较,低氧对照组细胞迁移数量相对表达量增高;与低氧对照组比较,低氧PLGA∕胶原支架组细胞迁移数量相对表达量增高(P<0.05);与低氧PLGA∕胶原支架组比较,低氧SDF-1 复合PLGA∕胶原支架组细胞迁移数量相对表达量增高(P<0.05),说明在低氧环境下,细胞具有一定迁移性,趋化因子SDF-1 与其受体CXCR4 之间相互作用是BMSCs 趋化过程的主要调节因素,与郝璐等[15]研究发现低氧条件可增强BMSCs 的迁移能力,而在加入SDF-1 的刺激下,BMSCs 迁移能力较大提升的结论相一致。
综上所述,体外实验模拟肌腱周围低氧环境,SDF-1 复合PLGA∕胶原三维立体支架对骨髓间充质干细胞的增殖和迁移影响,实验结果相对二维空间更具准确性,证实SDF-1 复合PLGA∕胶原支架三维立体支架具有良好的生物相容性,可有效促进细胞的增殖和迁移。下一步进行建造动物肌腱损伤模型,在动物体内放入三维仿生支架,评价仿生三维支架对肌腱损伤的修复影响,为治疗肌腱损伤提供有力的理论基础。

