不同浓度葡萄糖对大鼠INS-1 细胞的影响研究
范晓宇,徐子凯,柳雨菲,吴莞茹,李磊,何新怡,徐晶
1.齐齐哈尔医学院医学技术学院检验专业,黑龙江齐齐哈尔 161006;2.齐齐哈尔医学院生化教研室,黑龙江齐齐哈尔 161006
随着我国人口老龄化和生活水平的提高,糖尿病患病率逐年上升,其中70%~80%为2 型糖尿病(type 2 diabetes mellitus, T2DM),糖尿病是常见的慢性代谢性疾病,常伴有糖尿病心肌病、糖尿病肾病、糖尿病性视网膜病等糖尿病并发症,胰岛素抵抗是该病的主要特征,胰岛素抵抗是由于胰岛素分泌或者功能缺陷引起的综合特征[1-4]。胰岛素在生物体内调节能量代谢方面具有重要作用,也是糖尿病患者管理血糖达标的关键[5-9]。因此,对胰岛β 细胞活力、功能及胰岛素分泌情况的研究逐渐引起学者们关注。
大鼠胰岛INS-1 细胞具有正常胰岛β 细胞的大部分功能,能较好地对生理浓度葡萄糖的刺激做出应答,分泌较多的胰岛素,这种高度敏感性是由于细胞内氧自由基清除的酶类较少所致[10-12]。因此,本研究于2020年9 月—2021年6 月在齐齐哈尔医学院医药科学院分子生物学中心完成体外高糖诱导大鼠胰岛INS-1 细胞,检测不同浓度葡萄糖刺激胰岛β 细胞的胰岛素含量的变化,为选用提高胰岛素分泌量的药物提供实验数据。现报道如下。
1 材料与方法
1.1 材料
1.1.1 细胞及主要试剂 大鼠胰岛INS-1 细胞(中国医学科学院基础医学研究所基础医学细胞中心);RPMI 1640 培养基(Hyclone);胎牛血清(Clark);0.25%胰酶(gibco);活性氧簇(reactive oxygen species, ROS)检测探针和葡萄糖(Sigma);CCK-8 检测试剂盒(上海生工);大鼠胰岛素(insulin)酶联免疫检测试剂盒(北京索来宝科技有限公司)。
1.1.2 仪器 酶标仪(Spark);生物安全柜(Thermo);倒置荧光显微镜(OLYMPUS);离心机(eppendorf);激光共聚焦(ZEISS 710)。
1.2 方法
1.2.1 细胞培养与分组 将大鼠INS-1 细胞培养在含10% 胎牛血清的1640 培养基中,37°C 5% CO2细胞培养箱中。在1640 培养基中加入一定质量的葡萄糖,待充分溶解后,0.22 μm 针孔过滤器过滤,配置成浓度为5.5、16.7、25、33、50 mmol∕L 的葡萄糖。实验分组:1640 正常培养组,即对照组(normal control, NC),不同浓度葡萄糖组,分别为5.5、16.7、25、33、50 mmol∕L。
1.2.2 CCK-8 检测细胞存活率 将培养的100 μL大鼠胰岛INS-1 细胞以5×104∕mL 密度的悬液接种在96 孔细胞培养板中,37°C 5% CO2的细胞培养箱中培养24 h 后,弃掉培养基,PBS 清洗3 次,按照上述分组加入不同浓度葡萄糖的培养基,培养48 h,每孔加入10 μL CCK-8 试剂后,继续孵育2 h 后在450 nm 处检测吸密度(OD)值,根据如下公式计算细胞存活率。
细胞存活率(%)=(实验孔-空白孔)∕(对照孔-空白孔)×100%。
1.2.3 胰岛素分泌检测 将细胞以50 万∕孔的密度接种在6 孔细胞培养板中,细胞贴壁率达到70%~80%时,按照上述分组分别加入不同浓度葡萄糖的培养基,培养48 h 后,收集上清和细胞沉淀。上清低速离心(1 000 rpm,1 min)弃掉细胞,沉淀用裂解液100 μL 冰浴裂解10 min,漩涡震荡2~3 次,12 000 rpm 离心15 min,收集上清。将培养液上清和沉淀裂解上清分别按照大鼠胰岛素酶联免疫检测试剂盒说明书操作,在450 nm 波长处检测光密度值,根据标准曲线计算各组胰岛素释放量和细胞内含量。
1.2.4 ROS 水平检测 将细胞以5 000 个∕孔的密度接种在96 孔细胞培养黑色板中,贴壁后加入不同糖浓度培养48 h 后,每孔加入100 μL 培养基配制的浓度为10 μmol∕L 的DCFH-DA 探针,置于37°C 5%CO2细胞培养箱中30 min,PBS 清洗2 次,最后加入100 μL PBS,在酶标仪中测定荧光强度,激发波长为485 nm,发射波长为521 nm。
1.3 统计方法
采用SPSS 22.0 和GraphPad Prism 统计学软件对数据进行处理,计量资料经检验符合正态分布,以(±s)表示,组间差异比较采用t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 大鼠胰岛INS-1 细胞的培养
将大鼠INS-1 细胞从-80°C 冰箱取出立刻放于37°C 水浴锅中解冻,待溶解后将细胞打入含1640培养基的25 cm2细胞培养瓶中,置于37°C 5% CO2细胞培养箱中培养24 h 后,更换培养液,倒置显微镜下观察细胞状态,见图1。
图1 大鼠胰岛INS-1 细胞的培养(20×)
2.2 不同浓度葡萄糖时大鼠INS-1 细胞活力比较
大鼠INS-1 细胞培养在不同浓度葡萄糖培养液中培养48 h 后,对照组(NC)(1.047±0.101)与体外5.5、16.7、25、33 mmol∕L 糖浓度时的大鼠INS-1 细胞活力[(0.933±0.100),(0.846±0.117),(0.884±0.035),(0.914±0.040)]比较,差异无统计学意义(P>0.05),但糖浓度为50 mmol∕L 时,细胞存活率(0.727±0.096)显著下降,与对照组比较,差异有统计学意义(P<0.05)。见图2。
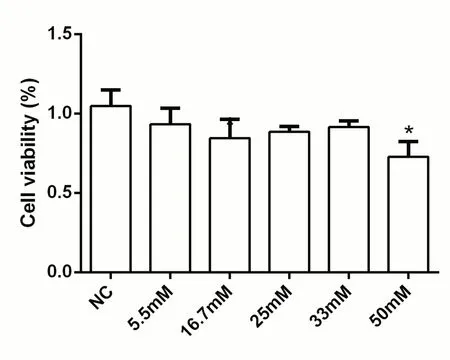
图2 不同浓度葡萄糖时大鼠INS-1 细胞活力
2.3 不同浓度葡萄糖时大鼠INS-1 细胞胰岛素释放水平比较
与对照组比较,不同浓度葡萄糖培养的INS-1 细胞胰岛素释放量、细胞内胰岛素含量、胰岛素总量都显著减少,差异有统计学意义(P<0.05);33 mmol∕L 糖浓度时最低[(0.207±0.008)、(0.224±0.014)、(0.451±0.079)],50 mmol∕L 糖浓度时有升高趋势[(0.315±0.011)、(0.374±0.011)、(0.660±0.109)ng∕mL]。见图3。

图3 不同糖浓度时INS-1 细胞胰岛素释放水平
2.4 不同浓度葡萄糖时大鼠INS-1 细胞ROS 比较
在激光共聚焦显微镜下显示,对照组(NC)细胞内活性氧(1.028±0.065)与低浓度葡萄糖(5.5 mM)时(0.645±0.075)比较,差异无统计学意义(P>0.05);当葡萄糖浓度超过16.7 mM 后,细胞内的活性氧水平(1.85±0.102)也逐渐升高,均高于对照组,差异有统计学意义(P<0.05)。其中33 mM 时最高(18.382±0.887),50 mM(3.209±0.607)比33 mM 低。见图4。

图4 不同糖浓度时INS-1 细胞活性氧水平
3 讨论
糖尿病是全球致死率较高的疾病之一,目前尚无治愈糖尿病的技术手段。血糖代谢异常是糖尿病的主要特点,原因主要胰岛素分泌不足和胰岛素抵抗(insulin resistance,IR)两个因素。胰岛β 细胞数量及功能是关系到胰岛素分泌量的关键,因此本文将寻找影响胰岛素分泌的因素,进而再研究保护胰岛β 细胞功能的药物[13-19]。
本研究在体外使用不同浓度葡萄糖刺激大鼠胰岛INS-1 细胞发现,细胞活力在5.5、16.7、25、33 mmol∕L 糖浓度时,大鼠INS-1 细胞活力与对照组比较,差异无统计学意义(P>0.05),但糖浓度为50 mmol∕L 时,细胞存活率与对照组相比显著下降(P<0.05)。有研究表明体外葡萄糖浓度25 mmol∕L相当于正常血糖值餐后高值7 mmol∕L[9],体外葡萄糖浓度50 mmol∕L 时抑制胰岛细胞活力,相当于正常血糖值餐后高值14 mmol∕L。在不同浓度葡萄糖刺激下,胰岛素释放量都显著减少(P<0.05),33 mmol∕L 糖浓度时胰岛素释放量最低,50 mmol∕L糖浓度时胰岛素释放量有升高趋势,细胞内胰岛素含量和胰岛素总量变化趋势与胰岛素释放量一致,提示大鼠胰岛INS-1 细胞在受葡萄糖刺激时分泌胰岛素总量会随着浓度的升高逐渐降低,当50 mmol∕L 糖浓度时,胰岛细胞应激性提高胰岛素的分泌量来维持血糖的稳定,本研究预测随着糖浓度的再升高,胰岛素将无法维持血糖平衡,因为胰岛β 细胞数量及功能是有限的。在活性氧检测实验中发现,体外低浓度葡萄糖(5.5 mM)时,细胞内活性氧与对照组比较,差异无统计学意义(P>0.05),当葡萄糖浓度超过16.7 mM 后细胞内的活性氧水平也逐渐升高(P<0.05),其中33 mM 时最高,然而50 mM 时活性氧水平比33 mM 低,但与对照组比较,差异有统计学意义(P<0.05),提示当葡萄糖浓度在50 mM 时细胞内可能启动抗氧化应激来抵抗高糖对细胞损伤的机制,这个结果与胰岛素释放量保持一致,因此验证细胞内ROS 的产生与胰岛素抵抗密切相关。
综上所述,不同浓度葡萄糖影响大鼠胰岛INS-1 细胞胰岛素释放量和细胞内ROS 的水平,将为体外高糖损伤模型的建立和临床药物的选取提供实验依据。

