生物有机肥中解磷菌和固氮菌的筛选与鉴定
黄挺 党俊杰 陈洪满 姚李波 邓冬梅 李柳红 陈龙保

摘 要:从生物有机肥中筛选出高效的解磷菌和自生固氮菌后,通过形态学观察、生理生化特征分析和16S rRNA序列测定等方法进行菌种鉴定,并用磷钼蓝比色法和凯氏定氮法测量解磷量和固氮量,对所筛选的菌种特性进行初步研究。实验表明,筛选出的解磷菌为芽孢杆菌(P1、P3)和根瘤菌(P2),自生固氮菌为根瘤菌(N1)和芽孢杆菌(N2)。其中测得菌株P1的解磷能力为93.53 mg/L、菌株P2的解磷能力为23.25 mg/L、菌株P3的解磷能力为126.46 mg/L,测得菌株N1固氮能力为28.33 mg/L、菌株N2固氮能力为32.39 mg/L。结果表明菌株P3和菌株N2可作为优势菌种进一步优化,为微生物菌肥扩大生产提供更好的实验依据。
关键词:解磷菌;固氮菌;筛选;鉴定;磷钼蓝比色法;凯氏定氮法
中图分类号:S144 DOI:10.16375/j.cnki.cn45-1395/t.2023.01.014
0 引言
长期使用化学肥料改变了土壤的理化性质,导致土壤板结,微生物群落发生改变[1]。生物有机肥是一种含有活体微生物的肥料[2],合理的施用能够增进土壤肥力、改良土壤结构、促进植物生长发育、改善作物品质、增强植物抗病(虫)和抗逆性、减少化肥的使用量。近年来,我国以绿色农业为导向,使得微生物肥料具有广阔的发展前景[3-4]。
土壤中可被植物利用的氮元素有限,并不能满足植物自身的营养需求[5]。固氮菌能够促进植物的生长,提高土壤的供氮能力,使土壤生物环境得到改善。固氮菌可分为共生固氮菌、联合固氮菌和自生固氮菌。3种固氮菌都可以将大气中单质氮转换成植物能够吸收利用的无机态氮,其中自生固氮菌能够独立固氮,与植物无依存关系。研究发现具有固氮能力的自生固氮菌已有数十种,包括球囊霉属、伯霍尔德杆菌属、玉米固氮螺旋菌属[6-7]。自生固氮菌能够广泛应用在玉米、小麦等农作物上,为其提供氮元素,在微生物肥料的应用中有着重要的价值[8]。
磷在植物的生长发育过程中对磷脂、核酸、ATP的合成起着重要作用[9]。土壤中磷元素含磷量平均占比0.05(w/w)[10],但土壤中的磷元素不能直接被吸收利用,造成一些地区土壤缺乏磷元素,农作物产量低下[11]。解磷菌将土壤中难溶的磷素溶解成植物能够吸收的有效磷,进而提升土壤养分,促进植物生长发育[12]。目前经分离鉴定出的解磷菌可分为36个属,89种。其中,解磷细菌最多,包括根瘤菌属、芽孢杆菌属、假单胞杆菌属、微球菌属等[11]。农业生产上,高效的解磷菌剂不仅能促进农作物增产,还能改善土壤环境进而提高磷的利用率,对生态系统的可持续发展有着重要意义。
本实验从生物有机肥中分离筛选出高效的解磷菌和固氮菌,并对植物的促生效应进行初步研究。
1 材料与方法
1.1 样品
样品来自柳州花卉市场销售的生物有机肥。
1.2 培养基
LB液体培养基(g/L):胰蛋白胨10 g ,酵母浸粉5 g,NaCl 10 g,溶于1 L蒸馏水中,pH 7.0,放入高压灭菌锅中,121 ℃灭菌20 min。
阿须贝培养基(g/L):甘露醇10 g,KH2PO4 0.2 g,MgSO4·7H2O 0.5 g,NaCl 0.2 g,CaCO3 5 g,CaSO4·H2O 0.5 g,琼脂20 g,蒸馏水定容至1 L,pH 7.0 ~ 7.5,放入高压灭菌锅中,121 ℃灭菌20 min。
Pikovskaya无机磷培养基(g/L):酵母浸粉0.5 g,葡萄糖10 g,NaCl 0.3 g,KCl 0.3 g,MgSO4·7H2O 0.3 g,MnSO4·H2O 0.03 g,FeSO4·7H2O 0.03 g,(NH4)2SO4 0.5 g,Ca3(PO4)2 5.0 g,蒸馏水定容至1 L,pH 7.0 ~ 7.5,琼脂粉20 g(液体培养基不加),放入高压灭菌锅中,121 ℃灭菌20 min。
1.3 分离纯化菌株
从生物有机肥中分别取10 g肥料倒入90 mL生理盐水(已灭菌)中,充分溶解后,静置10 min。取5 mL上清液分别接种到LB液体培养基中,在恒温37 ℃、转速121 r/min的条件下培养48 h。然后取1 mL菌液离心,倒掉上清液,加1 mL灭菌水溶解菌沉淀,然后逐级稀释至10-5、10-6、10-7。各取200 ?L菌液在无机磷培养基和阿须贝培养基上进行涂布操作。置于37 ℃恒温培养箱中培养2 ~ 3 d。分别挑取单菌株转接至斜面培养基,并保藏培养基。
1.4 解磷菌和自生固氮菌生长曲线的测定
菌种纯化后接种到10 mL灭菌的LB液体培养基中,在37 ℃、121 r/min条件下培养24 h后,移取1 mL菌液接种至盛有150 mL LB液体培养基的锥形瓶中。然后在30 ℃、121 r/min 摇床上培养,每个菌做2个平行实验。以不接菌的培养基为空白对照。定时取1 mL菌液,并用蒸馏水稀释至3 mL,然后在波长为600 nm条件下,测定其OD值。
1.5 解磷能力测定
将已纯化的解磷菌接种至LB培养基上活化24 h,然后取1 mL培养液分别接种到2个100 mL已灭菌的无机磷液体培养基上,置于30 ℃、121 r/min的摇床上培养,以不接菌的为空白对照。培养7 d,每24 h取样一次,每次取10 mL培养液离心,取上清液,以磷钼蓝比色法测定可溶性磷含量。
1.6 菌肥的固氮能力
重復上述1.5的步骤,取1 mL培养液接种到2个100 mL已灭菌的阿须贝无氮培养基上,置于30 ℃、121 r/min的摇床上培养,以不接菌的为空白对照。培养7 d,每24 h取样一次,每次取10 mL培养液离心,取上清液,利用凯氏定氮法[13]测定其固氮能力。
1.7 革兰氏染色观察
使用革兰氏染色法对2种菌种进行染色,观察并记录其是否是革兰氏阳性菌或者革兰氏阴性菌。
1.8 菌株的鉴定
对筛选的解磷菌、固氮菌2种菌株进行16S rRNA鉴定。取0.6 ~ 2.0 mL菌液进行DNA的提取和纯化,将纯化得到的DNA进行PCR扩增。以提取的DNA为模板,采用一对保守引物扩增基因,引物序列为27F(5-AGA GTT TGA TCC TGG CTC AG-3)和1492R(5-GGT TAC CTT GTT ACG ACTT-3)。PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s;56 ℃退火30 s;72 ℃延伸90 s,30个循环;72 ℃延伸10 min[14]。将扩增完的DNA进行回收纯化,纯化后的DNA送往广东潍捷基(上海)贸易有限公司进行测序。将测序所得的序列在NCBI上进行BLAST比对,找到与该序列同源性最高的菌,利用MEGA5.0软件构建进化树,分析该菌的种属。
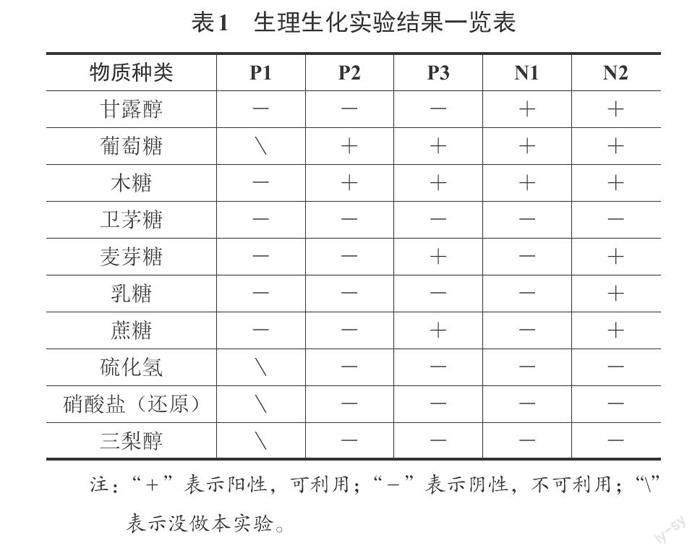
1.9 菌株的生理生化实验
结合《伯杰细菌鉴定手册》,对筛选得到的菌株进行营养利用测定,包括了甘露醇、葡萄糖、木糖、卫矛糖、麦芽糖、乳糖、蔗糖、硫化氢、硝酸盐和三犁醇实验。取20 μL菌液,接种于生理生化反应管中,然后将其密封后,观察各个生化反应管的顏色变化。
2 结果
2.1 形态特征结果分析
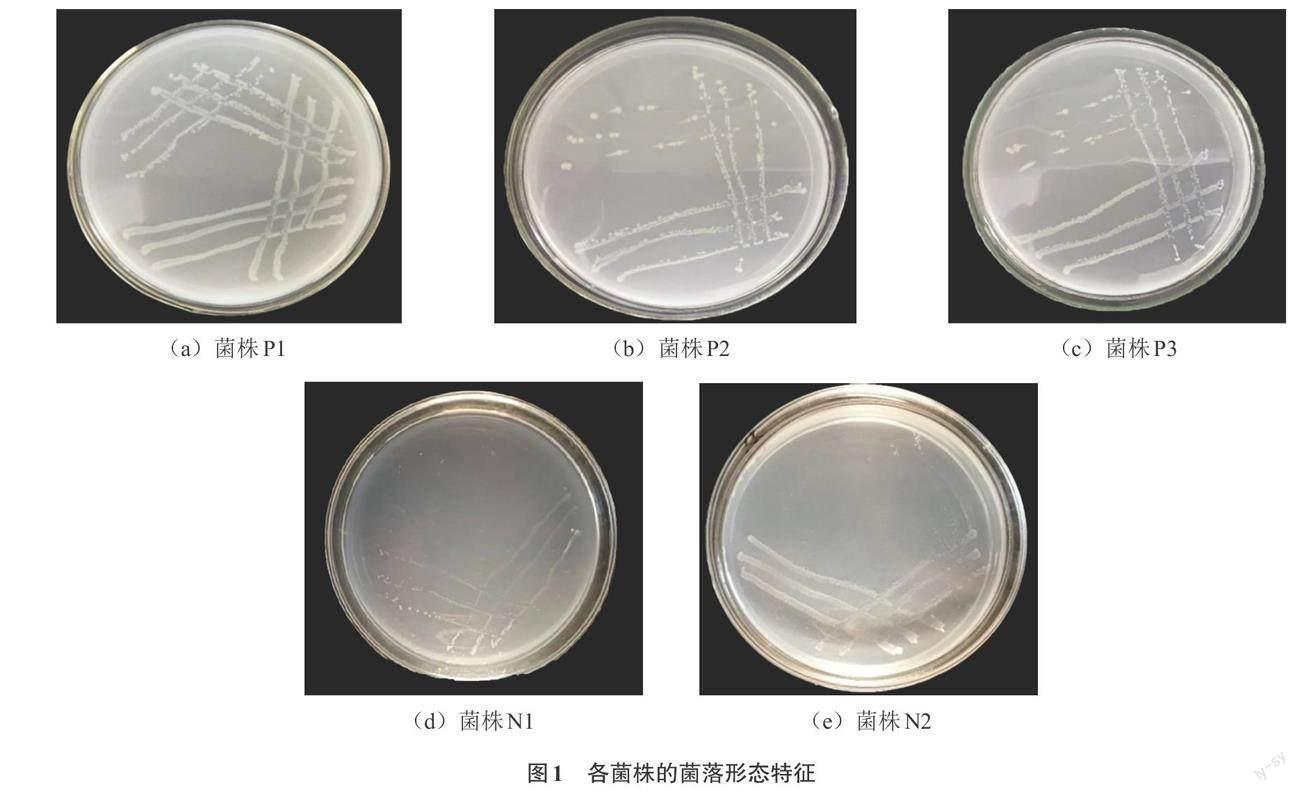
使用Pikovskaya无机磷培养基,从生物有机肥中筛选出3株解磷菌株P1、P2、P3,使用阿须贝培养基筛选出2株自生固氮菌N1、N2。
菌株P1、P2、P3为解磷菌。菌株P1培养1 d后,菌落直径为9 ~ 13 mm,圆形凸起,表面湿润光滑,周边整齐,菌体为淡黄色,为革兰氏阳性菌,杆状;菌株P2培养1 d后,菌落直径为5 ~ 12 mm,圆形、白色、表面凸起光滑、不透明,为革兰氏阴性菌,杆状;菌株P3培养1 d后,菌落直径为6 ~ 14 mm,圆形、白色、表面凸起粗糙、不透明,为革兰氏阳性菌,杆状。
菌株N1、N2为自生固氮菌,均为革兰氏阴性菌。其中菌株N1培养2 d后,菌落直径为5 ~ 10 mm,圆形、白色、表面凸起光滑、透明,杆状;菌株N2培养2 d后,菌落直径为6 ~ 13 mm,圆形、灰色、表面凸起粗糙、透明,杆状。
解磷菌P1、P2、P3的菌落形态与固氮菌N1、N2的菌落形态如图1所示。
2.2 生理生化实验结果
通过对不同营养要素的使用,以确定菌株对各营养要素的可利用性。菌株的生理生化结果如表1所示,所有菌株均能利用葡萄糖作为碳源,但多数菌株不能利用卫茅糖、乳糖和三梨醇作为碳源,这可能与其自身的代谢途径不同有关,其中菌株N2能够利用乳糖,可能是其分泌了β-半乳糖苷酶催化了乳糖水解。
2.3 分子鉴定结果分析
根据图2和图3的NCBI同源性、碳源利用性质(表1)、镜检结果和《伯杰细菌鉴定手册》进行互相比对,初步确定菌株P1、P3、N2同为芽孢杆菌属(Bacillus),菌株P2、N1同为根瘤菌属(Rhizobium)。
2.4 生长曲线分析
图4为各菌株的生长曲线图。如图4(a)所示,菌株P1、P2和P3在37 ℃、pH 7.0、121 r/min的环境下培养7 d,其生长曲线的趋势大体一致。0 ~ 16 h内,菌株生长处在延缓期,此时菌数量比较少,繁殖速度比较慢,所以OD值上升幅度不大;16 ~ 48 h内菌株P1处于对数生长期,培养基体系营养物质丰富,菌龄普遍较小,这时候菌的繁殖能力最强,菌株的OD值上升速率加快;48 ~ 110 h内,菌株处于稳定期,菌的OD值上下波动幅度不大,相对比较稳定。110 ~ 127 h这段时间OD值下降比较缓慢,此时培养基内营养物质所剩无几,菌密度较大,繁殖能力相对较弱。127 h后OD值下降幅度加快,原因是菌龄太大,有害物质增多,导致整个体系中的菌大量死亡,且在生长后期,菌体会发生自溶现象。
菌株N1、N2 2种自生固氮菌的生长特征相似(图4(b)),在12 ~ 48 h生长快速,进入对数期,48 h后进入稳定期,96 h达到生长的最大值,随后开始下降。2种固氮菌在12 ~ 48 h的生长曲线陡峭,细菌繁殖快,菌体浓度变化快。在48 h之后进入稳定期,48 ~ 96 h曲线平坦,细菌繁殖弱,菌液浓度几乎没有变化。
2.5 解磷固氮能力分析
图5为各菌株的解磷固氮能力变化曲线图。如图5(a)所示,试验初期发酵液中的可溶磷质量浓度比较低,随着培养时间的延长,可溶磷质量浓度变化趋势为先上升后下降。菌株P1在120 h达到了最大值,最大质量浓度为93.53 mg/L,144 h后可溶磷质量浓度开始下降;菌株P2在整个培养区间内的溶磷量最小,维持在3.46 ~ 23.25 mg/L,随着培养时间的延长,其曲线变化不明显,解磷能力表现出先增长后下降,最后趋于稳定的趋势,并于第120 h达到最大值23.25 mg/L。菌株P3在168 h内的溶磷量较大(28.26 ~ 126.46 mg/L),随着培养时间的延长,菌株P3的解磷能力表现出先增长后下降、最后趋于稳定的趋势,并于第96 h达到最大值126.46 mg/L,表明该菌株在培养的前96 h内解磷能力越来越强,而后期可能由于碳源等营养物质的耗竭,以及菌体生长繁殖受到抑制等,使解磷能力有所下降。对比菌株P1、P2和P3的解磷能力可以发现,菌株P3的解磷能力最强,且P1、P2和P3达到最大解磷量的时间也有所不同。
如图5(b)所示,菌株N1和N2在168 h内氮的增加量大,N1和N2的固氮能力变化曲线趋势大体一致,固氮能力维持在11.53 ~ 28.33 mg/L和15.49 ~ 32.39 mg/L,均表现出较强的固氮能力。随着培养时间的延长,2种自生固氮菌的氮增加量表现出先增长后下降,而后趋于稳定的趋势,第96 h达到最大值28.33 mg/L和32.39 mg/L。在培养的前96 h内固氮能力逐渐增强,由于碳源等营养物质的耗竭、菌体生长繁殖受到抑制等使固氮能力有所降低。对比菌株N1和N2的固氮能力可以发现,菌株N2的固氮能力更强。
3 讨论
本实验选择市场上的生物有机肥,筛选得到的解磷菌有芽孢杆菌、根瘤菌。运用磷钼蓝比色法测量溶磷量,以磷酸钙作为磷源。已有研究表明芽孢杆菌属经过分离鉴定具有较高的溶磷量,包括枯草芽孢杆菌、巨大芽孢杆菌、蜡状芽孢杆菌等菌种。这些实验研究成果可应用于促进植物的生长发育[15-18]。本研究中,菌株P1最高解磷量为93.53 mg/L,菌株P3最高解磷量为126.46 mg/L,两者均为芽孢杆菌属。吴海燕等[19]从贫磷黑土中筛选的巨大芽孢杆菌,培养到第4 d时,其解磷量可达到420 mg/L。方春玉等[20]从活性污泥中筛选的巨大芽孢杆菌,溶磷量可达到33.72 mg/L。程园园[18]研究发现CYY-9蜡样芽孢杆菌在研究的8株菌株中,溶磷效果最强,溶磷量达470 μg/mL。王倩如等[21]研究了17株能分解无机磷的菌株,其中ZNRS的蜡样芽孢杆菌溶磷效果最好,溶磷量为94.79 μg/mL。菌株P2为根瘤菌,最高解磷量为23.25 mg/L。杜雷等[22]从蔬菜大棚农作物根际中筛选出溶磷量为443.11 mg/L的根瘤菌。说明了同种微生物的溶磷效果不能归因于微生物本身,可能與微生物所处的环境不同,同时也可能因为解磷机制不一样。本研究对菌株P1、P2、P3的生存环境和解磷机制还需要进一步深入研究。
自生固氮菌以自身的固氮机制将空气中的单质氮转化成植物可以利用的氮素。筛选出来的自生固氮菌有芽孢杆菌属、根瘤菌属。运用凯氏定氮法测量固氮量,其中菌株N1为芽孢杆菌,最高固氮量为28.33 mg/L;菌株N2为根瘤菌,最高固氮量为32.39 mg/L。栾敏[23]培养出的自生固氮菌,发现红色红球菌R6和芸苔叶杆菌MR4的固氮量,分别达到了2.7 mg/L和4.0 mg/L,实验表明2种菌都能促进黄瓜根系生长,增加黄瓜总根长,提高黄瓜植株生物量。苌豹[3]发现解磷菌、解钾菌、固氮菌制备的复合菌肥可使每千克土壤中的有效磷含量、有效钾含量和总氮含量分别上升至113.37 mg、367.61 mg、731.46 mg,分别比使用单一解磷菌、解钾菌、固氮菌制备的菌肥提高了14.2%、10.9%、11.1%。固氮能力强的固氮菌也能够活化土壤中钾盐与磷盐,促进农作物生长,对环境与经济的作用具有可持续性。成艳红等[24]筛选出来的自生固氮菌增加了花生和玉米地里氮元素的积累,其植物氮元素的含量与氮肥实验处理的氮含量无明显差异。可将菌株N2作为优势菌种进一步优化,得到高效的自生固氮菌。根据前人研究,自生固氮菌相较于共生固氮菌的固氮能力较弱[25],但自生固氮菌分布广且适应能力强,即使在营养匮乏的土壤中也能生存并进行固氮。因此,筛选出高效的自生固氮菌对农业发展具有极大潜力。
4 结论
从市场购买的生物有机肥料中筛选和鉴定出一株解磷能力为126.46 mg/L的芽孢杆菌和一株固氮能力为32.39 mg/L的根瘤菌。所筛菌株均可利用葡萄糖作为碳源,但不能利用卫茅糖和三梨醇作为碳源。固氮菌和解磷菌的生长曲线在48 h左右达到稳定期,细菌数量开始趋于稳定;在108 h左右,由于营养物质减少,细菌死亡速率大于繁殖速率,开始进入衰退期。
本实验研究结果对改善土壤环境,提高植物对氮元素和磷元素的吸收和利用效率具有较大潜力,为实现微生物菌肥扩大生产提供更好的实验依据。
参考文献
[1] 周璇,沈欣,辛景树.我国微生物肥料行业发展状况[J].中国土壤与肥料,2020(6):293-298.
[2] 陈明元.食用菌渣制备微生物肥料的关键技术与应用研究[D].重庆:重庆三峡学院,2020.
[3] 苌豹.多种解磷、解钾、固氮菌混合发酵制备菌糠菌肥的研究[D].天津:天津大学,2014.
[4] 牛立亭,黄敏.微生物肥料:农资新“活”力[J].中国农资,2021(28):3-4.
[5] 梁珍,李林辉.一株蚯蚓肠道固氮菌的分离及鉴定[J].四川农业科技,2021(8):44-45,60.
[6] 王慧桥,陈为峰,诸葛玉平,等.两株自生固氮菌的鉴定及其应用基础研究[J].华北农学报,2018,33(4):210-216.
[7] 任玉晶.入侵植物紫茎泽兰对土壤自生固氮菌和丛枝菌根真菌群落的影响[D].北京:中国农业科学院,2011.
[8] 王慧桥,陈为峰,诸葛玉平,等.滨海盐土自生固氮菌的筛选及其对玉米幼苗生长的影响[J].河北科技师范学院学报,2017,31(2):60-67.
[9] 魏烈群.荣成天鹅湖解磷菌的分离筛选及其对沉积物磷释放的影响[D]. 烟台:烟台大学,2021.
[10] 姜焕焕.耐盐碱解磷菌与磷石膏联用改良盐碱土的效果与机制[D]. 哈尔滨:哈尔滨工业大学,2019.
[11] 庄馥璐,柴小粉,高蓓蓓,等.苹果根际解磷菌的分离筛选及解磷能力[J].中国农业大学学报,2020,25(7):69-79.
[12] 池景良,郝敏,王志学,等.解磷微生物研究及应用进展[J].微生物学杂志,2021,41(1):1-7.
[13] 蔺红苹,谢呈媛,王芸,等.桐花树根部一株内生固氮菌的筛选及其培养特性研究[J].林业科学研究,2021,34(1):181-186.
[14] 汪蕊露,李进,王翀,等.一株自生固氮菌的筛选、鉴定及生长条件优化[J].生物学杂志,2022,39(2):69-73,79.
[15] 孙健,张鑫鹏,李松龄,等.高寒冷凉环境中解磷微生物的效果初探[J/OL].中国土壤与肥料,2022[2022-03-01].https://kns.cnki.net/kcms/detail/detail.aspx?dbcode=CAPJ&dbname=CAPJLAST&filename=TRFL20220504001&uniplatform=NZKPT&v=mcDXbeturbiVRgVasWKOZJFA1u8D0IjkM4ptKpNOHhO2tZNKqPAk1-BFLo3EaL1z.
[16] 汪金华,杨腊英,黄俊生,等.西瓜根际土壤解磷芽孢杆菌的筛选及其解磷特性研究[J].海南大学学报(自然科学版),2021,39(2):146-152.
[17] 黄慧婧,罗坤.芽孢杆菌与杀菌剂复配防治植物病害的研究进展[J].微生物学通报,2021,48(3):938-947.
[18] 程园园.苜蓿根际芽孢杆菌的分离鉴定及特性分析[D].哈尔滨:哈尔滨师范大学,2015.
[19] 吴海燕,金荣德,范作伟,等.解磷巨大芽孢杆菌(Bacillus megaterium)的溶磷机理探讨[J].吉林农业大学学报,2014,36(2):171-175.
[20] 方春玉,吕枫,赵兴秀,等.1株巨大芽孢杆菌特性、解磷条件研究及其应用初探[J].环境科学与技术,2021,44(3):16-22.
[21] 王倩如,叶晶菁.甲胺磷农药废水生化处理高效菌选育的研究[J].化工环保,1995,15(4):205-206,27,208-210.
[22] 杜雷,王素萍,陳钢,等.一株高效解磷细菌的筛选、鉴定及其溶磷能力的研究[J].中国土壤与肥料,2017(3):136-141.
[23] 栾敏.土壤自生固氮菌的分离鉴定及生物固氮与促进植物生长效应研究[D].南京:南京农业大学, 2007.
[24] 成艳红,黄欠如,武琳,等.红壤旱地一株自生固氮菌的筛选鉴定及其固氮能力评估[J].中国农学通报,2020,36(9):100-106.
[25] 慈恩,高明.生物固氮的研究进展[J].中国农学通报,2004,20(1):25-28.
Screening and identification of phosphate solubilizing bacteria and
nitrogen-fixing bacteria in bioorganic fertilizers
HUANG Ting, DANG Junjie, CHEN Hongman, YAO Libo, DENG Dongmei*,
LI Liuhong, CHEN Longbao
(School of Biological and Chemical Engineering, Guangxi University of Science and Technology, Liuzhou
545006, China)
Abstract: High efficient phosphorus solubilizing and free-living nitrogen fixing bacteria were screened from bio-organic fertilizers. The strains were identified by morphological observation, physiological and biochemical characterization and 16S rRNA sequence determination, and the amount of phosphorus solubilization and nitrogen fixation were measured by phosphorus-molybdenum blue colorimetric method and Kjeldahl nitrogen determination, and the properties of the screened strains were initially studied. The experiments showed that the screened phosphate solubilizing bacteria were Bacillus (P1, P3), Rhizobium (P2) and the autochthonous nitrogen fixing bacteria were Rhizobium (N1), Bacillus (N2). The phosphorus solubilization capacity of P1 was 93.53 mg/L, that of P2 was 23.25 mg/L and that of P3 was 126.46 mg/L. The nitrogen fixation capacity of N1 was 28.33 mg/L and that of N2 was 32.39 mg/L. Therefore, P3 and N2 can be used as the dominant strains and can be further optimized for the expansion of microbial fertilizer production.
Key words: phosphate solubilizing bacteria; nitrogen-fixing bacteria; screening; identification; phosphorus molybdenum blue colorimetry method; Kjeldahl method
(责任编辑:于艳霞)

