高龄小鼠来源精原干细胞长期培养体系的建立*
汤瑞玲,范立青
(1.湖北科技学院医学部基础医学院人体解剖教研室,湖北 咸宁 437100;2.中南大学湘雅医学院基础医学院生殖与干细胞工程研究所)
随着全球进入后工业化时代,生育年龄推后,以及二胎政策的施行,高龄父亲(advanced paternal age,APA)的生殖状态及其对子代健康的影响已经成为全球研究热点。临床人群研究显示[1-3],高龄父亲子代发生先天畸形、儿童肿瘤、智力低下、精神疾病如孤独症和精神分裂症,以及不良孕产史的风险大大增加。高龄雄性睾丸中精原干细胞(spermatogonial stem cell,SSC)发生的新发基因突变和表观遗传异常均可通过精子传递,从而导致严重的子代健康问题,称为父亲年龄效应(paternal age effects,PAEs)[4-5];父亲年龄超过35岁导致PAEs疾病风险呈指数级增加;小鼠睾丸细胞转录组学显示8月龄SSCs即开始表达衰老相关基因[6-7]。目前SSC衰老研究集中于新生期和性成熟期小鼠来源的SSC体外长期培养造成的遗传和表观遗传改变[8-9],直接来源于高龄小鼠睾丸SSC体外培养体系尚未见报道。本研究拟建立8月龄小鼠睾丸来源SSCs体外培养体系,可以完整保存SSCs发生衰老改变时的遗传、表观遗传、基因表达特征,将为阐明高龄SSC衰老启动时的遗传和表观遗传调控机制提供有力的研究工具。
1 材料与方法
1.1 动物
6~8周龄成年雄性昆明白小鼠购自湖南史莱克景达有限责任公司,饲养于中南大学生殖与干细胞工程中心实验动物房,用于实验室正常小鼠繁殖配种,12h光照,12h黑暗,水食自由,所有实验动物处理均遵循《实验动物管理和使用指南》。5只6月龄小鼠停止配种后继续饲养至8月龄用于本实验。
1.2 试剂和仪器
StemPro-34 SFM培养基、高糖DMEM、100×MEM维生素、100xNEAA、100×丙酮酸钠、100×ITS、FBS购自美国Gibco公司。Recombinant mouse GDNF购自美国Sigma公司、Recombinant mouse GDNF GFRa-1购自Sino Biological公司、Recombinant mouse bFGF、Recombinant mouse EGF和Recombinant mouse LIF均购于美国R&D公司。腐胺、D(+)葡萄糖、乳酸、维生素C、d-生物素、β-巯基乙醇购自Sigma公司。胶原酶IV、中性蛋白酶和0.05%胰酶/EDTA购自美国Gibco公司,透明质酸酶和DNA酶购自美国Sigma公司,0.1%明胶购自美国Millipore公司,BCIP/NBT碱性磷酸酯酶显色试剂盒购自美国Invitrogen公司,兔抗小鼠ThY-1多克隆抗体、兔抗小鼠PLZF多克隆抗体、兔抗小鼠c-KIT多克隆抗体、鼠抗OCT-4单克隆抗体均购自美国Santa Cruze公司,兔抗SCP3购自Abcam公司,驴血清、alexafluor 488标记驴抗兔二抗、alexafluor 488标记驴抗小鼠二抗购自美国Invitrogen公司,SP免疫组化试剂盒购自中国福建迈新公司。Trizol购自美国Invitrogen公司,RevertAid First Strand cDNA SyntHEsis Kit逆转录试剂盒购自美国Thermo公司,2×PCR Premix Taq购自日本Takara公司,江丰数字切片扫描仪购自中国江丰公司,体视光学显微镜购自德国蔡司公司,倒置相差荧光显微镜购自日本尼康公司,水套式二氧化碳培养箱购自美国Thermo公司。
1.3 实验方法
1.3.1 高龄小鼠睾丸切片HE染色和IHC检测PLZF表达
8周龄和8月龄昆明白小鼠脱颈致死,睾丸用Bouin固定液固定,梯度酒精脱水,二甲苯透明,石蜡包埋切片,切片厚度5μm;免疫组化(immunohisto-chemistry,IHC)染色:常规脱蜡至水,100mmol/L甘氨酸脱甲醛,3%过氧化氢消除内源性生物素,正常羊血清封闭,1∶200稀释兔抗PLZF抗体孵育过夜,生物素标记羊抗兔二抗室温孵育10min,链霉菌抗生物素蛋白-过氧化酶室温孵育10min,DAB显色,苏木素复染,中性树脂封片。苏木素伊红(haematoxylin-eosin,HE)染色:常规脱蜡至水,苏木素染色5min,0.1%盐酸酒精分色5sec,自来水返蓝20min,醇溶伊红染色2min,中性树脂封片。HE和IHC切片使用江丰数字切片扫描仪扫描,KF-Viewr阅片软件截屏拍照。
1.3.2 三步酶消化法消化高龄小鼠睾丸获取单细胞悬液
(1)配制消化酶。消化酶Ⅰ:6mL高糖DMEM加入5mg/mL胶原酶IV、2mg/mL透明质酸酶;消化酶Ⅱ:6mL高糖DMEM加入2mg/mL胶原酶IV、2mg/mL透明质酸酶、2mg/mL中性蛋白酶、100μg/mL Dnase I酶;消化酶Ⅲ:6mL 0.05%胰酶/EDTA加入100μg/mL Dnase I酶,0.22μm无菌过滤器4℃保存过滤备用。
(2)三步酶消化。脱颈处死8月龄雄性昆明白小鼠1只,取出双侧睾丸,去除睾丸白膜,在体式显微镜下用钟表镊分离精曲小管之间的间质组织和血管,10mL PBS洗涤3次,将松散完整精曲小管移到15mL离心管中,加入6mL消化酶Ⅰ进行第一步消化:37℃水浴,30~40次/min震荡消化10min,加入6mL高糖DMEM和2%FBS终止消化,静置沉降5min共3次,吸弃上清中的间质组织和细胞直至洗涤液清亮,5mL吸管轻轻吹吸精曲小管200次,800rpm离心2min。收集上清单细胞悬液,管底沉淀的精曲小管片段加入6mL消化酶Ⅱ进行第二步消化:37℃水浴,100次/min震荡消化20min,加入600μL FBS终止反应,5mL吸管轻轻吹吸200次帮助精曲小管和细胞团块解离,800rpm离心2min。收集上清单细胞悬液,10mL不含钙镁的DPBS洗涤管底的精曲小管残迹和细胞团块,1500rpm离心5min,管底沉淀的细胞团块加入5mL消化酶Ⅲ进行第三步消化:37℃水浴,100次/min震荡消化5min,加入600μL FBS终止消化,5mL吸管轻轻吹吸200次,直至细胞团块完全解离,将第一、二、三步消化中收集的全部细胞悬液用200目无菌筛网过滤,1500rpm离心5min,10mL高糖DMEM和10%FBS洗涤,10mL含15%FBS的精原干细胞培养液重悬,细胞计数5.4×106个细胞,台盼蓝染色检测细胞活性达95%以上。将细胞按9×105/cm2的密度接种到0.1%明胶预包被的6个60mm皿中,37℃ 5%CO2差异贴壁培养72h。
1.3.3 高龄小鼠精原干细胞原代培养
(1)配制小鼠精原干细胞培养液。StemPro-34 SFM加入StemPro专用补充物作为基础培养基,逐次加入1×MEM维生素、1×NEAA、1×丙酮酸钠、1×ITS、60μmol/L腐胺、6mg/mL D(+)葡萄糖、1μL/mL乳酸、100μmol/L维生素C、10μg/mL d-生物素、20ng/mL GDNF,400ng/mL GFRa1、20ng/mL EGF,10ng/mL bFGF,10ng/mL LIF、50μmol/L β-巯基乙醇,根据需要的浓度最后加入胎牛血清(fetal bovine serum,FBS),0.22μm无菌过滤器过滤4℃保存备用。
(2)CF-1小鼠来源胚胎成纤维细胞饲养层和条件培养基制备。小鼠胚胎成纤维细胞(mouse embryo fibroblasts,MEF)培养液由高糖DMEM添加10%FBS组成;液氮罐取出冻存的P2代CF-1小鼠来源MEF,解冻后加入MEF培养液10mL,接种到0.1%明胶预包被的100mm大皿,常规换液培养48h,以1∶4比例传代,P3代换液常规培养3~4d至细胞铺满皿底,PBS洗涤3次,加入配有10μg/mL丝裂霉素C的MEF培养液,37℃、5%CO2培养2.5h。洗涤、消化、离心收集丝裂霉素C处理的P3代MEF,按3×106/管加入冻存液放入液氮中冻存,冻存液由9μL FBS和1μL DMSO组成。制备条件培养基时按1.5×106/9.5cm2接种密度铺入6孔板中的1孔,加入2mL精原干细胞培养液,每隔24h收集条件培养基并更换新鲜精原干细胞培养液,7~10d后观察饲养层细胞状态,如果不佳即丢弃。
(3)高龄小鼠精原干细胞原代培养。差异贴壁培养72h后,倒置显微镜下见5个60mm中皿贴壁体细胞约占皿底2/3,生殖细胞悬浮在培养液中,少量细胞相互积聚形成细胞团块,收集上清生殖细胞,细胞计数2.2×106,以1.1×106接入铺有密度为7.5×105/9.5cm2MEF饲养层的6孔板中2孔,加入2mL含10%FBS的精原干细胞培养液,37℃ 5%CO2培养,翌日观察到绝大部分生殖细胞已贴壁,仅少许悬浮细胞,隔日换液,每个培养孔加入MEF条件培养液和新鲜精原干细胞培养液各1mL,记为P0代。
(4)高龄小鼠精原干细胞的传代培养。P0代细胞培养10d后,倒置显微镜下见6孔板2个孔的生殖细胞大量死亡,漂在培养液中,MEF饲养层上剩余的精原细胞堆积成大量小细胞团块。每孔加入1mg/mL中性蛋白酶+1mg/mL胶原酶Ⅳ,37℃消化20min,轻轻吹吸皿底,至饲养层上的生殖细胞团块完全脱落,皿底仅剩余部分饲养层细胞,等体积含有5%FBS的DMEM终止反应,1500rpm离心5min,按2∶2传代,接入铺有密度为5×105/9.5cm2MEF饲养层的6孔板中2孔,37℃ 5%CO2继续培养,记为P1代;第10d观察到精原细胞呈葡萄串状聚集,可见多个包含20~50个细胞的精原干细胞克隆形成,1mg/mL中性蛋白酶+1mg/mL胶原酶Ⅳ消化传代,传代比例2∶3;从P1到P5代高龄小鼠SSC克隆增殖比较缓慢,传代间隔为7~10d,传代比例为2∶2或2∶3,在此期间保持精原干细胞培养液中15%FBS的浓度、CF-1来源MEF饲养层铺皿密度5×105/9.5cm2,如果出现细胞2~3d不增殖时可加入新鲜解冻的MEF增加饲养层密度,或者加入MEF条件培养基,以促进高龄小鼠SSC克隆增殖;P6代以后高龄小鼠SSC克隆体外增殖处于稳定状态,传代间隔缩短至5~7d,传代比例为1∶3,P6代开始将精原干细胞培养液中FBS以每周下降5%的梯度逐渐调整至5%,1周后再调整至1%,饲养层接种密度调整至2.5×105/9.5cm2,体外稳定传代培养6个月,共传13代,在传代和实验需要之外,将6孔板中每孔细胞加入由9μL FBS和1μL DMSO配制的冻存液,放入1个冻存管,置入液氮中保存。
1.3.4 高龄小鼠精原干细胞克隆的干性、精原干细胞标记物检测
(1)AKP染色检测SSC克隆的碱性磷酸酶活性。P10代SSC接种到4个孔内,常规培养3d,第4d进行SSC克隆的AKP染色:吸弃培养液,PBS洗涤3次,4%多聚甲醛200μL室温固定15min,双蒸水200μL洗3次,每次10min,按照使用说明书配制BCIP/NBT染色液,加200μL染色液入培养孔,室温孵育10~15min,吸弃染色液,用双蒸水洗2次各2min,倒置显微镜观察SSC克隆颜色变化,如果呈浅蓝色可继续加入染色液再染15~30min,双蒸水洗涤3次,SSC克隆细胞呈深蓝色时拍照。
(2)免疫荧光检测SSC克隆的精原细胞标记物的蛋白表达情况。P10代SSC接种到4个孔内,常规培养3d,第4d进行SSC克隆的免疫荧光染色,吸弃培养孔内的培养液,400μL PBS洗涤3次,4%多聚甲醛200μL室温固定30min,400μL PBS洗3次各10min,10%正常驴血清200μL室温封闭30min,吸弃驴血清,分别加100μL一抗:ThY-1和cKIT兔抗多克隆抗体、OCT-4鼠抗单克隆抗体用10%驴血清按1∶50浓度稀释,SCP3、PLZF兔抗多克隆抗体用含有0.5% TritonX-100的10%驴血清按1∶100浓度稀释,阴性对照孔留置封闭液,4℃冰箱孵育过夜,400μL PBS洗3次各10min,加入1∶1000稀释的alexafluor 488标记驴抗兔二抗100μL室温避光孵育1h,400μL PBS洗3次各10min,1∶1000浓度DAPI复染细胞核3 min,400μL PBS洗涤1次5 min,倒置荧光显微镜观察SSC克隆荧光染色结果并拍照。
(3)RT-PCR检测SSC克隆的精原干细胞标记物mRNA表达情况。6孔板培养孔用4℃预冷PBS洗涤2次,1mL Trizol裂解液轻轻吹吸,移入1.5mL无核酶污染EP管内,冰上裂解10min,加0.2mL氯仿,按照Trizol使用说明书抽提RNA,溶于20μL DEPC水,测OD260/OD280,计算RNA浓度和纯度,-80℃冻存;取1μg总RNA按照逆转录试剂盒说明书冰上配制20μL反应体系获得cDNA,RT反应程序为:42℃孵育60min;70℃孵育5min;4℃,+∞。取1μL cDNA为模板配制20μL PCR反应体系,程序如下:95℃预变性5min(95℃变性30s,58℃退火30s,72℃延伸30s)×35循环,72℃终延伸5min,4℃,+∞。基因引物序列见表1。PCR产物用1.5%琼脂糖胶100V电泳15min分离,Gel Dox XR凝胶成像系统拍照。

表1 RT-PCR检测mRNA表达的引物序列
2 结 果
2.1 高龄小鼠睾丸内精曲小管出现形态学改变
8月龄高龄小鼠睾丸大体形态与8周龄正常小鼠相似(图1a),HE染色观察到8月龄高龄小鼠睾丸出现精子异常的精曲小管:部分精曲小管内出现各级生精细胞排列紊乱,偶见精曲小管仅保留Sertoli细胞和精原细胞而其他生精细胞均缺失(图1b);IHC进行PLZF检测显示8周龄正常对照小鼠PLZFhigh表达于A型未分化精原细胞(a typeundifferentiated spermatogonia,Aun),PLZFlow表达于A型分化精原细胞(a type differentiating spermatogonia,Adiff),不表达于中间型分化精原细胞(intermediate type differentiated spermatogonia)(图1c),8月龄高龄小鼠生精正常和生精异常精曲小管中均存在PLZFhighAun和PLZFlowAdiff精原细胞,同时PLZFPOS还表达于In分化精原细胞(图1d)。

红色三角:8周龄整体睾丸;蓝色三角:8月龄整体睾丸;红色箭头:仅剩余基底膜侧生精细胞的精曲小管;蓝色箭头:生精细胞排列紊乱的精曲小管;红色无尾箭头:精原细胞;蓝色无尾箭头:Sertoli细胞;红色星号:PLZFhighA型未分化精原细胞;蓝色星号:PLZFlowA型分化精原细胞;紫色星号:PLZFPOS中间型In分化精原细胞图1 高龄小鼠的大体形态、HE染色和IHC检测(Bar =100μm)
2.2 高龄小鼠单个整体睾丸经过间质预处理和三步酶消化解离成单细胞悬液
高龄小鼠难以成批获取,我们只能进行单只高龄小鼠原代培养,为尽可能多的获取精原干细胞,我们需要优化消化过程。在去除白膜后,消化前先用钟表镊机械分离小鼠睾丸间质中的血管和结缔组织,减少第一步消化时间,同时尽可能多的去除间质组织和成纤维细胞。分离液中充满离散的间质组织团块,未完全分离的血管残端仍然附着在精曲小管上(图2a);充分洗涤预处理的睾丸组织上清液中可见大量的间质细胞和间质组织团块(图2b);第一步胶原酶和透明质酸酶消化后,可见大量间质组织从精曲小管壁完全脱落(图2c);再次充分洗涤丢弃间质组织和细胞之后,洗涤液中可见完整脱落的间质血管(图2d);洗涤后保留的精曲小管管壁光滑,悬浮液中残存极少量间质细胞(图2e);将洗涤后收集的精曲小管反复吹吸之后,大量精曲小管断裂崩解(图2f);第二步胶原酶、透明质酸酶和中性蛋白酶组合消化和吸管反复吹吸后,精曲小管完全解体,仅剩余少量未消化的细胞团块(图2g);第三步胰酶消化和吸管反复吹吸后,精曲小管基本完全解离,尚有极少量的小细胞团块(图2h);200目筛网过滤掉细胞团块,至此高龄小鼠睾丸组织完全解离成单细胞悬液(图2i)。
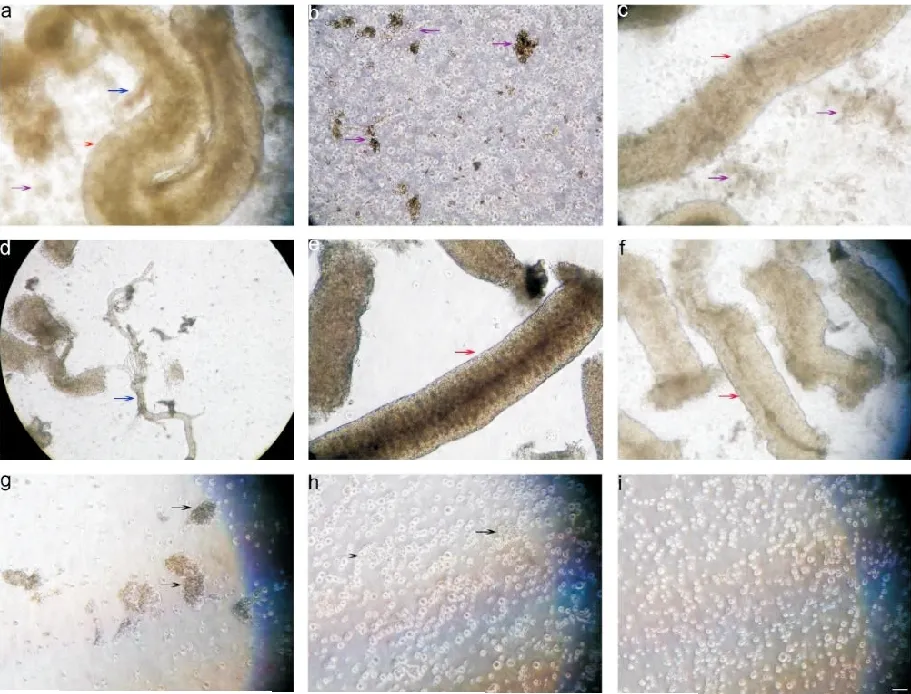
红色箭头:精曲小管;蓝色箭头:间质血管;紫色箭头:间质组织;黑色箭头:细胞团块图2 高龄小鼠消化前预处理精曲小管形态改变过程(Bar=100μm)
2.3 高龄小鼠的72h差异贴壁富集和原代培养
将消化解离的高龄小鼠睾丸单细胞悬液接种到0.1%明胶包被的6个60mm中皿,每隔24h观察贴壁的体细胞密度,72h后贴附在皿底的体细胞约占皿底面积的1/2(图3a),收集悬浮的生殖细胞并洗涤培养皿,可见皿底稀疏的贴壁体细胞(图3b),将丝裂霉素C处理的MEF细胞按7.5×105/21cm2密度铺皿作为高龄小鼠精原干细胞培养的饲养层细胞(图3c),将收集的生殖细胞以1.1×106/21cm2密度接种到饲养层上进行原代培养,记为P0代(图3d)。P0D10d可见生殖细胞集聚成葡萄串状贴附在MEF饲养层上面,其中有少量有丝分裂旺盛的SSC来源子细胞紧密结合形成直径<50μm小克隆(图3e);P1D10d可见葡萄串状的生殖细胞团块数量减少,进入有丝分裂增殖的SSC数量增加,直径增大,最大直径约100μm(图3f);P2D10日SSC克隆数量和克隆直径进一步增加,最大SSC克隆直径约200μm,仅剩余极少量未进入增殖状态的原代生殖细胞,这些原代生殖细胞核直径仍保持在10μm左右(图3g);P3D10日可见SSC克隆数量和克隆直径继续增加,最大SSC克隆直径约500μm,未观察到原代生殖细胞(图3h);P5D10可见SSC克隆处于稳定增殖状态,细胞状态良好(图3i);P6代开始逐渐降低精原干细胞培养液中血清浓度和MEF饲养层铺皿密度,P8D7(图3j)P10D7(图3k)和P13D5(图3l)传代过程中随着残留的老化MEF凋亡,培养皿中MEF密度逐渐降低,SSC克隆仍处于稳定增殖状态,克隆细胞状态良好。

红色箭头:葡萄串状生殖细胞团块;蓝色箭头:SSC克隆;绿色箭头:未进入增殖状态的原代生殖细胞图3 高龄小鼠睾丸消化细胞中SSC差异贴壁富集、原代培养SSC克隆形成和传代培养(Bar=100μm)
2.4 体外培养高龄小鼠SSC克隆具有碱性磷酸酶活性,表达精原干细胞标记物
免疫荧光检测显示高龄小鼠SSC克隆表达ThY-1、PLZF、OCT-4 3种未分化精原细胞标记蛋白(图4a-i),不表达c-KIT分化精原细胞蛋白(图4j-l)和SCP3精母细胞蛋白(图4m-o);AKP染色显示高龄小鼠SSC克隆表达碱性磷酸酶(图4s);RT-PCR结果显示高龄小鼠SSC克隆表达未分化精原细胞标记物Gfra1、Oct-4、Ssea-1 mRNA,也表达分化精原细胞标记物c-Kit mRNA和精母细胞标记物Scp3 mRNA(图4t)。

a-r:免疫荧光,第一列代表SSC克隆抗体荧光染色,第二列代表SSC克隆DAPI复染,第三列代表SSC克隆明场形态,Negative代表阴性对照;s:AKP染色;t:RT-PCR,Primer代表阴性对照图4 免疫荧光、AKP染色和RT-PCR检测高龄小鼠SSC克隆的干细胞活性和精原干细胞标记物在蛋白和mRNA水平的表达情况(Bar=100μm)
3 讨 论
3.1 高龄小鼠睾丸微环境更有利于A型精原细胞增殖与存活
在正常睾丸发育过程中,PLZF高表达于Aun而弱表达于Adiff[10]。本研究IHC显示在高龄小鼠睾丸中PLZF除了Aun与Adiff精原细胞之外,还表达于In分化精原细胞,提示高龄小鼠睾丸微环境可能促进cKITpos分化精原细胞的去分化,以及PLZFPOS的Aun和Adiff精原细胞存活和增殖,与文献报道结果一致[11]。文献研究结果表明,高龄小鼠睾丸微环境发生氧化应激改变[12],导致活性氧(reactive oxygen species,ROS)水平升高,ROS激活Myc基因表达,促进精原细胞增殖而使精曲小管内其余生精细胞凋亡[13-14]。
3.2 通过优化睾丸消化分离富集步骤,最大程度获取单只高龄小鼠睾丸来源精曲小管和有活力的单细胞
8月龄高龄小鼠成批获取较困难,本课题组选择每次进行单只高龄小鼠的睾丸细胞消化富集和原代培养。根据前期经验,第一步消化时剪碎的精曲小管片段和消化下来的间质细胞团块比重相似,造成静置沉降时精曲小管片段与间质细胞团块都沉降在管底,导致消化的单细胞中存在间质成纤维细胞污染,需要经历多轮差异贴壁甚至多次传代才能够去除[15]。在本研究中,我们通过消化前机械去除间质组织和血管,第一步消化分离残留间质组织同时保持精曲小管的完整性,提高静置沉降时精曲小管与间质的比重差,保证沉降的精曲小管纯度,减少间质成纤维细胞对SSC原代培养过程的污染[16-17]。
3.3 高龄小鼠来源SSC体外培养需要高密度饲养层、条件培养基和高浓度生长因子及胎牛血清支持
精原干细胞原代培养克隆形成与增殖能力和饲养层种类、饲养层密度、生长因子种类、生长因子浓度、血清浓度均有密切关系[18-19]。本课题组在单只高龄小鼠来源精原干细胞原代培养进行了优化改进:采用CF-1小鼠来源胚胎成纤维细胞(mouse embryo fibroblasts,MEF)作为饲养层[18,20],提高MEF饲养层密度,填加条件培养基,提高胎牛血清与生长因子浓度,加入GDNF受体GFRa1可溶性成分,成功促进高龄小鼠SSC原代培养克隆形成并增殖传代保持长达6月。
3.4 高龄SSC克隆是包含未分化和分化精原细胞的异质性克隆
高龄小鼠体外培养的SSC克隆在逐渐降低胎牛血清浓度和饲养层密度后,可维持长期稳定增殖,具有干细胞的碱性磷酸酶活性,免疫荧光染色显示这些SSC克隆表达ThY-1、PLZF和OCT-4等A型精原细胞标记蛋白,不表达cKIT分化精原细胞和SCP3精母细胞标记蛋白;但是在mRNA水平,这些高龄小鼠来源SSC克隆除了表达Gfra1、Ssca-1、Oct-4等未分化精原细胞标记物之外,也表达c-kit分化精原细胞和Scp3精母细胞标记物;研究显示[21-22],在精原细胞分化以及减数分裂启动过程中主要涉及到转录后调控机制,提示本研究中单只高龄小鼠来源SSC克隆是由未分化、分化精原细胞构成的异质性克隆,与文献报道结果相符[23]。
总之,本研究通过在第一步消化中有效清除睾丸成纤维细胞,提高精原细胞接种密度、优化饲养层和生长因子、FBS组合等措施,成功建立单只8月龄昆明白来源高龄小鼠的SSC体外长期培养体系,该SSC克隆可以长期稳定传代,具有干细胞活性,是一株同时表达未分化和分化精原细胞标记物的异质性原代培养SSC细胞系。后续还需要进行SSC克隆同种异体移植进行功能表型鉴定,SSC转录组、表观组学检测将有利于我们深入理解高龄小鼠来源SSC的基因表达和表观调控情况。本研究为高龄男性SSC的体外功能表型和分子机制研究提供一种新的细胞工具。

