右美托咪定对缺氧/复氧心肌细胞的保护作用及机制研究
汪艳萍, 许宜珍, 袁应川, 古丽·亚科夫, 陈政文, 陈爱芳
(新疆医科大学第二附属医院 麻醉科, 新疆 乌鲁木齐, 830063)
麻醉过程中的缺氧是心肌缺血最重要的病因,可诱发心肌细胞凋亡、氧自由基的累积等,进而导致细胞死亡,引发心肌梗死。因此,如何保护麻醉过程中心肌细胞损伤成为研究的重点。右美托咪定(Dex)是近年来出现的高选择性α2肾上腺素能受体激动剂,具有镇静、镇痛和抗焦虑功效,对人体呼吸功能抑制性较弱,代谢快,不良反应少[1]。临床研究[2]发现, Dex可显著减少术后心肌缺血再灌注损伤发生率,提示Dex对心脏具有保护功能。张莹莹等[3]研究发现,心脏瓣膜置换术中使用Dex可保护心肌功能。此外,动物实验[4-5]同样表明,Dex可保护缺氧-复氧心肌细胞。但Dex对心肌细胞的保护作用机制尚处于探索阶段。微小RNA(miRNA)参与细胞的多种生物学行为,研究[6-7]发现,miRNA修复缺氧/复氧心肌细胞损伤中发挥重要作用。研究[8]显示,慢性心力衰竭患者血浆miR-138-5p水平呈低表达,上调miR-138-5p可促进缺氧/复氧心肌细胞的增殖,抑制凋亡。然而, miR-138-5p调控缺氧/复氧心肌细胞损伤的机制及其与Dex的关系尚不清楚。本研究探讨了Dex对缺氧/复氧心肌细胞的保护作用及其对miR-138-5p的影响。
1 材料与方法
1.1 细胞、试剂及仪器
H9C2心肌细胞(苏州海星生物科技有限公司),盐酸右美托咪定(天津一方科技有限公司),DMEM/F12培养基、双抗、胎牛血清(南京森贝伽生物科技有限公司),细胞凋亡检测试剂盒(武汉伊莱瑞特生物科技股份有限公司),超氧化物歧化酶(SOD)、乳酸脱氢酶(LDH)、丙二醛(MDA)酶联反应检测试剂盒(武汉伊莱瑞特生物科技股份有限公司),肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)酶联反应检测试剂盒(武汉伊莱瑞特生物科技股份有限公司),CCK-8检测试剂盒(武汉伊莱瑞特生物科技股份有限公司),兔抗人白细胞淋巴瘤-2(Bcl-2)、Bcl相关X蛋白(Bax)一抗(武汉伊莱瑞特生物科技股份有限公司),二甲基亚砜(DMSO)(武汉伊莱瑞特生物科技股份有限公司),Mir-X miRNA First-Strand Synthesis试剂盒(日本takara公司),TRIzol(上海联迈生物工程有限公司),空质粒(Vector)、miR-138-5p mimic、突变型(MUT)-性别决定区Y框蛋白9(SOX9)、野生型(WT)-SOX9载体(沈阳万通生物有限公司),Lipofectamine 3000(上海传秋生物科技有限公司),萤光素酶报告基因酶法试剂盒(Luciferase Reporter Gene, 上海西唐生物科技有限公司), ABI7500PCR仪(美国ABI公司),多功能酶标仪(杭州优米仪器有限公司), Tanon V8快速蛋白质印迹系统(武汉华科达实验设备有限公司)。
1.2 细胞培养、分组
H9C2细胞使用完全DMEM/F12培养基(包含0.1%双抗、10%胎牛血清)进行培养,培养条件为37 ℃、5% CO2。待细胞融合到80%左右时进行传代,取传代3次的细胞进行后续实验。将正常培养的细胞设为对照组。H9C2 细胞首先用无血清DMEM/F12培养基在95% N2+5% CO2的条件下孵育2 h,然后使用完全DMEM/F12培养基, 37 ℃、5% CO2条件下孵育6 h, 最后培养成缺氧/复氧(H/R)细胞。
用含有10 nmol/L Dex的完全DMEM/F12培养基孵育 H9C2细胞 24 h,然后进行H/R处理,将其设定为H/R+Dex组。将Vector、miR-138-5p mimic质粒转染至H9C2细胞后进行H/R处理,分别设定为H/R+Vector组、H/R+miR-138-5p组。将Vector、miR-138-5p mimic质粒分别与MUT-SOX9、WT-SOX9载体结合,共同转染至H9C2细胞,将得到的转染细胞分为MUT-SOX9+Vector组、MUT-SOX9+miR-138-5p组、WT-SOX9+Vector组及WT-SOX9+miR-138-5p组。
1.3 酶联免疫反应吸附法(ELISA)检测上清液指标水平
收集各组细胞上清液,以2 000转/min离心5 min,将上清液转移至新的离心管中。按照试剂盒说明书检测上清液中MDA、SOD、LDH、TNF-α及IL-6含量。
1.4 CCK-8检测细胞增殖
将各组细胞接种到96孔(1 000个细胞/孔),并进行不同处理24 h后加入10 μL CCK-8溶液孵育2 h, 检测450 nm吸光度值。
1.5 流式细胞术检测细胞凋亡
各组细胞培养24 h后用胰酶消化,制备单细胞悬液(2×105个/mL), 然后分别加入5 μL Annexin V-FITC、氯化丙定(PI),避光孵育15 min。上机检测细胞凋亡率。
1.6 实时荧光定量聚合酶链式反应(RT-qPCR)检测miR-138-5p表达
向各组细胞中加入Trizol提取总RNA, 利用反转录试剂盒合成 cDNA, 体系如下: mRQ Buffer (2x) 5 μL, RNA sample 3.75 μL, mRQ Enzyme 1.25 μL, 总体积10 μL, 随后进行qRT-qPCR,体系如下: ddH2O 9.0 μL, TB Green Advantage Premix (2X) 12.5 μL, ROX Dye (50X) 0.5 μL, miRNA-specific primer (10 μmol/L)及mRQ 3′ Primer (10 μmol/L)各0.5 μL, cDNA 2.0 μL。反应条件: 95 ℃ 10 s, 95 ℃ 5 s, 60 ℃ 20 s, 95 ℃ 60 s, 55 ℃ 30 s, 95 ℃ 30 s。内参选择U6, 采用2-△△Ct法表示miR-138-5p相对表达量。miR-138-5p上游引物: 5′- CCGATAAGACGAACAA-3′, 下游引物: 5′-GAGCAGGCTGGAGAA-3′; U6上游引物: 5′-GTTGCGGGTGTCCGAATG-3′, 下游引物: 5′-GGCAGAGATGATGACCCTTTT-3′。
1.7 Weston blot检测TNF-α、IL-6、Bcl-2、Bax及SOX9的表达
使用RIPA提取细胞总蛋白,测量浓度。配制浓缩胶、分离胶后向槽中加入约20 μg的蛋白, 70~110 V下分离蛋白,然后将蛋白转移只PVDF膜上,5%脱脂牛奶常温下封闭1 h, 加入TNF-α(1∶1 000)、IL-6(1∶1 000)、Bcl-2(1∶1 000)、Bax(1∶1 000)及SOX9(1∶1 000), 4 ℃冰箱孵育过夜,次日加入对应的二抗(1∶1 000)室温孵育1 h, 曝光, Image J分析灰度值,使用目的蛋白/内参β-actin比值表示表达量。
1.8 荧光素酶报告实验
通过target网站(http://www.targetscan.org)分析miR-138-5p与SOX9基因的结合核苷酸序列。将miR-NC、miR-138-5p mimic与MUT-SOX9、WT-SOX9分别两两结合共同转染至H9C2细胞中,孵育48 h, 使用细胞裂解液裂解后保留上清液检测荧光素酶活性。
1.9 统计学方法
使用SPSS 13.0软件对数据进行统计分析,计量数据以均数±标准差表示,组间比较行t检验,多组间单因素方差分析比较行q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 Dex对H/R细胞增殖的影响
H/R组细胞吸光度值为(0.83±0.07), 低于对照组的(2.01±0.13), 差异有统计学意义(t=13.84,P<0.001); H/R+Dex组细胞吸光度值为(1.68±0.11), 高于H/R组,差异有统计学意义(t=11.29,P<0.001)。
2.2 Dex对H/R细胞凋亡的影响
H/R组细胞凋亡率、Bax蛋白表达量分别为(19.93±2.03)%、(0.93±0.07), 高于对照组的(5.14±0.21)%、(0.89±0.11), Bcl-2蛋白表达量为(0.21±0.04), 低于对照组的(0.46±0.08), 差异有统计学意义(P<0.001); H/R+Dex组细胞凋亡率、Bax蛋白表达量分别为(8.32±0.53)%、(0.31±0.03), 低于H/R组, Bcl-2蛋白表达量为(0.78±0.09), 高于H/R组,差异有统计学意义(P<0.001)。见图1。

A: 对照组典型凋亡图; B: H/R组典型凋亡图; C: H/R+Dex组典型凋亡图; D: 各组细胞凋亡相关蛋白表达。图1 各组细胞凋亡率、Bcl-2及Bax表达量比较
2.3 Dex对H/R细胞炎性因子、MDA、SOD、LDH表达的影响
H/R组细胞MDA、LDH、TNF-α、IL-6表达量高于对照组, SOD表达量低于对照组,差异有统计学意义(P<0.001); H/R+Dex组细胞MDA、LDH、TNF-α、IL-6表达量低于H/R组, SOD表达量高于H/R组,差异有统计学意义(P<0.001)。见表1、2。
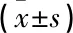
表1 各组细胞MDA、SOD、LDH表达水平比较
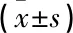
表2 各组细胞炎性因子和蛋白表达水平比较
2.4 Dex对H/R细胞miR-138-5p、SOX9表达的影响
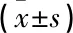
表3 各组细胞miR-138-5p、SOX9表达水平比较
H/R组细胞SOX9蛋白表达量高于对照组, miR-138-5p表达量低于对照组,差异有统计学意义(P<0.001); H/R+Dex组细胞SOX9表达量低于H/R组, miR-138-5p表达量高于H/R组,差异有统计学意义(P<0.001)。见表3。
2.5 miR-138-5p对H/R细胞增殖的影响
H/R+miR-138-5p组细胞miR-138-5p表达量为(1.65±0.15), 吸光度值为(1.64±0.13), 分别高于H/R+Vector组的(0.13±0.03)、(0.83±0.07), 差异有统计学意义(t=17.21, 9.502,P<0.001)。
2.6 miR-138-5p对H/R细胞凋亡的影响
H/R+miR-138-5p组细胞凋亡率为(5.14±0.21)%, Bax蛋白表达量为(0.41±0.11), 分别低于H/R+Vector组的(19.88±4.05)%和(0.95±0.13), Bcl-2表达量为(0.43±0.12), 高于H/R+Vector组的(0.14±0.04), 差异均有统计学意义(P<0.001)。见图2。
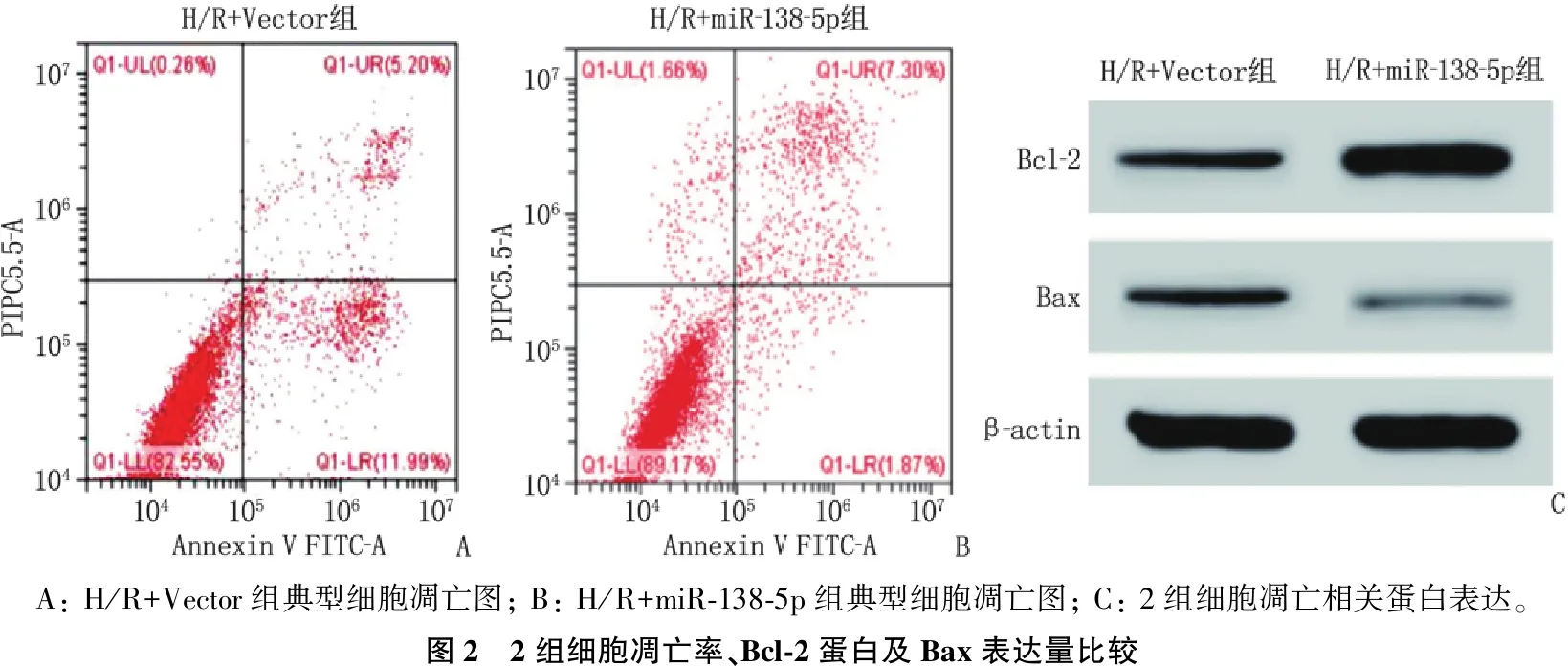
A: H/R+Vector组典型细胞凋亡图; B: H/R+miR-138-5p组典型细胞凋亡图; C: 2组细胞凋亡相关蛋白表达。图2 2组细胞凋亡率、Bcl-2蛋白及Bax表达量比较
2.7 miR-138-5p对H/R细胞炎性因子、MDA、SOD、LDH表达的影响
H/R+miR-138-5p组细胞MDA、LDH、TNF-α、IL-6表达量低于H/R+Vector组, SOD表达量高于H/R+Vector组,差异有统计学意义(P<0.001)。见表4、5。
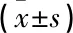
表4 2组细胞MDA、SOD、LDH表达水平比较
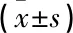
表5 2组细胞炎性因子和蛋白表达水平比较
2.8 miR-138-5p与SOX9的靶向关系
生物信息学分析发现, miR-138-5p与SOX9 3′UTR存在互补配对碱基对。H/R+miR-138-5p组细胞SOX9表达量低于H/R+Vector组,差异有统计学意义(P<0.05)。
与WT-SOX9+Vector组比较, WT-SOX9+miR-138-5p组细胞SOX9表达量降低,差异有统计学意义(P<0.05); MUT-SOX9+Vector组与MUT-SOX9+miR-138-5p组细胞SOX9表达量差异无统计学意义(P>0.05)。见图3。
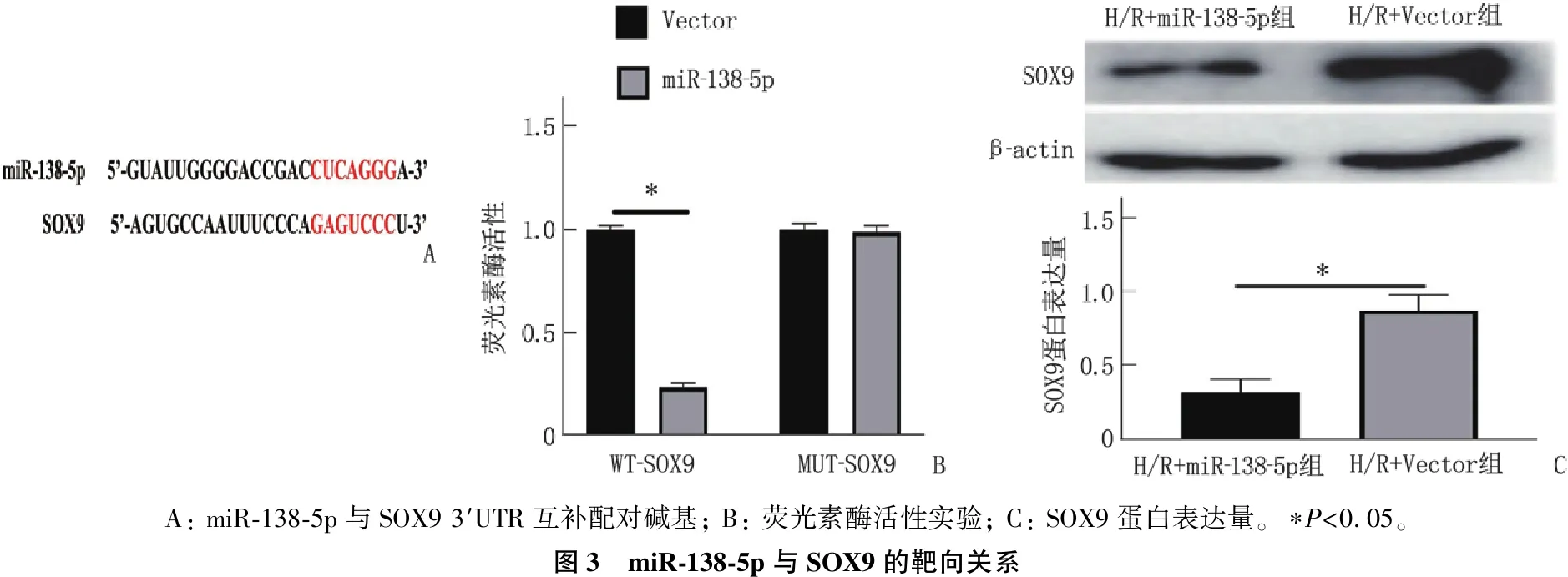
A: miR-138-5p与SOX9 3′UTR互补配对碱基; B: 荧光素酶活性实验; C: SOX9蛋白表达量。∗P<0.05。图3 miR-138-5p与SOX9的靶向关系
3 讨 论
心肌缺血再灌注损伤严重影响患者的生命质量,严重时甚至引起患者死亡。Dex作为α2肾上腺素能受体激动剂,具有镇静、消炎等功能。研究[9-10]表明, Dex对多种器官具有保护作用。李晓滨等[11]研究发现, Dex通过调控miR-146a/丝裂原活化蛋白激酶(MAPK)通路抑制缺血再灌注损伤大鼠心肌细胞内质网应激、氧化应激及凋亡,促进增殖。此外, WANG Z等[12]研究发现, Dex通过miR-208b-3p/Med13/Wnt通路抑制缺氧/复氧心肌细胞凋亡,促进细胞增殖。但Dex保护缺氧心肌细胞的机制尚不明确。本研究通过构建H/R心肌细胞模型,观察Dex对心肌细胞的保护功能及机制,结果显示, H/R心肌细胞增殖受到抑制、发生凋亡,加入Dex后则可以促进细胞的增殖并抑制凋亡,提示Dex对H/R心肌细胞具有保护作用。炎症反应是缺血再灌注损伤的基础。TNF-α、IL-6作为重要的促炎因子,参与了心肌细胞的缺血再灌注损伤,抑制炎症反应可显著改善心肌细胞的生理功能[13]。本研究结果显示, H/R心肌细胞TNF-α、IL-6表达明显升高,而Dex处理可抑制这些炎症因子的表达,提示Dex可通过降低H/R心肌细胞的炎症反应改善细胞损伤。氧化应激在心肌损伤中起到关键作用,心肌细胞发生损伤后,炎性因子、氧化应激反应可诱发线粒体功能失调,引起细胞内活性氧的产生,细胞出现凋亡[14]。SOD、MDA和LDH是评估抗氧化系统状态的可靠指标,其中SOD可抑制细胞脂质过氧化反应,导致活性氧下降; 细胞损伤后MDA和LDH出现过表达,并释放至细胞外。本研究结果显示, Dex可降低MDA和LDH水平,提高SOD含量,提示Dex具有抗氧化应激的作用[15]。
miR-138-5p与细胞炎症反应有关,参与心脏、脑血管及脊髓损伤的修复[16-18]。SUN S等[19]研究发现,下调miR-138-5p通过沉默调节蛋白1(SIRT1)促进心力衰竭的进展。此外, miR-138-5p在H/R心肌细胞中呈低表达,沉默miR-138-5p可上调心肌细胞炎性因子表达,促进细胞凋亡[20]。刘青[21]研究显示, miR-138-5p在H2O2诱导H9C2心肌细胞中呈低表达,上调miR-138-5p可抑制细胞炎性因子表达及氧化应激反应。本研究结果显示, H/R心肌细胞中miR-138-5p低表达,上调miR-138-5p可抑制H/R心肌细炎性因子表达,抑制细胞凋亡,促进细胞增殖[21]。此外,研究结果还表明,Dex处理H/R心肌细胞后可上调miR-138-5p表达,提示Dex可能通过miR-138-5p发挥其对心肌细胞的保护作用。
miRNA一般通过与下游靶基因结合发挥作用,为探索miR-138-5p的下游靶基因,本研究采用生物信息学分析法对其进行分析,结果发现miR-138-5p与SOX9 3′UTR区域存在结合位点,提示两者可能存在靶向关系。SOX9属于SOXE家族成员,参与细胞的多种生物学行为。研究[22]发现,在缺血性心脏疾病心肌组织中SOX9表达上调。本研究结果表明, H/R心肌细胞中SOX9高表达,与一项研究[22]结果基本一致。此外,上调miR-138-5p的心肌细胞中SOX9呈低表达,双荧光素酶实验进一步证实, miR-138-5p与SOX9存在负性调控关系。这些结果证实, miR-138-5p通过负性靶向调控SOX9保护H/R心肌细胞。
本研究存在一定局限性: 首先, miR-138-5p、SOX9与心肌缺血再灌注损伤的关系有待进一步在体内、体外进行实验验证;其次, Dex对心肌缺血再灌注损伤的保护作用有待进一步动物、人体实验进行验证;最后, Dex是否对通过其他miR发挥其保护作用需要进一步探讨。
综上所述, Dex可通过上调miR-138-5p抑制靶基因SOX9的表达,从而减轻H/R心肌细胞的炎症反应及氧化应激,抑制细胞凋亡,促进细胞增殖,最终发挥保护心肌的作用。

