术前控制营养状态评分与宫颈癌患者术后复发、转移的关系
蔡祎品, 黄海伟, 刘晓丽, 张 洁, 徐崧圆, 高 瑜, 赵 芳
(苏州大学附属张家港医院 妇科, 江苏 张家港, 215600)
宫颈癌是全球最常见的妇科恶性肿瘤,也是导致女性癌症相关死亡的主要原因之一。癌症统计数据[1-3]表明,全球每年约57万女性被诊断为宫颈癌,其中约一半以上患者因此而死亡。根治性手术切除配合术后同步放化疗是目前宫颈癌患者的主要治疗模式,但肿瘤的高复发、转移使宫颈癌患者的总体治疗效果无法令人满意[4-5]。因此,寻找有效预测宫颈癌复发、转移风险的生物学指标是早期识别高危患者和提高长期生存率的关键。目前,研究[6-7]证实的影响宫颈癌患者预后的因素包括肿瘤直径、肿瘤浸润深度、盆腔淋巴结转移、淋巴血管间隙浸润(LVSI)以及国际妇产科联合会(FIGO)肿瘤分期等。然而,这些因素主要关注肿瘤的病理生物学特征,未考虑肿瘤患者自身因素对预后的影响。肿瘤患者免疫营养状态和全身炎症反应与癌症的发生发展及患者预后密切相关。一些反映营养免疫状态与炎症反应程度的生物学指标,如中性粒细胞与淋巴细胞计数的比值 (NLR)、血小板与淋巴细胞计数的比值 (PLR)、预后营养指数(PNI)、控制营养状态(CONUT)评分、格拉斯哥预后评分(GPS)等已被证实可作为恶性肿瘤患者预后的有效评价工具[8-9]。CONUT评分最初是住院患者营养风险筛查的一种简单、客观的评价方法,能够综合反映机体营养状况、免疫功能和脂质代谢[10]。之后CONUT评分被用于预测多种恶性肿瘤患者的术后并发症风险、复发、转移及长期生存结局[11-13]。本研究探讨CONUT评分与术后复发、转移的关系,明确其作为宫颈癌患者预后参数的临床价值。
1 资料与方法
1.1 一般资料
本研究将2017年1月—2019年4月因宫颈癌接受根治性手术切除的患者作为研究对象。纳入标准: ① 所有患者均行子宫根治性切除及彻底的盆腔淋巴结清扫,经术后病理学证实为Ⅰ~ⅡA期宫颈鳞状细胞癌或宫颈腺癌; ② 既往未接受放化疗等抗肿瘤治疗措施者; ③ 经影像学证实无肺、肝、骨等远隔器官转移者。剔除标准: ① 患者存在严重影响外周血淋巴细胞总数、血清白蛋白及总胆固醇含量检测的疾病,如肝肾功能不全、血液系统疾病、活动性传染病、自身免疫性疾病等; ② 合并其他系统恶性肿瘤者; ③ 临床病理资料、实验室检查不完整者; ④随访时间短于1个月者。本研究严格按照《赫尔辛基宣言》的伦理标准进行,经医院伦理委员会审核批准,临床数据遵循隐私保密准则,并在数据收集前以书面形式获得患者或其家属的知情同意。
1.2 临床数据收集
通过医院电子病历系统收集纳入患者的基本信息、临床病理资料和实验室检查结果,包括年龄、人类乳头瘤病毒(HPV)感染、病理组织学类型、肿瘤分化程度、肿瘤直径、宫旁浸润、盆腔淋巴结转移、FIGO肿瘤分期、LVSI、辅助放化疗等。所有患者宫颈癌临床分期根据2009年版FIGO肿瘤分期系统确定[14]。宫颈癌的组织学类型与组织学分级采用世界卫生组织(WHO)对女性生殖系统肿瘤的分类(2020年版)进行定义[15]。
所有患者于术前1周常规进行空腹采血,检测项目包括血常规、血生化指标检测、鳞状细胞癌抗原 (SCC-Ag)等指标,以评估患者血清白蛋白水平、外周血淋巴细胞总数及总胆固醇浓度。根据既往研究[10]对CONUT评分的定义, CONUT评分具体计算标准如下: ① 血清白蛋白水平按照≥35.0 g/L、30.0~<35.0 g/L、25.0~<30.0 g/L和<25.0 g/L共 4个等级,分别计0、2、4和6分; ② 外周血淋巴细胞总数分别按照 ≥1 600×103个/mL、1 200~<1 600×103个/mL、800~<1 200×103个/mL和<800×103个/mL, 计0、1、2和3分; ③ 血清总胆固醇浓度按照≥180 mg/dL、140~<180 mg/dL、100~<140 mg/dL和<100 mg/dL共4个等级,分别计0、1、2和3分。根据以上3项指标的分数计算每位患者的CONUT总分,满分为12分,其中0~1分为营养状态良好, 2~4分为轻度营养不良, 5~8分是中度营养不良, ≥9分表明存在重度营养不良[10]。
1.3 随访与研究结局
对存在LVSI、盆腔淋巴结转移、宫旁浸润等危险因素者,根据患者自我意愿行放疗、化疗或同步放化疗。放疗常规剂量为45~55 Gy, 照射野包括肿瘤床和区域淋巴结组织等,化疗药物为铂类药和紫杉醇为基础的治疗方案。所有患者手术治疗结束后前2年每3个月及之后每6个月进行1次随访评估,随访内容包括常规妇科查体、阴道残端细胞学检查、CT扫描(胸、腹、盆腔)、肿瘤标志物检测等。根据患者症状或辅助检查对可疑局部复发或远处转移者进一步行正电子发射计算机断层扫描(PET)/CT或阴道镜下细胞学活检,以明确诊断。本研究主要观察终点为无复发生存时间 (RFS), 定义为患者自手术日至术后出现肿瘤复发或转移的时间。术后复发、转移包括肿瘤局部复发、盆腔区域淋巴结转移及远处转移(肺、骨、肝等)。
1.4 统计学分析

2 结 果
2.1 一般资料比较
根据纳入和排除标准,本研究最终共纳入134例接受根治性手术治疗的宫颈癌患者。全组患者中位年龄55 (41, 68) 岁, 108例患者存在HPV感染。组织学高、中、低分化者分别为21例、68例和45例,鳞状细胞癌(116例)是最常见的病理组织学类型。根据2009年版FIGO肿瘤分期, ⅠA期患者15例, ⅠB期94例, ⅡA期25例,其中23例患者有盆腔淋巴结转移, 13例患者有宫旁浸润, 34例患者存在LVSI。
2.2 CONUT评分与宫颈癌患者临床病理特征的关系
根据每位患者血清白蛋白水平、外周血淋巴细胞总数及总胆固醇浓度计算CONUT评分,全组患者中位CONUT评分为2(1, 4) 分,其中营养状态良好56例(41.8%), 轻度营养不良54例(40.3%), 中度营养不良20例(14.9%), 重度营养不良4例(3.0%)。基于tROC曲线, CONUT评分预测宫颈癌患者术后复发、转移的最佳截断值为3分,AUC值为0.709 (95%CI: 0.587~0.830), 见图1。
高CONUT评分组与低CONUT评分组的一般资料及临床病理特征的分布结果表明,与低CONUT评分组相比,高CONUT评分组患者盆腔淋巴结转移率(26.9%、11.0%,χ2=5.692,P=0.017)和FIGO肿瘤分期 (FIGO ⅡA期: 28.8%、12.2%,χ2=5.814,P=0.016) 更高,差异有统计学意义(P<0.05)。然而, 2组年龄、HPV感染、组织学类型、组织学分级、术前血清SCC-Ag水平、肿瘤直径、宫旁浸润、LVSI和术后辅助治疗等方面比较,差异无统计学意义(P>0.05), 见表1。
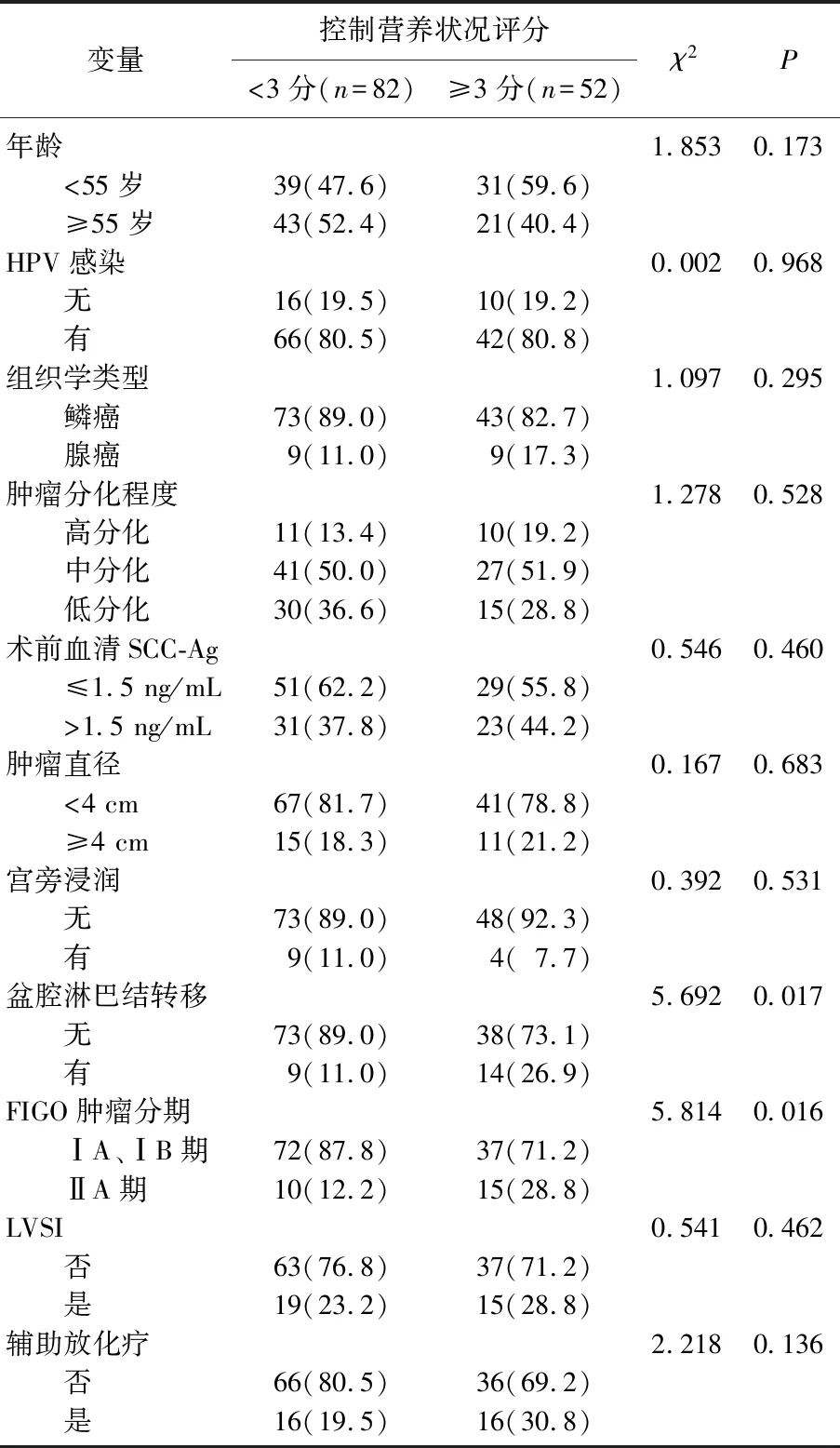
表1 CONUT评分<3分与≥3分患者的一般资料及
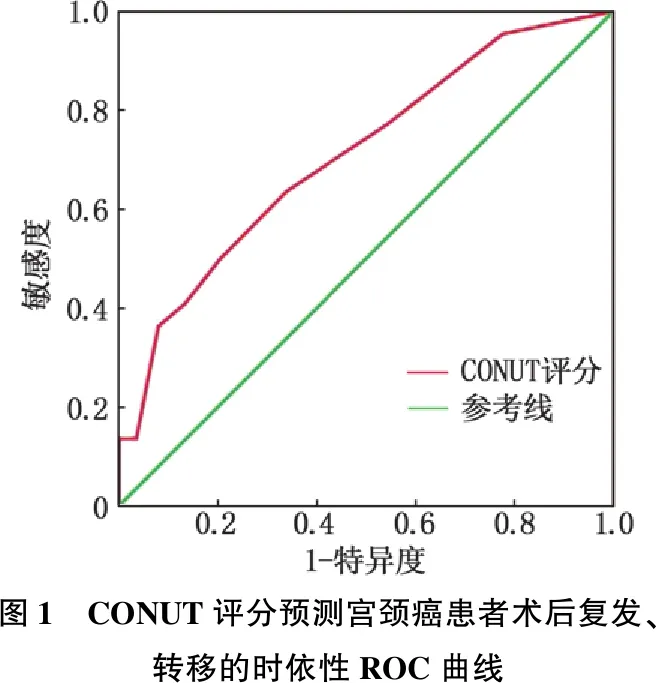
图1 CONUT评分预测宫颈癌患者术后复发、转移的时依性ROC曲线
2.3 CONUT评分作为宫颈癌患者术后复发、转移的预测指标
全组患者的中位随访时间为35.4 (21.0, 44.0)个月,随访期内共22例(16.4%)宫颈癌患者术后发生肿瘤复发、转移,患者总体3年无复发生存率为83.4%。生存分析表明,高CONUT评分组患者术后复发、转移风险高于低CONUT评分组, 2组患者3年无复发生存率分别为69.5%和89.3%, 差异有统计学意义(χ2= 7.244,P=0.007), 见图2。
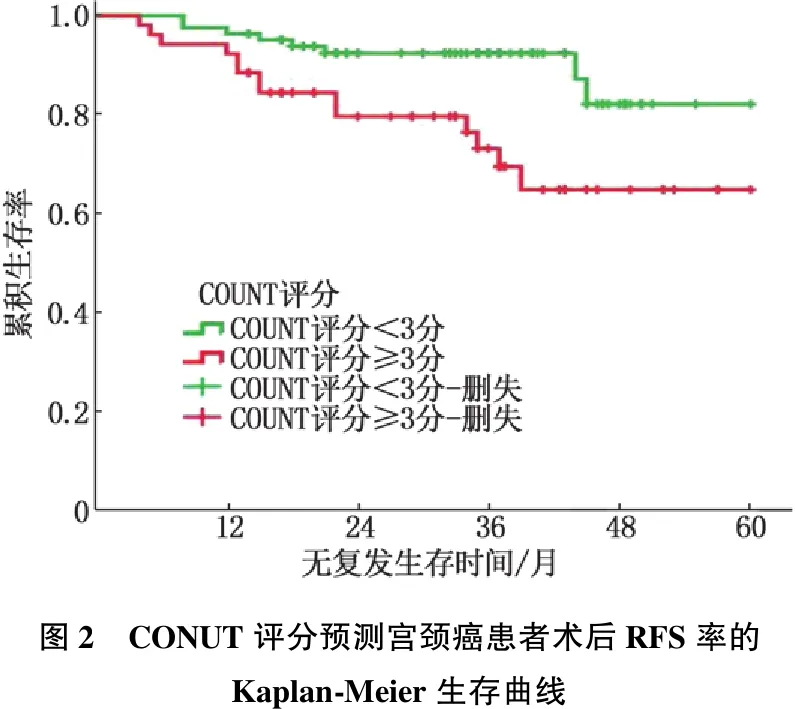
图2 CONUT评分预测宫颈癌患者术后RFS率的Kaplan-Meier生存曲线
为了进一步分析宫颈癌术后复发、转移的独立危险因素,本研究对患者的临床病理特征和CONUT评分等因素进行了单变量和多变量Cox回归分析。单变量Cox回归分析发现,术前血清SCC-Ag >1.5 ng/mL(P=0.044)、盆腔淋巴结转移(P=0.005)、FIGO ⅡA期(P<0.001)、LVSI(P=0.001)及COUNT评分≥3分(P=0.011)与宫颈癌患者术后复发、转移具有显著相关性。通过多变量Cox回归模型校正混杂因素后, CONUT评分(HR=2.771, 95%CI: 1.158~6.626,P=0.022)仍然是宫颈癌患者术后复发、转移的独立预测因素。此外,其他具有显著差异的预测变量还有FIGO肿瘤分期 (HR=2.968, 95%CI: 1.183~7.444,P=0.020)和LVSI (HR=2.589, 95%CI: 1.031~6.499,P=0.043), 见表2。
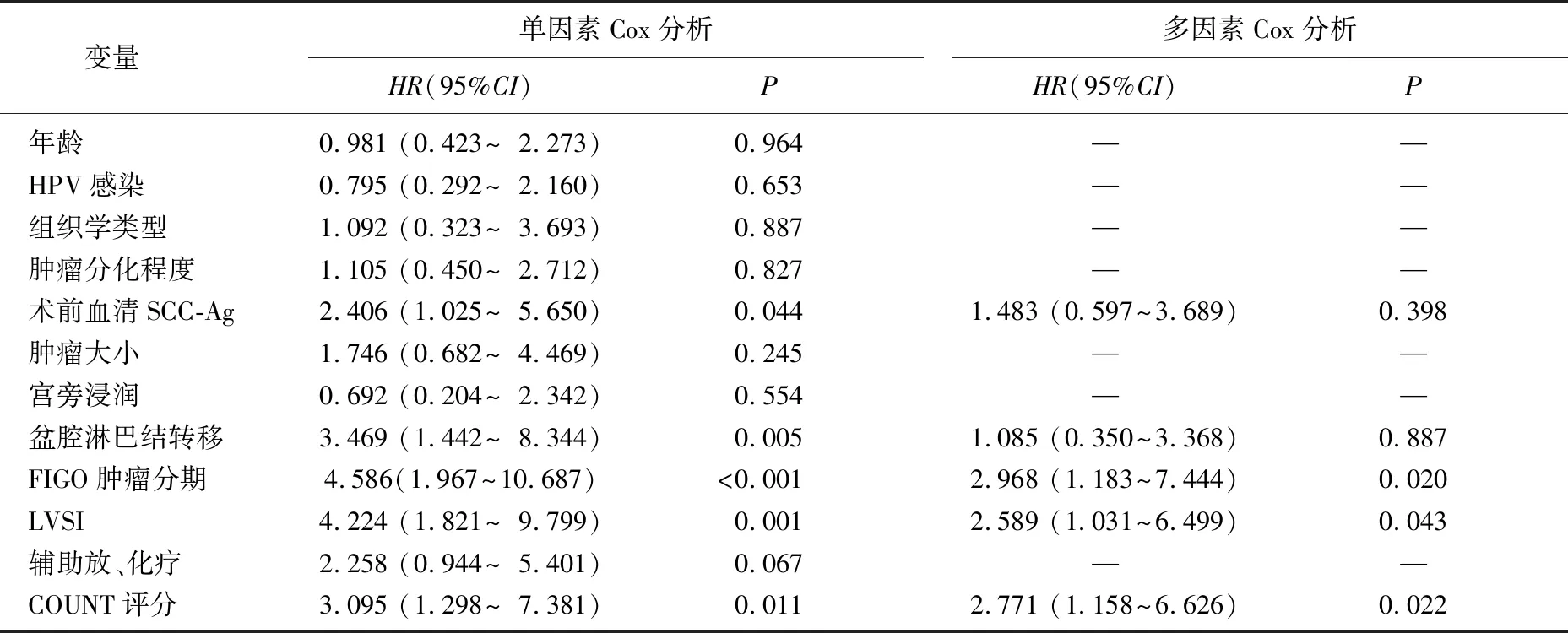
表2 影响宫颈癌患者RFS的风险因素分析
3 讨 论
高肿瘤负荷会导致慢性营养消耗与代谢紊乱,营养失衡是恶性肿瘤患者常见的临床表现之一。研究[16-17]发现, 30%~80%的肿瘤患者在疾病发生发展过程中存在不同程度的营养不良。本研究将CONUT评分作为宫颈癌患者营养评估的工具,结果发现, 55.2%的患者术前存在不同程度的营养不良,其中约17.9%的患者有中度以上营养不良,进一步表明营养状态失衡在宫颈癌患者中普遍存在。近年来,肿瘤患者的营养状态评估与营养干预逐渐受到临床重视[18]。研究[19-20]发现,营养不良是各种恶性肿瘤患者预后不良的独立危险因素。CONUT评分早期主要用于肿瘤患者术前的营养风险筛查,完全基于患者的血清白蛋白水平、外周血淋巴细胞总数及总胆固醇浓度等3个血液学参数指标,是1项客观反映患者免疫营养状态的评价工具[10]。有学者认为,肿瘤患者的内环境变化不仅可以反映机体的免疫营养状况,还有助于评估术后复发、转移风险及预后结局。既往研究[12, 21-22]已证实, CONUT评分可作为预测卵巢癌、乳腺癌、肝癌等患者肿瘤复发与长期生存的独立预后参数。但很少有文献报道CONUT评分对宫颈癌患者预后评估的重要性。
本研究回顾性分析了术前CONUT评分与宫颈癌临床病理特征及患者术后复发、转移的关系,结果表明, CONUT评分≥3分与盆腔淋巴结转移及FIGO肿瘤分期显著相关,是宫颈癌患者复发、转移的独立预测指标。本研究结果也得到了其他文献的支持,在ZHANG G Y等[23]研究中, 698例接受手术和术后同步放化疗的ⅠB~ⅡA期宫颈癌患者,根据治疗前CONUT评分被分为高CONUT评分(≥3分) 组与低CONUT评分组(<3分),结果发现,高CONUT组子宫旁浸润与盆腔淋巴结转移发生率更高,总体生存率更差。同时, KURODA D等[24]报道了CONUT评分对697例胃癌患者的预后价值,结果证实, CONUT评分对高复发风险患者的识别优于体质量指数、PNI等其他营养评价参数,为胃癌患者提供了更为准确的预后分层。与此同时,在临床实践中应注意评估患者治疗前的营养状况,并提供针对性的干预措施,以期降低术后复发、转移风险,改善肿瘤患者的预后。
血清白蛋白主要由肝脏合成,是反映机体营养状态与炎症反应的重要指标之一。由于肿瘤的分解代谢与营养物质消耗,低白蛋白血症在恶性肿瘤中,特别是晚期肿瘤患者中极为普遍[25-26]。研究[27-28]证实,低白蛋白血症促进肿瘤的进展与转移,是疾病严重程度与不良预后的预测因子。在CONUT评分体系中,血清白蛋白值被赋予了其他2个因素2倍的权重,充分体现了其在肿瘤患者预后预测中的显著影响。脂质代谢在恶性肿瘤的发生、发展过程中同样发挥着举足轻重的作用。研究[29-30]发现,当血清胆固醇水平降低时,肿瘤的发病风险增高24%, 并与患者不良预后显著相关。低胆固醇血症在恶性肿瘤患者中同样较为常见,作为机体热量储备的主要指标,胆固醇的生物合成常可受到肿瘤生长的抑制,使细胞膜的完整性受损,进而影响DNA复制和细胞的增殖、侵袭能力[31-33]。外周血淋巴细胞总数是机体抗肿瘤免疫的重要体现,研究[34-35]发现CD4+和CD8+T淋巴细胞数量减少可导致肿瘤细胞逃脱机体免疫监视,促进肿瘤的进展与转移。因此,从生物学角度可以解释CONUT评分与宫颈癌淋巴结转移及FIGO肿瘤分期的关系,因为高肿瘤负荷可以促进肿瘤坏死因子、转化生长因子和白细胞介素-6等炎症介质的分泌,直接干扰蛋白质、脂质等营养物质的代谢[36-37]。CONUT评分充分整合了3项免疫营养评价参数,可以更好地反映机体的免疫状态与营养平衡,进一步提高肿瘤患者预后评估的准确性。
本研究进一步证实了CONUT评分在宫颈癌患者中的预后价值,但主要局限性在于回顾性设计和有限的样本量,尽管在统计过程中进行了严格的病例筛选,但依然可能存在选择性偏倚。其次,预测宫颈癌患者术后复发、转移的最佳CONUT评分阈值尚无统一标准。本研究通过tROC曲线认定了CONUT评分≥3分为划分阈值,但仍需要在未来的研究中加以证实。因此,未来还需进一步开展多中心、大样本、前瞻性的临床研究。
综上所述, CONUT评分是宫颈癌患者术后复发、转移的独立预测因素, CONUT评分≥3分表明患者预后不佳。本研究结果进一步证实了CONUT评分作为宫颈癌患者的预后指标的临床价值,提示临床应重视术前营养状况评估及营养干预,以改善宫颈癌患者的预后结局。

