颗粒蛋白前体PGRN通过增强ORFV诱导的自噬促进病毒的复制
甄瑞雪,吕丽君,陆慧君,刘兴源,徐梦实,关继羽,贺文琦,高 丰,赵 魁
(吉林大学 动物医学学院 人兽共患病研究教育部重点实验室,吉林 长春 130062)
羊传染性脓疱病又称羊口疮(orf),是由羊传染性脓疱病毒(orf virus,ORFV)感染引起绵羊、山羊以及多种野生动物的一种高度接触性传染病,人也可通过接触发生感染[1]。ORFV是痘病毒科副痘病毒属代表种,具有高度的嗜上皮性,主要引起感染动物口唇部、鼻周、乳房、外阴部以及蹄部皮肤的增生性病变,感染羊尤其是羔羊常因饥饿和继发感染导致生长迟缓甚至死亡[2-3]。在人类,ORFV感染部位皮肤也出现水疱、脓疱等病变,后期形成溃疡甚至结痂脱落,多表现为局部自限性病变[4]。目前,ORFV感染广泛发生于世界各地羊群中,感染动物常出现生长及繁殖性能的下降,给养羊业造成严重的经济损失[5-6]。
细胞自噬是真核生物的一种高度保守的由溶酶体介导的降解和循环过程。细胞可利用自噬清除和降解其自身破损、老化以及功能异常的细胞器和蛋白质,以维持细胞内稳态。此外,自噬也可清除入侵的病原体,是机体抵抗感染的重要机制之一[7-8]。在发生自噬时,细胞内形成一种称为吞噬泡的小囊泡样结构,包裹待降解产物形成具有双层膜结构的自噬体,最终自噬体与溶酶体融合形成自噬溶酶体,进而将底物降解[9-10]。尽管自噬被证实是一种有效应对病毒感染的防御机制,但多种病毒也进化出阻止或利用自噬的策略,以利于其自身的复制增殖[11]。
颗粒蛋白前体(progranulin,PGRN)是广泛分布于各组织、器官和细胞中的一种分泌型多功能蛋白,参与了炎症反应、创伤修复、神经发育、自噬等多种生命活动过程[12-13]。目前,越来越多的证据表明,PGRN是溶酶体功能的关键调控因子,它能够被转运至溶酶体并分解产生促进溶酶体功能的颗粒蛋白亚基,进而参与调节自噬[14]。课题组前期研究结果显示,ORFV感染能够诱导细胞自噬,并且随着自噬水平的增加,病毒复制也随之增强,然而PGRN是否参与对ORFV诱导自噬的调控及机制尚不清楚。鉴于此,本研究首先从转录和蛋白水平上分析了PGRN在ORFV感染细胞中的表达变化规律,并深入探讨了PGRN对ORFV感染诱导自噬水平及病毒复制增殖的影响。本研究结果不仅有利于明确PGRN对ORFV诱导自噬水平的调控作用,而且将为进一步揭示ORFV致病机制奠定基础。
1 材料与方法
1.1 病毒和细胞ORFV/JL/08/CC毒株由本实验室分离鉴定及保存[15];OFTu细胞由本实验室分离培养及保存。
1.2 主要试剂高糖DMEM(美伦生物);高糖DMEM(2×)(吉诺生物);胰蛋白酶(新赛美生物科技有限公司);胎牛血清(BI公司);5×上样缓冲液、RIPA蛋白裂解液(中)、Lipo8000TM转染试剂、BCA试剂盒(碧云天生物);快速封闭液(雅酶生物);GAPDH抗体、辣根过氧化物酶(HRP)标记山羊抗兔、抗鼠和辣根过氧化物酶(HRP)标记驴抗羊IgG(Proteintech公司);PGRN抗体(R&D公司);Progranulin/PGRN 蛋白(MCE);LC3B抗体(Sigma公司);PCR引物由吉林省库美生物有限公司合成。
1.3 细胞培养与病毒感染将状态良好且处于对数生长期的OFTu细胞进行传代,以80%~90%细胞密度接种于6 cm一次性细胞培养皿中,培养18~24 h后,接种ORFV(MOI=10),分别收集感染后0,12,24,36,48,60 h的样品进行实时荧光定量PCR(qRT-PCR)和Western blot分析。
1.4 细胞转染将OFTu细胞以70%~80%的密度接种于6孔细胞培养板中,培养18~24 h后进行转染,在进行转染前更换培养基,将每个孔都换成2 mL的新鲜培养液(1%青链霉素,10%FBS),然后再进行后续的细胞转染操作:取1个洁净无菌的1.5 mL离心管,分别依次加入125 μL 高糖DMEM、100 pmol/L siRNA、4 μL Lipo8000TM转染试剂,并依次用枪轻轻吹打混匀,室温孵育20 min后滴加至6孔板内,放入细胞培养箱继续培养24 h后,将ORFV以MOI=10接种细胞,收集感染后48 h的样品进行qRT-PCR、Western blot和病毒毒力测定。同时设立PGRN处理组,将OFTu细胞以70%~80%的密度接种于6孔细胞培养板中,培养18~24 h后以MOI=10接种ORFV,孵育1 h后将培养液更换为2 mL含1 000 μg/L PGRN重组蛋白、2% FBS的培养液,感染后48 h收集样品进行qRT-PCR、Western blot和病毒毒力测定。
1.5 荧光定量PCR分析将细胞按照1.3和1.4方式进行处理后,提取细胞总RNA,将其反转录成cDNA后,应用特异性引物检测PGRN mRNA的相对表达。反应参数:95℃ 2 min,94℃ 15 s,55℃ 15 s,68℃ 30 s,95℃ 15 s,60℃ 1 min,45个循环。以GAPDH作为内参,计算相对表达量,引物序列见表1。
表1 引物信息
1.6 Western blot检测将细胞按1.3和1.4处理后,使用RIPA裂解液(PMSF浓度为1 mmol/L)将收集于1.5 mL离心管底部的细胞沉淀吹起并吹打混匀,冰上孵育30 min后,4℃ 12 000 r/min离心10 min,测定蛋白质量浓度。取蛋白样品,进行12% SDS-PAGE,电泳后通过半干法将蛋白转移至PVDF膜上,应用快速封闭液室温封闭15 min后,用TBST冲洗1次,分别用PGRN、GAPDH、LC3B抗体4℃孵育过夜后,TBST清洗 3次,每次10 min,用辣根过氧化物酶(HRP)标记的山羊抗兔、抗鼠和抗羊IgG于37℃孵育1 h,用TBST清洗3次,每次10 min,用ECL法显色后利用ImageJ软件对蛋白条带进行定量分析。
1.7 病毒噬斑试验将OFTu细胞以80%~90%的密度接种于12孔板,培养18~24 h后,分别将相应的病毒液稀释到原来浓度的10-3,对应每孔接种600 μL稀释的病毒液,37℃、5% CO2孵育1 h后弃掉病毒液,加入2%低熔点琼脂糖培养基,培养5 d后,弃掉上层琼脂糖培养基,用4%多聚甲醛室温固定15 min后,用2%结晶紫进行细胞染色,用清水冲洗3次后拍照分析。
1.8 统计学分析使用SPSS 20.0软件进行统计学分析,P>0.05表示差异不显著,*P<0.05表示差异显著,**P<0.01表示差异非常显著,***P<0.001表示差异极显著。
2 结果
2.1 ORFV感染诱导PGRN表达上调收集ORFV感染后不同时间(0,12,24,36,48,60 h)的OFTu细胞样品,分别提取感染细胞总蛋白及总RNA进行Western blot和qRT-PCR分析。利用Western blot对感染细胞中PGRN、ORFV及自噬相关蛋白P62、LC3蛋白表达的检测结果显示,ORFV诱导OFTu细胞自噬的发生时间为36 h,此时LC3开始发生型别转换,P62下调;PGRN的表达量也在36 h开始显著上调(图1)。利用提取的感染后不同时间的OFTu细胞总RNA进行qRT-PCR测定,并利用Excel和SPSS软件进行统计分析,结果如图2所示,PGRN mRNA的表达呈时间依赖性增加。上述结果提示,PGRN表达的上调可能与自噬的发生相关。
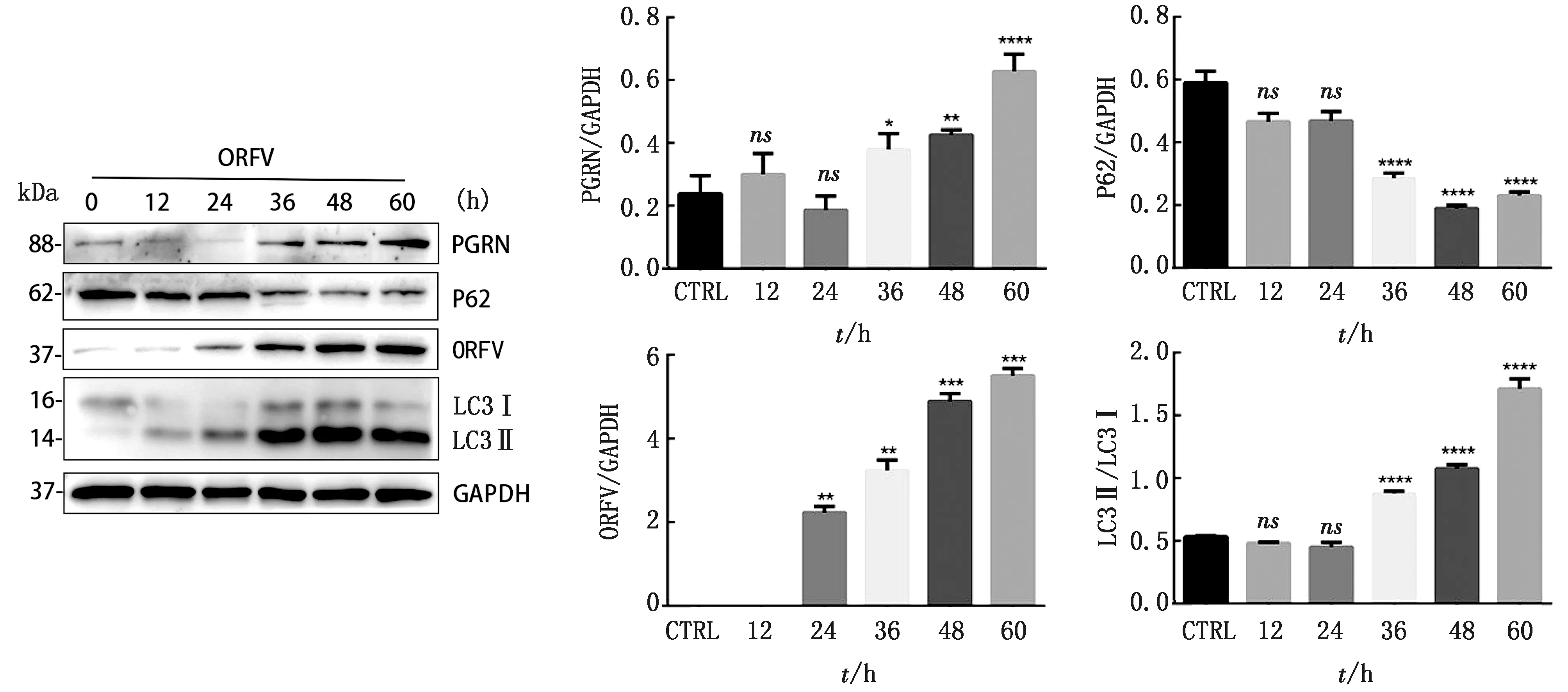
图1 Western blot检测PGRN、ORFV及自噬相关蛋白P62、LC3蛋白的相对表达水平
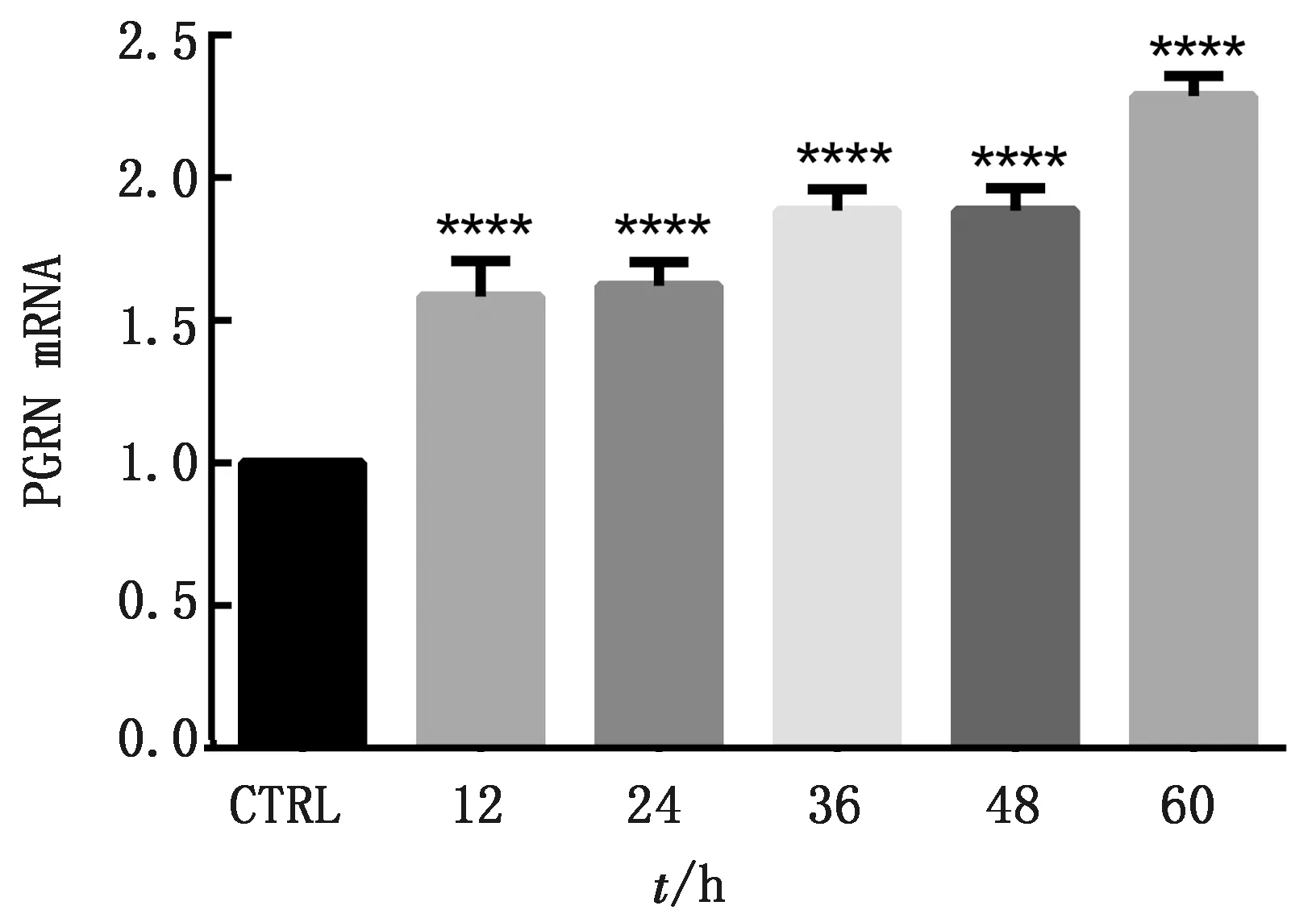
图2 qRT-PCR检测PGRN mRNA表达情况
2.2 PGRN正向调节ORFV诱导的OFTu细胞自噬为明确PGRN与ORFV诱导OFTu细胞自噬之间的关系,将特异性靶向PGRN的siRNA#640、#1509、#1632转染细胞,48 h后收取细胞样品,分别提取细胞总蛋白和总RNA,利用Western blot和qRT-PCR检测PGRN蛋白及mRNA表达情况。结果如图3A所示,将PGRN靶向siRNA#640和siRNA#1632转染细胞后,PGRN的蛋白质水平和mRNA表达显著降低。选取#1632转染OFTu细胞,转染后24 h以MOI=10接种ORFV,接种后48 h 提取细胞总蛋白通过Western blot检测PGRN、P62以及LC3蛋白表达情况,结果如图3B所示,干扰PGRN后,P62的表达上调,抑制 LC3Ⅰ向LC3Ⅱ的型别转化。而在ORFV感染细胞中添加PGRN重组蛋白培养48 h后,提取细胞总蛋白,通过Western blot检测PGRN、P62以及LC3蛋白表达情况,结果如图3C所示,体外添加PGRN重组蛋白后,P62的表达下调并且促进LC3Ⅰ向LC3Ⅱ的转换。
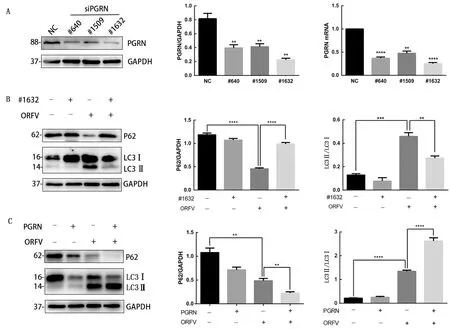
A. 将siRNAs转染OFTu细胞后,PGRN的蛋白和mRNA表达检测;B. 干扰PGRN后,OFTu细胞感染ORFV后48 h LC3和P62蛋白表达检测;C. 添加PGRN重组蛋白后,OFTu细胞感染ORFV后48 h LC3和P62蛋白表达分析
2.3 PGRN通过调控自噬影响ORFV复制为了探究PGRN对ORFV复制的影响,用siRNA#1632转染OFTu细胞后,将ORFV以MOI=10分别接种siRNA#1632转染后24 h的OFTu细胞以及添加重组PGRN蛋白的OFTu细胞,分别收集感染后48 h的病毒液进行病毒噬斑试验,结果显示,干扰PGRN抑制了ORFV的复制(图4A),而体外添加PGRN能显著促进ORFV的复制(图4B)。为进一步明确PGRN是否通过对ORFV诱导的自噬水平进行调节而影响ORFV的复制,将ORFV以MOI=10接种至自噬抑制剂BafA1(20 nmol/L)预处理的细胞及正常OFTu细胞,孵育1 h后分别加入含有相同浓度的自噬抑制剂BafA1、BafA1+PGRN重组蛋白,收集培养48 h后的病毒液进行噬斑试验,结果如图4C所示,经自噬抑制剂BafA1处理的细胞中ORFV的毒力被显著抑制,而添加PGRN重组蛋白的细胞中ORFV的毒力相对于单独添加自噬抑制剂BafA1有所回升。上述结果表明,PGRN通过调节ORFV诱导OFTu细胞自噬水平影响ORFV的复制。
A.转染siRNA#1632后,病毒复制能力变化检测;B.体外添加PGRN后, 病毒复制能力变化检测;C.BafA1+PGRN重组蛋白共处理后,病毒复制能力变化检测
3 讨论
羊口疮(orf)又称羊传染性脓疱病、传染性脓疱性皮炎,是主要发生于绵羊和山羊的一种高度接触性传染病,表现为皮肤/黏膜的增生性病变[16]。该病的病原ORFV具有高度的嗜上皮性,主要感染受损或疤痕皮肤,并在表皮角质细胞中复制。该病的病变通常表现为红斑、丘疹、水疱、脓疱和结痂,主要发生于羔羊的口唇及鼻周部位,但乳房、阴部、蹄部也可发生感染[17-18]。由于单纯ORFV感染多为自限性疾病,人们认为ORFV仅导致感染动物局部较为轻微的皮肤病变,从而忽视了ORFV感染对羊群乃至人的潜在危害。然而,ORFV传染性强,且对外界环境抵抗力强,能够在感染痂皮中存在数月甚至数年,可持续多年危害羊群,严重危害感染动物产毛、产肉、繁殖等生长与生产性能,给养羊业造成严重的经济损失。此外,作为一种人兽共患病病原,ORFV潜在的公共卫生安全问题目前也已引起人们的重视。
自噬是一种在所有真核生物中高度保守的细胞降解和循环过程,通过胞质细胞器、蛋白质和大分子的降解以及分解产物的再循环,在细胞的生存和维持中发挥着重要作用[19]。在哺乳动物细胞中,自噬主要包括以下3种类型:微自噬、大自噬和伴侣蛋白介导的自噬(CMA)[20]。虽然每一种自噬都在形态上不同,但这3种类型都最终将底物运送到溶酶体进行降解,进而维持细胞内稳态[21]。虽然自噬能够清除大多数的外来细菌和病毒,但许多病毒已经进化出一系列的策略来逃逸这种细胞防御机制,甚至可利用自噬来促进自身的复制。目前的研究表明,病毒可通过3种方式适应或调节自噬:一些病毒能够抑制自噬的发生,例如人单纯疱疹病毒Ⅰ型(HSV-1)能够编码产生神经毒力蛋白ICP34.5,通过与自噬相关蛋白Beclin-1结合抑制自噬发生,进而减弱细胞防御对其自身复制的限制[22]。此外,一些病毒能够诱发细胞产生不完全自噬,即在感染初期能够促进细胞自噬,但后期可抑制自噬溶酶体形成,阻断自噬内容物降解,例如人病毒性肝炎病毒(HCV)[23]和人狂犬病病毒(RV)[24]。然而,还有一些病毒能够利用细胞自噬促进病毒自身的复制。本课题组前期研究证实,ORFV能够诱导OFTu细胞发生完全自噬,并可利用自噬促进其自身的复制[25-31]。
PGRN作为分布广泛的一种分泌型多功能蛋白,已被证实是参与自噬调节的重要分子。然而PGRN是否参与对ORFV诱导的自噬的调控及机制尚不清楚。鉴于此,本研究首先从转录和蛋白水平上分析了PGRN在ORFV感染细胞中的表达变化规律,结果显示,ORFV感染后36 h PGRN发生显著上调表达,该时间与ORFV激活OFTu细胞发生自噬的时间相一致,该结果提示,PGRN与ORFV诱导的OFTu细胞自噬存在关联。为进一步确认,本研究分别利用siRNA靶向干扰PGRN或者体外添加PGRN重组蛋白的方法对PGRN进行抑制表达或过表达,检测PGRN对自噬相关分子的影响,结果显示,抑制PGRN能够抑制LC3的型别转换,并使P62上调表达;体外添加PGRN重组蛋白则促进LC3Ⅰ向LC3Ⅱ的转换,P62表达下调。以上结果表明,PGRN参与对ORFV诱导的细胞自噬的调控。本研究进一步探讨了PGRN是否通过对ORFV诱导自噬水平的调控而影响病毒的复制,病毒噬斑试验结果显示,PGRN能够促进ORFV复制,且可逆转自噬抑制剂对病毒复制的抑制作用,该结果表明,PGRN能够通过调节ORFV激活的自噬影响病毒的复制。本研究结果不仅有利于明确PGRN对ORFV诱导自噬的调控作用,而且将为进一步揭示ORFV的致病机制奠定基础。

