基于CRISPR/Cas9技术创建甜菜BvCENH 3基因突变体的研究
韩平安 ,唐宽刚 ,常 悦 ,孙瑞芬 ,王 良 ,张自强 ,付增娟 ,赵尚敏 ,吴新荣 ,李晓东
(1.内蒙古自治区农牧业科学院,内蒙古呼和浩特 010031;2.内蒙古自治区甜菜品种遗传改良与种质创制重点实验室,内蒙古呼和浩特 010031)
食糖与粮、棉、油同属涉及国计民生的大宗农产品,它既是人民生活的必需品,也是我国农产品加工业,特别是食品和医药行业及下游产业的重要基础原料和国家重要的战略物资[1]。世界上约35%的食糖来源于甜菜[2],甜菜是我国两大糖料作物之一,是重要的特色经济作物。甜菜不仅是制糖业重要的基础原料,还是一种良好的饲料和潜在的能源作物[3]。甜菜为二年生异花授粉作物,采用常规育种方法获得纯合亲本的时间较长,育种速度缓慢,单倍体育种可以快速获得纯合体,获得的二倍体植株为纯合的双单倍体,大大缩短育种进程,提高育种效率。前期单倍体诱导技术主要为体外诱导[4]和体内诱导[5]。
基于着丝粒特异性组蛋白基因CENH3的改造是近年来建立单倍体诱导系的一个研究热点。CENH3是着丝粒特异的组蛋白H3突变体,CENH3基因参与着丝粒复合蛋白的募集和稳定,在着丝粒的组装及染色体的正常分离与传递中起着关键作用[6]。因CENH3对着丝粒区域的重要性,CENH3改变会导致染色体分离错误甚至产生致死效应[7]。拟南芥中CENH3低表达量抑制了有丝分裂,导致减数分裂时染色体的分离出现错误[8]。RAVI等[9]通过对拟南芥染色体着丝粒的突变体研究,开发出了通过着丝粒介导使亲本之一染色体选择性丢失,从而获得单倍体的方法。该研究发现,拟南芥CENH3-1的无效突变体具有致死性。通过修饰来改变CENH3可以挽救CENH3-1突变体的致死效应。一种是在CENH3的N端融合绿色荧光蛋白,成为GFP-CENH3;另一种是用组蛋白H3.3的N端代替CENH3的N端,并在N端融合GFP,成为GFP-CENH3 tailswap。将两种修饰的CENH3分别转入拟南芥CENH3致死突变体,转入后植株的野生表型均可恢复。通过转基因获得GFP-CENH3 tailswap纯合植株多数表现为雄性不育,作为母本与不同基因型的野生型植株杂交后能够产生25%~50%的父本单倍体,GFP-CENH3植株与野生型杂交,也能诱导单倍体,但频率低于GFP-CENH3 tailswap植株。玉米和芥菜用类似的方法修饰CENH3,并将修饰后的CENH3转入CENH3纯合致死突变体,也能得到单倍体植株[10-11]。KARIMIASHTIYANI等[12]研究表明,拟南芥CENH3的点突变就可以获得单倍体诱导系。
CRISPR/Cas9是一种重要基因组编辑工具,因CRISPR/Cas9系统设计简洁、靶位点选择灵活、构建简单且编辑效率高,使其迅速成为植物基因组编辑主要工具[13-15]。CRISPR/Cas9技术已成功在水稻[16]、小麦[17]、玉米[18]、棉花[19]等作物上得到了广泛的应用。利用基因组编辑手段,可以创造成单一亲本染色体消失的诱导系[20-22]。本研究以甜菜BvCENH3基因为目标基因,构建CRISPR/Cas9编辑载体,采用农杆菌介导法转化甜菜,对转基因植株进行初步分析,以期获得甜菜BvCENH3基因序列改变的突变体,同时通过进一步研究,建立可用于甜菜自交系培育的双单体生产体系,旨在为创建甜菜单倍体诱导系进而创制优良的甜菜新种质奠定理论基础并提供技术支撑。
1 材料和方法
1.1 试验材料
甜菜(Beta vulgaris L.)无菌苗、载体 pBWA(V)K和pBWA(V)-Cas9、EHA105农杆菌菌株由内蒙古自治区农牧业科学院甜菜分子育种课题组保存。引物设计通过Primer Premier 5.0完成,序列由南京金斯瑞公司合成,相关信息见表1。

表1 引物信息Table 1 Primer information
1.2 试验方法
1.2.1 sgRNA的设计与CRISPR/Cas9载体的构建
以甜菜BvCENH3基因(LOC104907459)为目标序列,根据靶标设计的原则[23]设计BvCENH3基因的2个特异性靶标序列,靶标1序列:CCACCTGCTTGCTGCTGCTCCCC,靶标 2序列:CCGCGCAGTTTGCAATCACCACA。同时设计扩增含2个靶标序列的sgRNA引物(F1/R1和 F2/R2,并引入Eco31Ⅰ酶切位点),序列见表1。将靶标1通过 T4连接酶连入中间载体 pBWA(V)-Cas9/BvCENH3-B1,靶标 2连入中间载体 pBWD/BvCENH3-B2。用LguⅠ酶切2个中间载体pBWA(V)-Cas9/BvCENH3-B1和 pBWD/BvCENH3-B2,并用T4连接酶进行连接,获得含有双靶标的重组载体命名为CRISPR-Cas9/BvCENH3。靶标反应条件,中间载体构建酶切连接反应体系、反应条件,双靶标载体构建酶切连接反应体系、反应条件均参照韩平安等[24]的方法进行。将双靶标重组载体CRISPR-Cas9/BvCENH3质粒转化大肠杆菌,待菌落出现后,用引物F3/R3进行PCR检测阳性克隆并测序。提取测序正确的阳性克隆质粒并采用冻融法导入农杆菌EHA105中。用特异性引物F3/R3进行菌液PCR检测。PCR 检测体系(20 μL):2×Mix 10 μL,上游引物 1 μL,下游引物 1 μL,ddH2O 7 μL,菌液 1 μL。PCR 扩增程序:95 ℃ 5 min;95 ℃ 30 s,60 ℃ 30 s,72℃ 2 min,30个循环;72℃ 10 min;4℃保存。扩增条带大小为1 250 bp。
1.2.2 甜菜的遗传转化
1.2.2.1 菌液的制备
挑取农杆菌单菌落于加有卡那霉素(Kan,100 mg/L)的YEB液体培养基中,28℃黑暗条件下,200 r/min振荡培养16~20 h后,将菌液置于离心管中,5 000 r/min离心5 min收集菌体,重新悬浮菌液,OD600值为 0.4~0.5,备用。
1.2.2.2 侵染和共培养
将在分化培养基(MS+6-BA 1 mg/L+水解酪蛋白200 mg/L+琼脂7 g/L,pH值为5.8,pH值下同)上预培养7 d左右的甜菜叶柄置于农杆菌菌液中,置于摇床上(100 r/min),28℃侵染20 min后,移除菌液,将叶柄接种在共培养基(MS+6-BA 1 mg/L+水解酪蛋白200 mg/L+AS 300 μmol/L+琼脂7 g/L)上,25℃暗培养3 d。
1.2.2.3 抗性筛选与植株再生
叶柄与农杆菌共培养3 d后,转移到含有Kan(50 mg/L)的筛选培养基(MS+6-BA 1 mg/L+水解酪蛋白200 mg/L+头孢霉素250 mg/L+Kan 50 mg/L+琼脂7 g/L)中培养,每隔7 d转接1次。当丛生芽长至0.5~1.0 cm时,将其从外植体上切下转入生根培养基(MS+NAA 1 mg/L+琼脂7 g/L)中诱导生根。
1.2.2.4 转基因植株PCR检测
剪取Kan抗性植株幼叶,利用高通量核酸提取仪(KingFisher Flex,Thermo Fisher)提取基因组 DNA,具体步骤按磁珠法植物DNA提取试剂盒说明书进行。以DNA为模板,用特异性引物F4/R4扩增抗性基因Kan进行阳性植株检测,扩增条带大小为500 bp,PCR反应体系和PCR反应程序同1.2.1。
1.2.2.5 突变检测
提取阳性植株的DNA样品进行二代测序。利用DNAMAN软件将测序结果与野生型甜菜BvCENH3序列进行比对分析,获得靶位点突变植株。
1.2.2.6 目的基因拷贝数检测
利用微滴式数字PCR(droplet digital PCR,ddPCR)技术,首先对BvCENH3基因的扩增引物F5/R5和内参基因GS的扩增引物F6/R6的特异性进行检测。之后用特异引物对突变体植株进行BvCENH3基因插入拷贝数检测。内参基因(GS)在甜菜中拷贝数为1。ddPCR扩增体系、扩增程序见韩平安等[25]的方法。每个样品进行3个平行重复试验。外源基因拷贝数的计算方法:外源基因拷贝数=外源基因浓度/内参基因浓度。
2 结果与分析
2.1 sgRNA双靶标CRISPR-Cas9/BvCENH3载体的构建
目的片段与载体连接后转化大肠杆菌,随机挑取9个单菌落进行PCR检测,获得1 250 bp片段,符合目的条带大小(图1)。将阳性克隆测序后与人工合成序列比对,证实获得序列完全正确。将测序正确质粒导入农杆菌中,获得目的条带(图2),证明编辑载体构建成功,为CRISPR-Cas9/BvCENH3。
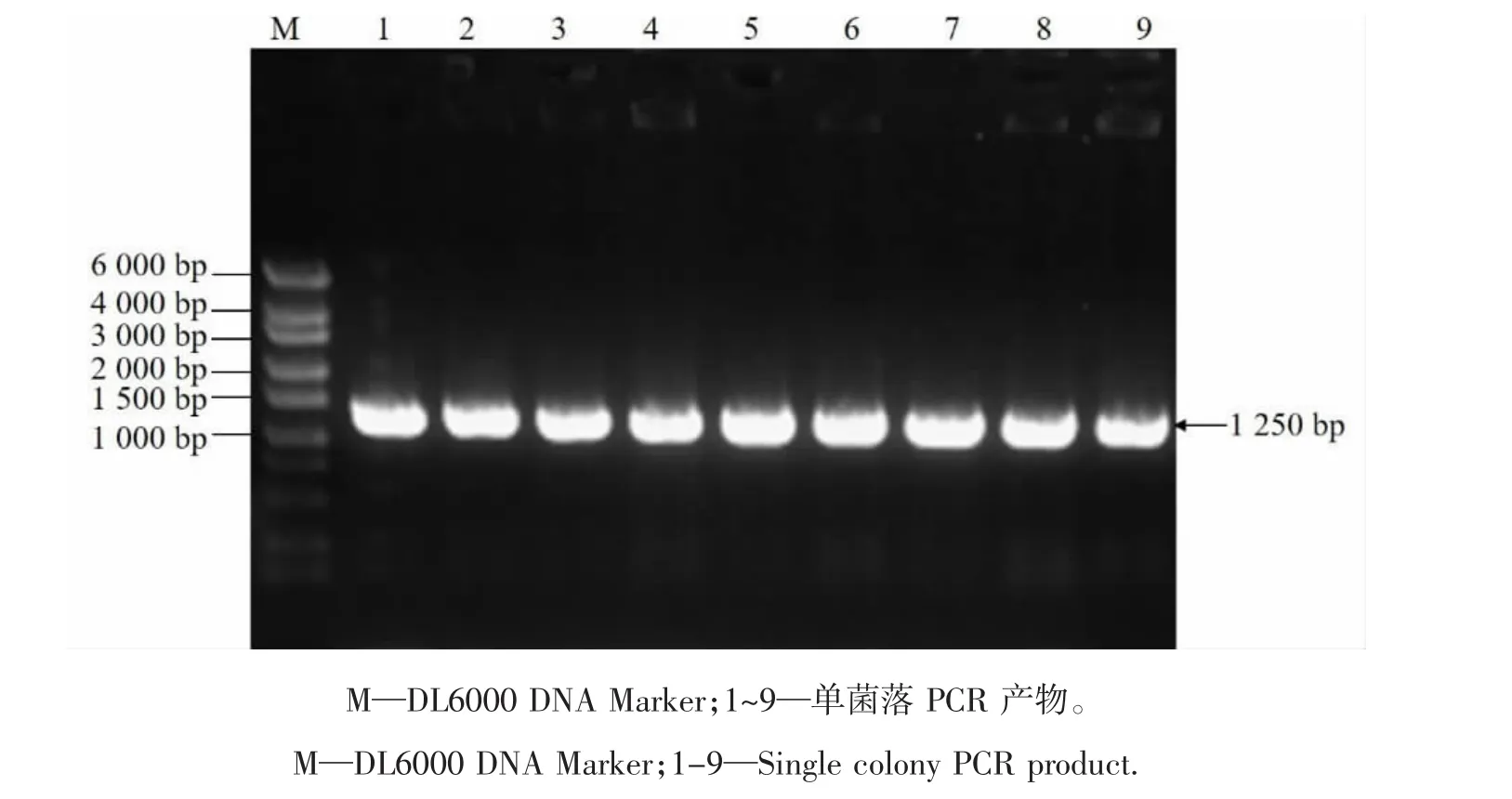
图1 sgRNA双靶标CRISPR-Cas9/BvCENH3载体大肠杆菌菌液扩增图谱Figure 1 Amplification of sgRNA dual-target CRISPR-Cas9/BvCENH 3 vector E.coli solution
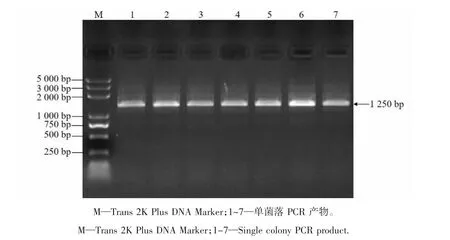
图2 sgRNA双靶标载体CRISPR-Cas9/BvCENH 3农杆菌菌液扩增图谱Figure 2 Amplification of the sgRNA dual-target vector CRISPR-Cas9/BvCENH3 agrobacterium solution
2.2 抗性植株的获得
采用农杆菌介导法转化甜菜叶柄,通过Kan(50 mg/L)筛选获得抗性丛生芽(图3),待根系长至2~3 cm时移栽至花盆。
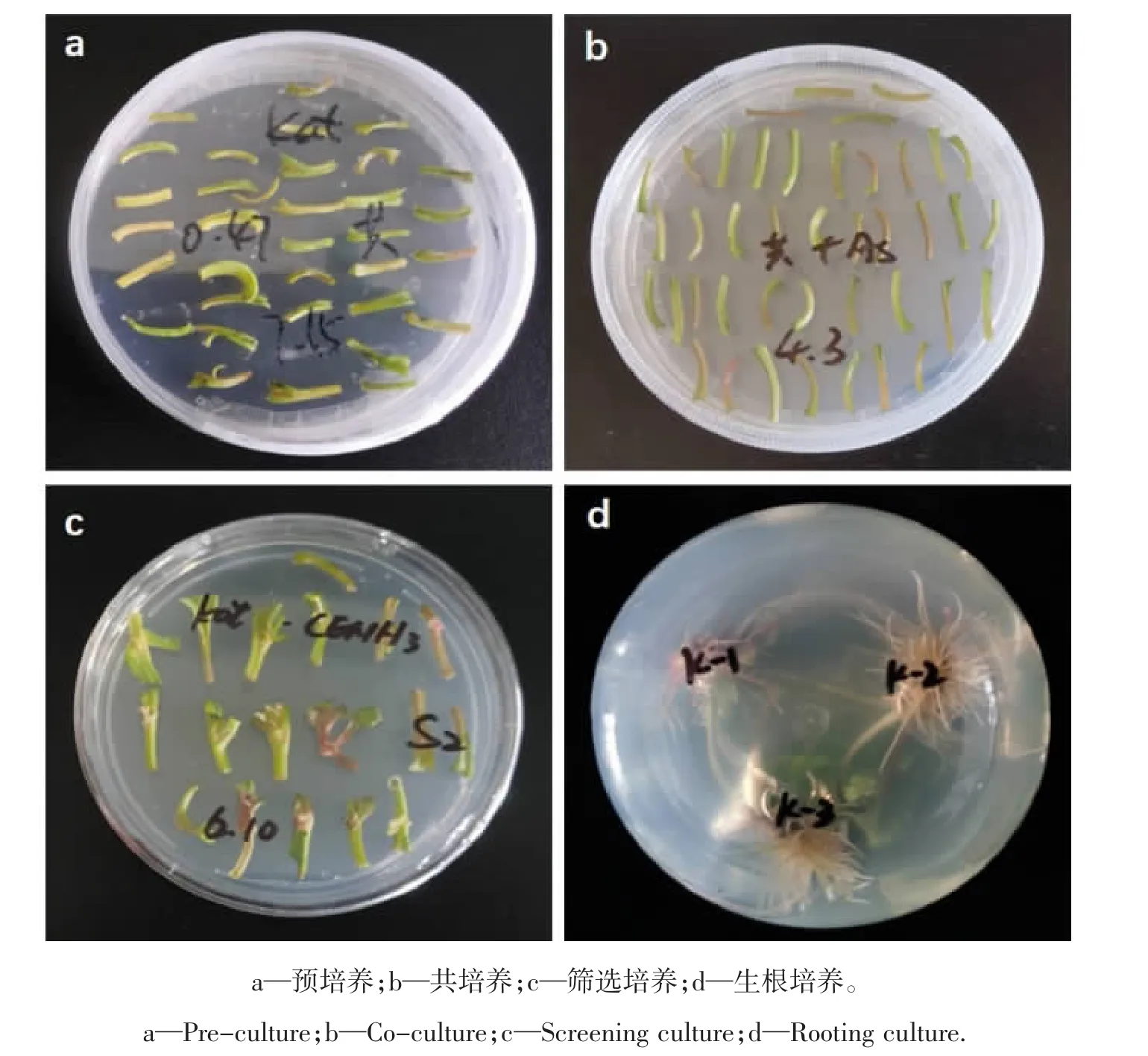
图3 甜菜的遗传转化Figure 3 Genetic transformation of sugar beet
2.3 转基因甜菜的PCR检测
将获得的抗性植株进行Kan抗性基因的PCR扩增,扩增产物经1%琼脂糖凝胶电泳检测,共有82株植株片段为500 bp,符合预期条带大小(图4),初步判断目的基因已整合到甜菜染色体基因组中,成功获得转基因植株。

图4 部分转基因甜菜植株的PCR检测Figure 4 PCR detection of some transgenic sugar beet plants
2.4 突变检测
将阳性植株的DNA样品进行二代测序。利用DNAMAN软件将测序结果与野生型甜菜BvCENH3基因进行序列比对分析,82个转基因株系中有40个被成功编辑,编辑效率为48.78%,突变类型有单碱基替换(T→G、A→C)、碱基缺失(TC、TCTC)等5种突变类型(表2)。突变类型1共有19个株系,其中第1条染色体的靶标1附近发生单碱基替换(A→C)、4个碱基(TCTC)缺失,第2条染色体靶标1上发生单碱基替换(T→G)、靶标1附近有单碱基替换(A→C)和4个碱基(TCTC)缺失。突变类型2共有6个株系,其中,第1条染色体靶标1附近发生单碱基替换(A→C)、2个碱基(TC)缺失,第 2条染色体在靶标1上发生单碱基替换(T→G)、靶标1附近发生单碱基替换(A→C)和4个碱基(TCTC)缺失。突变类型3共有11个株系,其中,第1条染色体靶标1附近发生单碱基替换(A→C)、4个碱基(TCTC)缺失,第2条染色体未发生突变。突变类型4有2个株系,其中,第1条染色体靶标1附近发生单碱基替换(A→C)、2个碱基(TC)缺失,第2条染色体靶标1附近发生单碱基替换(A→C)和4个碱基碱基(TCTC)缺失。突变类型5有2个株系,其中,第1条染色体未发生突变,第2条染色体在靶标2附近发生单碱基替换(A→C)。
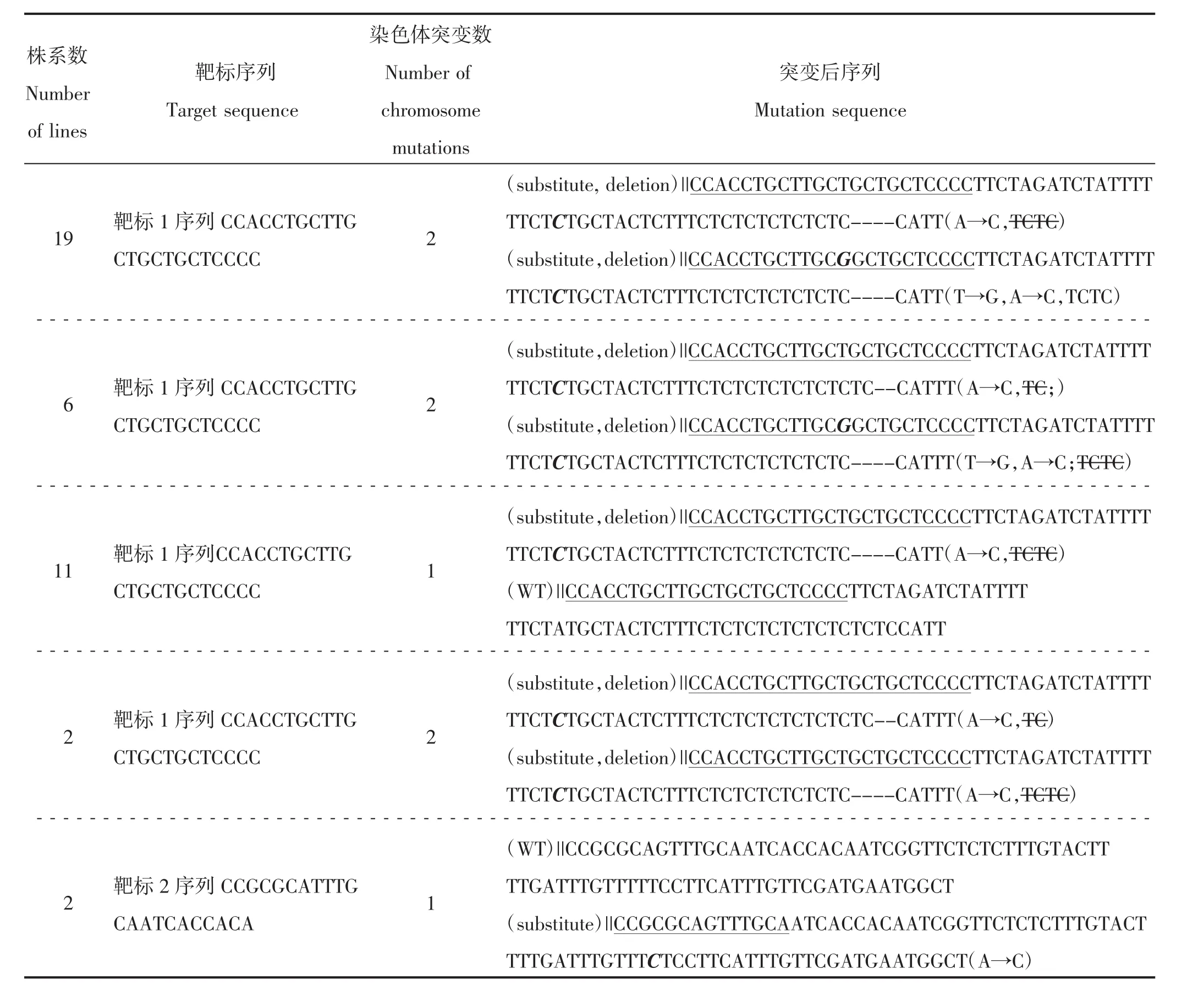
表2 转基因植株突变类型Table 2 Mutation types of transgenic plants
2.5 目的基因拷贝数检测
利用ddPCR技术对突变植株进行目的基因插入拷贝数检测。首先以甜菜GS为内参基因,对目的基因扩增引物的特异性进行检测。由图5可知,2个基因对应引物的阳性微滴(蓝色带)与阴性微滴(黑色带)都能明显区分开,表明目的基因引物的特异性较好。其次,对ddPCR的重复性进行分析,所有样品BvCENH3和GS基因的试验有效微滴总数均大于20 000(表3),满足微滴数字PCR微滴的分析要求,试验中生成微滴的相对标准偏差(relative standard deviation,RSD)介于 2%~5%(表 4),小于 25%,符合欧盟核酸定量检测的要求,说明试验中建立的微滴数字PCR体系微滴生成稳定,重复性良好,数据可靠性高。对40个转基因株系进行目的基因拷贝数分析,获得23个低拷贝株系,BvCENH3插入拷贝数为1.1~1.9(表 4)。
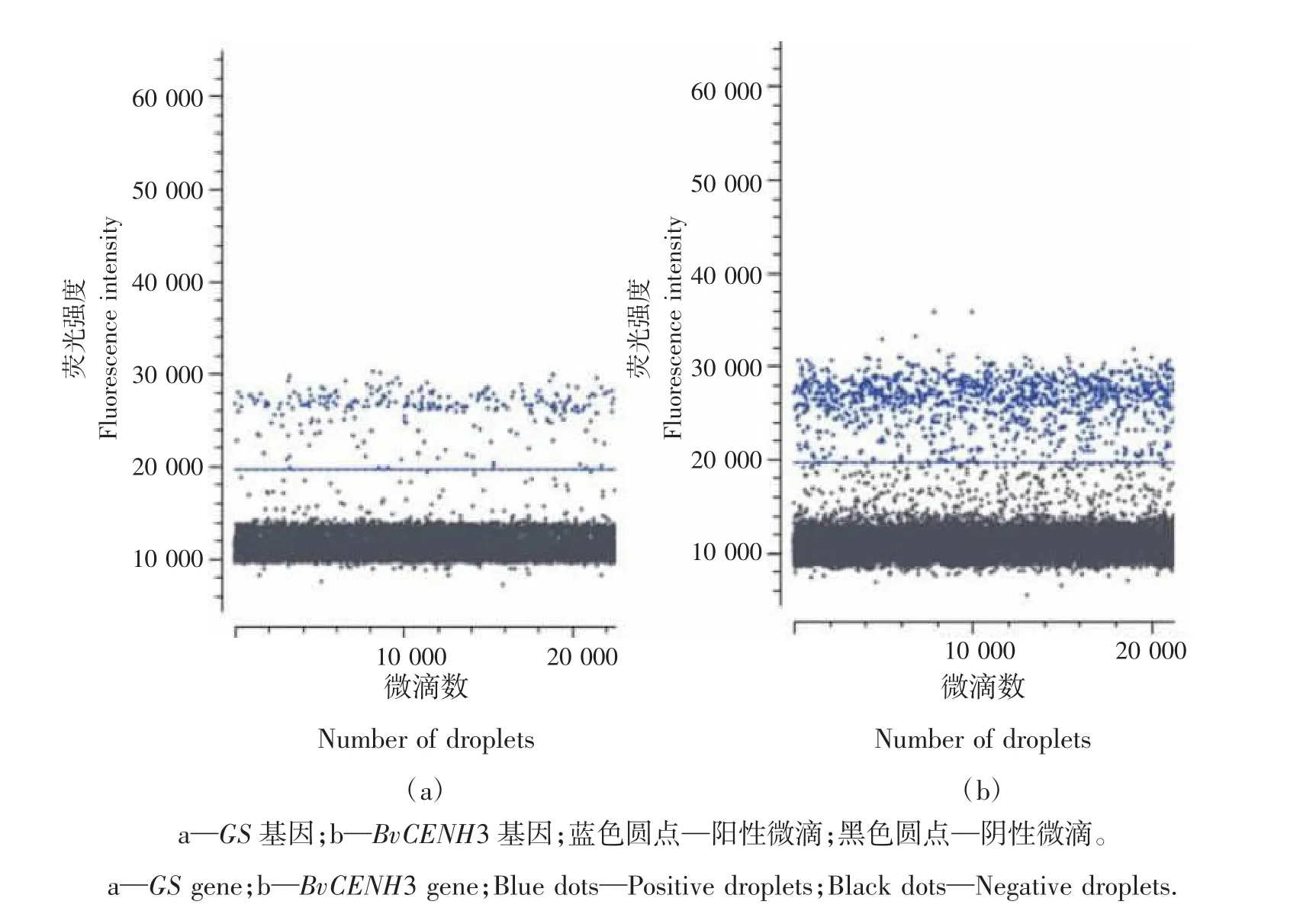
图5 ddPCR引物特异性检测Figure 5 ddPCR primer specificity test

表3 ddPCR重复性分析Table 3 Repeatability analysis of ddPCR
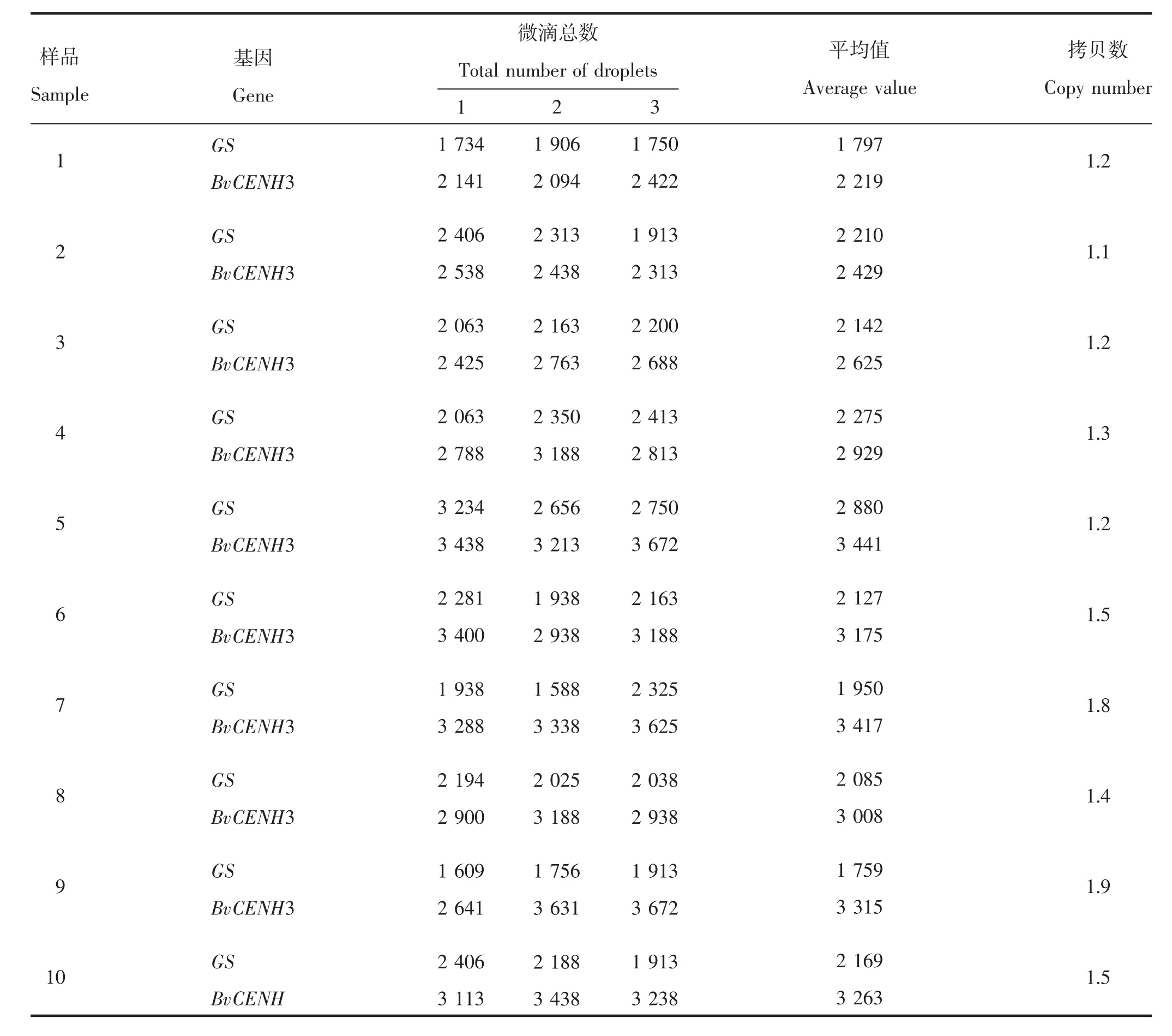
表4 部分转基因植株拷贝数分析Table 4 Copy number analysis of some transgenic plants
3 讨论与结论
CRISPR/Cas9技术凭借其精准、高效、设计简单等优势,以前所未有的速度和效率打破了传统育种的瓶颈,迅速成为生物学领域中的强大工具[26]。在水稻上,采用CRISPR/Cas9技术对3个(Bsr-d1、Pi21和ERF922)已知的稻瘟病抗性相关基因进行基因编辑研究,发现单基因突变体和3基因突变体的稻瘟病抗性均显著高于野生型品种[27]。在水稻研究中还发现,利用CRISPR/Cas9技术对早籼品种中早70敲除TMS5,获得了败育稳定的温敏不育系材料[28]。利用CRISPR/Cas9技术编辑小麦ARE1基因提高了小麦的氮素利用效率及田间产量[29]。此外,CRISPR/Cas9技术在玉米[30]、大豆[31]、油菜[32]等作物中均得到了较好应用。本研究采用CRISPR/Cas9技术对甜菜BvCENH3基因进行编辑,成功获得突变体,为甜菜单倍体育种提供了试验材料和理论基础。
着丝粒特异性组蛋白CENH3在细胞分裂中起重要作用,着丝粒功能的改变与染色体的消除有关,能够诱导单倍体植株的形成[33]。研究者开发出CENH3介导的单倍体育种技术,先后在拟南芥、玉米和小麦等作物得到成功应用。在拟南芥研究中发现,CENH3改变会导致合子发育过程中亲本染色体消除而产生单倍体[9]。在玉米研究中发现,CENH3突变体的杂交后代中有近0.86%的种子为单倍体[10]。通过基因编辑技术编辑小麦的着丝粒组蛋白TaCENH3α,筛选鉴定到小麦父本单倍体诱导系,其效率为7%,为CENH3单倍体诱导技术在多种作物中的应用铺平道路[34]。甜菜分子育种课题组前期采用CRISPR/Cas9技术对烟草CENH3基因进行编辑,获得6株突变植株[23]。本研究基于前期基础,利用CRISPR/Cas9技术对甜菜BvCENH3基因进行编辑,获得40株编辑植株,编辑效率为48.78%。本研究针对目标基因设计2个靶标,靶标1有4种突变类型,靶标2仅有1种突变类型,靶标1的编辑效率明显优于靶标2,说明同一基因不同靶标编辑效率不同,载体的编辑效率与靶标有较大的相关性[35]。因此,为确保目标基因的高效编辑,应设计2个及2个以上的靶标[36]。此外,甜菜分子育种课题组还构建了互补载体GFP-CENH3 tailswap且获得了转基因植株。后期会将以上两个载体的获得阳性植株进行杂交,同时进行表型鉴定与育性鉴定。
本研究采用CRISPR/Cas9基因组编辑技术,利用农杆菌介导法对甜菜叶柄进行遗传转化,获得82株转基因植株,其中40株被成功编辑,编辑效率为48.78%,靶标1效率优于靶标2;突变类型有单碱基替换(T→G、A→C)、碱基缺失(TC 、TCTC 缺失)等5种突变类型;筛选出23株低拷贝编辑植株,BvCENH3插入拷贝数为1.1~1.9。本研究初步创建了甜菜基因组编辑技术体系,为甜菜单倍育种奠定了理论与技术基础。

