Ca2+对3Cr 钢在CO2 环境中腐蚀行为的影响
张雅妮,邵英杰,张少刚,吉 楠,龙 岩,樊 冰,王思敏
(1.西安石油大学材料科学与工程学院,陕西 西安 710065;2.中国石油集团石油管工程技术研究院,陕西 西安 710077)
0 前 言
随着油气开发进入到高含水期,采出水中Ca2+、Cl-、细菌的含量越来越高,如中原油田和青海油田的矿化度已经高达1×105mg/L[1],对注采系统的安全运行构成了威胁。目前,关于Ca2+对管柱、管网的腐蚀行为研究的结论并不一致。关于Ca2+对于腐蚀速率的影响,有的研究认为Ca2+能提高腐蚀速率,有的研究认为Ca2+能降低腐蚀速率[2-10];关于Ca2+对点蚀的影响,有的研究认为Ca2+能引发点蚀,有的研究认为Ca2+能延缓点蚀[11-15]。这些研究得到了相互矛盾的结论的主要原因是研究过程中未明确瞬时饱和度,溶液水化学性质以及液体的流动等因素的影响。但各项研究中较为一致地认为Ca2+主要通过改变碳酸腐蚀产物层的结构和成分而影响材料的腐蚀速率。3Cr 钢作为一种低合金钢,具有良好的耐蚀性,这是由于Cr 元素在3Cr 钢腐蚀产物层中的富集会使膜层的致密性提高[16-19]。Wang等[6]对比分析了X65、3Cr、6.5Cr 钢在静态、80 ℃、总Cl-含量为27 740 mg/L、Ca2+含量在0~1 080 mg/L 范围内的条件下的腐蚀行为,结果显示随着溶液中Ca2+浓度的增加,3Cr 钢的腐蚀速率降低;Ca2+强化了3Cr 钢的伪钝化,降低了腐蚀产物膜的孔隙率。在实际工况环境中,管体内的液体处于流动状态,固/液界面的离子状态和静态条件下的不同,因此腐蚀产物层和腐蚀形式也存在差异。
本工作采用高压釜模拟井下高温高压流体环境,分析了Ca2+浓度和腐蚀时间对3Cr 钢腐蚀行为的影响。采用SEM、XRD 对试样表面的腐蚀产物进行了分析,采用电化学工作站分析了Ca2+浓度对3Cr 钢腐蚀行为的影响机理。
1 试 验
1.1 试验材料
采用ARL4460 型直流光谱仪测试试验所用材料3Cr 钢的化学组成,结果见表1。

表1 3Cr 钢的化学组成Table 1 Chemical composition of 3Cr steel
1.2 高温高压试验
试片尺寸为50 mm×10 mm×3 mm,如图1 所示。依次用600,800,1 000,1 200,1 500 号砂纸打磨试片,打磨后的试片表面光亮,光滑,平整,无任何刮痕或小点,打磨后的试片的表面粗糙度Ra为0.63~1.25 μm。

图1 试样尺寸示意图Fig.1 Schematic diagram of sample size
采用C276 型高温高压釜对3Cr 钢进行高温高压腐蚀试验。采用JEOL-6390A 型扫描电镜(SEM)观察腐蚀产物的形貌,采用XRD-6000 型X 射线衍射仪(XRD)分析腐蚀产物层的物相组成。3Cr 钢高温高压腐蚀试验参数如表2 所示。
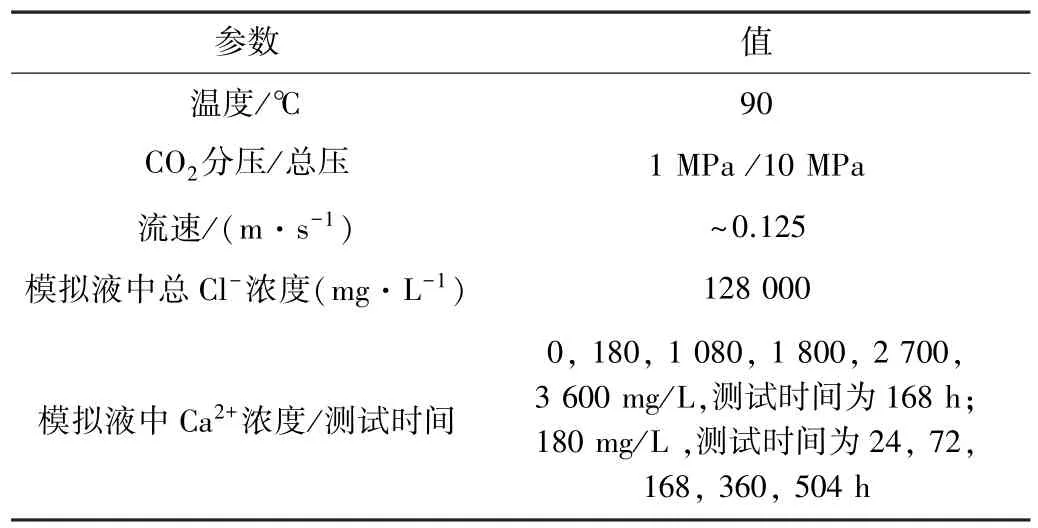
表2 3Cr 钢高温高压腐蚀试验参数Table 2 High temperature and high pressure corrosion test parameters of 3Cr steel
高温高压试验流程如下:在釜中放置夹持有试样的试样架,缓缓注入800 mL 的NaCl+CaCl2溶液(NaCl、CaCl2试剂均为分析纯级别),最终使溶液面高出试样顶端2~3 cm,以保证在整个试验过程中试样所有表面均浸没于溶液中。放置好试样后,密封加盖,通入高纯N2除氧12 h 后,升温至预定温度,通入CO2和N2至预定压力,开始试验。试验结束后采用蒸馏水缓慢冲洗试样,以去除试样表面残余的腐蚀介质。再用无水酒精冲洗试样后晾干,置于干燥器中以待分析产物。
去除试样表面腐蚀产物的方法如下:将试样放置于清洗液[10%(体积分数,下同)HCl+90%H2O+5 g/L C6H12N4]中剧烈搅拌至腐蚀产物完全除净。清洗后的试样立即用自来水进行冲洗,再在过饱和的碳酸氢钠溶液中浸泡3~5 min 进行中和处理,然后用自来水冲洗并用滤纸吸干残余水分,置于无水酒精中浸泡3 ~5 min,冷风吹干试样表面残余酒精,置于干燥器中24 h后称重,采用空白试样校正清洗过程中的质量损失。
1.3 电化学试验
采用PARSTAT2273 型电化学工作站测试3Cr 钢在含不同Ca2+浓度的NaCl+CaCl2溶液(NaCl、CaCl2试剂均为分析纯级别,保持溶液总Cl-浓度不变)中的电化学行为。使用2 组溶液进行对比试验。一组溶液在试验前仅通入高纯N2除氧3 h,一组溶液通入高纯N2除氧3 h,再通入CO23 h,形成CO2饱和态。测试体系为三电极体系,辅助电极为石墨电极,参比电极为饱和甘汞电极,工作电极为10 mm×10 mm×6 mm 的块状3Cr 钢试样,电极底部用纯铜导线焊接引出,然后用环氧树脂封住3Cr 钢试样,只留研究面(10 mm×10 mm)暴露在外,采用机械抛光尽量去除研究面的表面缺陷,之后用蒸馏水和丙酮清洗,放置于干燥器中24 h 后待用。
1.4 数据处理
采用失重法按照式(1)计算平均腐蚀速率:
式中:vcorr为试样的平均腐蚀速率,mm/a;W1为试样腐蚀前的质量,g;W2为试样腐蚀后的质量,g;S为试样表面积,cm2;t为试验时间,h;ρ为试样材质密度,g/cm2。
2 试验结果
2.1 Ca2+浓度对3Cr 钢腐蚀行为的影响
图2 所示为Ca2+浓度对3Cr 钢在高Cl-(128 000 mg/L)环境中平均失重速率的影响。
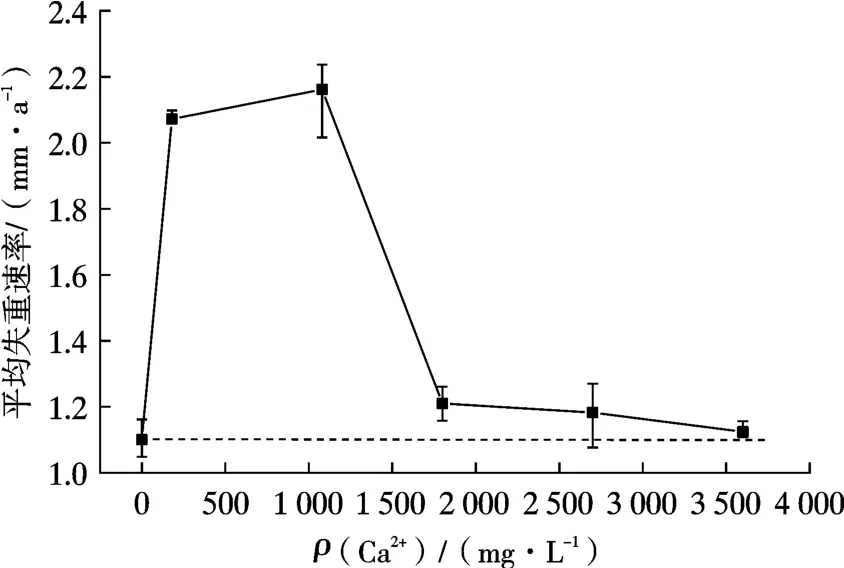
图2 Ca2+浓度对3Cr 钢失重速率的影响Fig.2 Effect of Ca2+concentration on weight loss rate of 3Cr steel
由图2 可见,Ca2+的添加提高了材料的失重速率;在Ca2+浓度较低时[ρ(Ca2+)=180,1 080 mg/L],3Cr钢的失重速率较高,超过2 mm/a;当Ca2+浓度高于1 800 mg/L 时,失重速率急剧降低,基本保持在1.2 mm/a 以下。
图3 为以P110 钢作为对比,Ca2+浓度对3Cr 钢腐蚀产物形貌的影响。在未添加Ca2+的溶液环境中,P110 钢试样表面FeCO3颗粒呈不完整状紧密堆积在试样表面;3Cr 钢试样表面的腐蚀产物表现为双层结构:底部完整覆盖的片层状和上部零散分布的颗粒状。当Ca2+浓度为180 mg/L 和1 080 mg/L 时,试样表面腐蚀产物膜层起翘脱落。从破碎后的膜片分布情况可以看出,膜层的起翘脱落为膜层生长所致,非产物脱水所致。表3 为图3 中选区EDS 元素分析结果。表3 显示3Cr 钢试样底层产物主要由C、O、Fe、Cr 元素组成,部分3Cr 钢试样底层产物区域含Cr 高达13.88%;顶层的颗粒状产物主要由C、O、Fe 元素组成。为进一步明确产物中Ca2+和Cr 元素的赋存方式,以无Ca2+环境为对比,选取未添加、低浓度Ca2+环境(180 mg/L)和平均失重速率开始下降环境(1 800 mg/L)中的腐蚀产物进行XRD 分析,结果如图4 所示。试样表面产物由FeCO3和Fe3C 2 种物相组成,在2θ=35°处附近有非晶峰(图4 中方框所标识的较宽的峰)出现,对应为Cr 的非晶产物。

图3 以P110 钢作为对比,Ca2+浓度对3Cr 钢腐蚀产物形貌的影响Fig.3 Effect of Ca2+concentration on the morphologies of corrosion products of 3Cr steel compared to P110 steel
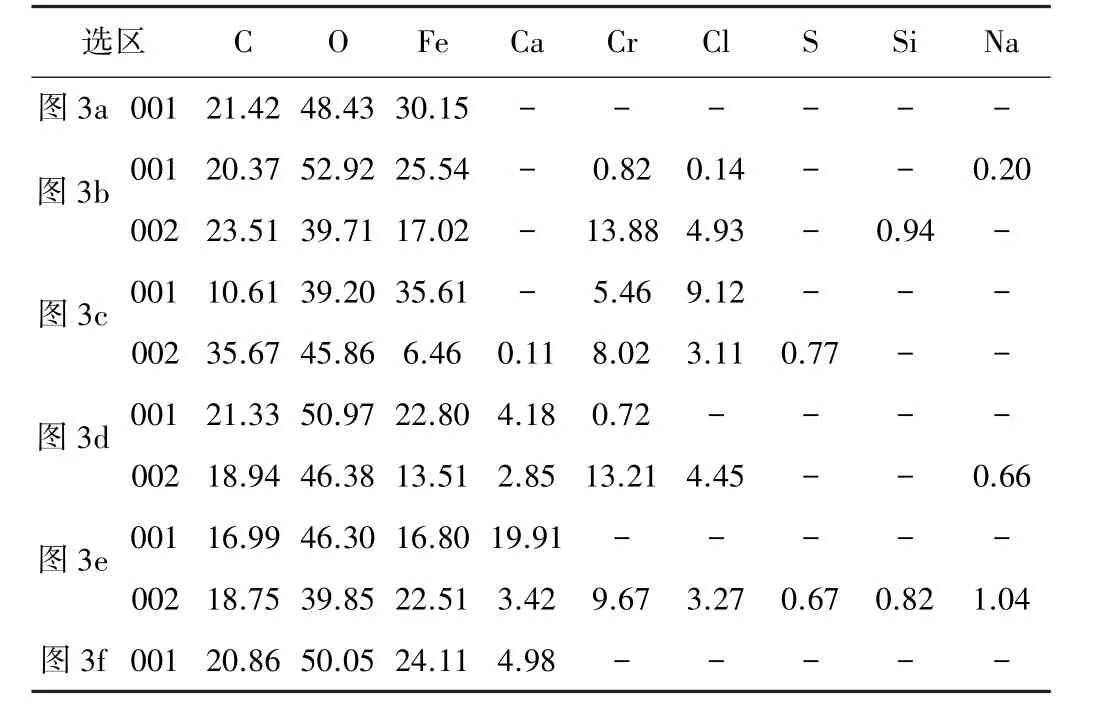
表3 图3 中选区EDS 元素分析结果(原子分数) %Table 3 EDS element analysis results for selected areas in Fig.3(atomic fraction) %
结合图3、4 和表3 对膜层中的Ca、Cr 元素进行分析。随着溶液中Ca2+浓度的增加,扇柱形FeCO3颗粒逐渐向球形CaxFe1-xCO3(0<x<1)颗粒转变。当溶液中Ca2+的 浓 度 较 高 时[ρ(Ca2+) ≥1 800 mg/L],CaxFe1-xCO3向纺锤形CaCO3转变,且纺锤形颗粒在试样表面的沉积量随溶液中Ca2+浓度的增加而增加。底层腐蚀产物膜层中Ca 元素含量并未随着溶液中Ca2+浓度的增加而明显增加,基本保持在3%~5%(原子分数)之间。少量的Ca2+对试样表面产物中Cr 元素的影响不大,当Ca2+的浓度高于1 800 mg/L 时,产物中的Cr元素含量有所降低。
点蚀对管柱的服役寿命影响较大。采用SEM 对部分腐蚀后试样的表面形貌进行观察,结果如图5 所示。在Ca2+浓度较低(1 080 mg/L)时,试样表面腐蚀严重,有腐蚀形成的沟槽,未出现明显蚀坑。当Ca2+浓度增至1 800 mg/L 时,试样表面局部区域有蚀坑形成,蚀坑直径约为17~20 μm,深度10 μm。
2.2 腐蚀时间对3Cr 钢在含Ca2+溶液中腐蚀行为的影响
图6 是3Cr 钢在含180 mg/L Ca2+溶液中的平均失重速率随时间的变化曲线。由图6 可知,腐蚀早期平均失重速率较低,随着腐蚀时间的延长,试样的平均失重速率增加,当腐蚀时间为240 h 时,试样的平均失重速率达到最大。后期,试样的平均失重速率有所降低。失重速率的变化与试样表面膜层的结构、组成和厚度的改变密切相关。选取暴露初期和暴露末期试样表面的产物进行SEM 观察和EDS 线扫描,结果如图7 和图8 所示。表4 为图7 中选区的EDS 元素分析结果。由图8 可知,暴露初期,试样表面产物膜层极薄,腐蚀72 h时,试样表面产物膜层的平均厚度约为4 ~5 μm。随着FeCO3在试样表面沉降量的增加,产物膜层增厚,腐蚀至168 h 时膜层的平均厚度约为40 μm。腐蚀至504 h 时膜层厚度变化不大,但扇柱形FeCO3在试样表面膜层的覆盖量显著增加。EDS 线扫描结果显示Ca 元素多分布于腐蚀产物靠近基体侧,Cr 元素多分布于产物靠溶液侧,且Ca 元素在腐蚀产物中的分布并不均匀。
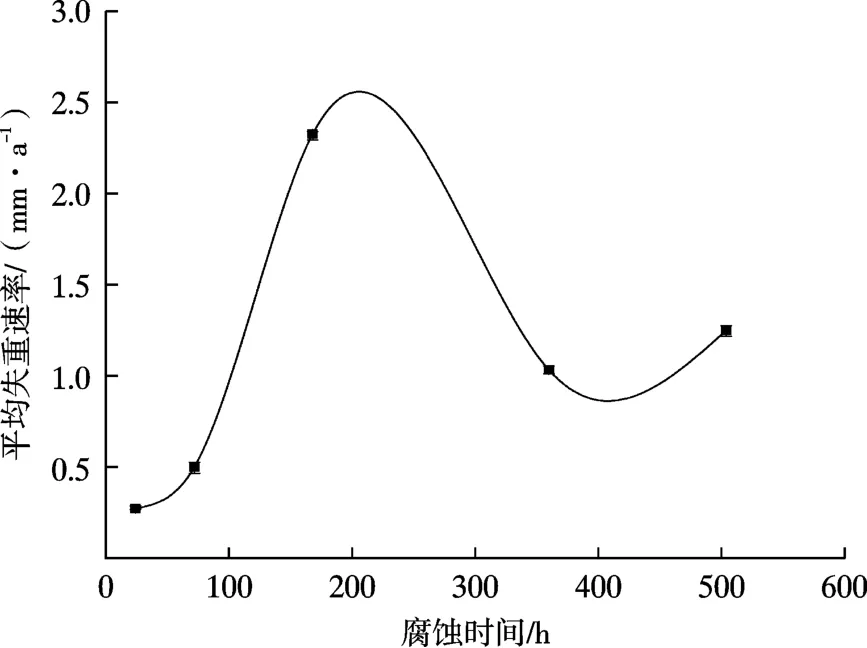
图6 3Cr 钢在含180 mg/L Ca2+溶液中的平均失重速率随时间的变化曲线Fig.6 Time dependent curve of average weight loss rate of 3Cr steel inthe solution containing 180 mg/L Ca2+

图7 不同腐蚀时间下3Cr 钢腐蚀产物的SEM 形貌Fig.7 SEM morphologies of corrosion products of 3Cr steel at different corrosion times

图8 不同腐蚀时间下3Cr 钢腐蚀产物截面的形貌及EDS 线扫描结果Fig.8 Cross section morphologies and EDS line scanning results of corrosion products of 3Cr steel at different corrosion times
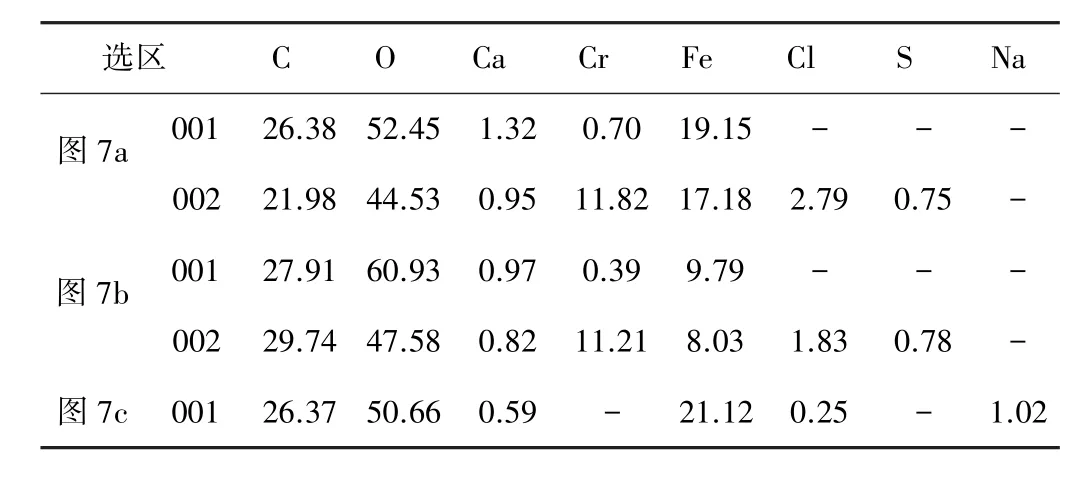
表4 图7 中选区的EDS 元素分析结果Table 4 EDS element analysis results for selected areas in Fig.7
3 讨 论
3.1 Ca2+的存在对溶液性质及金属/溶液界面反应速率的影响
采用PHS-25 酸度计对常温常压下研究溶液的pH值进行测量,结果如表5 所示。未添加Ca2+的溶液在通入CO2前为单一的NaCl 溶液,理论pH 值应为7,实际测量值远低于7,这是由于采用的分析纯NaCl 含有少量杂质。溶液中NaCl 含量越低,杂质对溶液pH 值的影响就越弱。在通入CO2后,溶液的pH 值显著降低,含Ca2+溶液的pH 值较不含Ca2+溶液的pH 值略有降低,说明Ca2+的存在会促进溶液的酸化,具体反应见式(2)~(5):
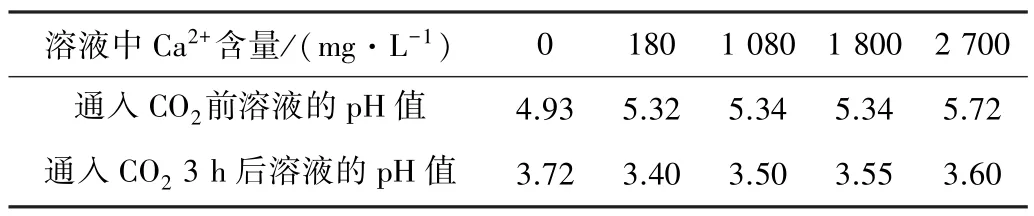
表5 溶液的pH 值测试结果Table 5 Test results of pH value of solution
溶液中Ca2+的存在促使反应(2)和(3)的进行,使溶液的pH 值降低。
采用电化学试验分析Ca2+的存在对金属/溶液界面反应速率的影响。将打磨好的电化学试样放入待测溶液中除膜15 min 后进行动电位极化曲线测试,测试结果见图9,极化曲线拟合结果见表6。由于仅通入高纯N2除氧的溶液,溶液中的阴离子只有Cl-和水电离产生的OH-。由表6 可见,相比未添加Ca2+的NaCl 溶液,少量Ca2+的添加对体系自腐蚀电位值的影响不大,但当Ca2+浓度高于1 080 mg/L 时,体系的自腐蚀电位显著降低。高浓度的Ca2+使Fe 在Cl-H2O 体系中的腐蚀趋势增大,但对腐蚀电流密度的影响不大。通入CO2后,3Cr 的腐蚀电流密度较未通入CO2时的上升了1~2 个数量级,同时Ca2+的添加也显著增加了金属的腐蚀电流密度。Ca2+浓度的变化对腐蚀体系的影响因CO2的通入而减弱。
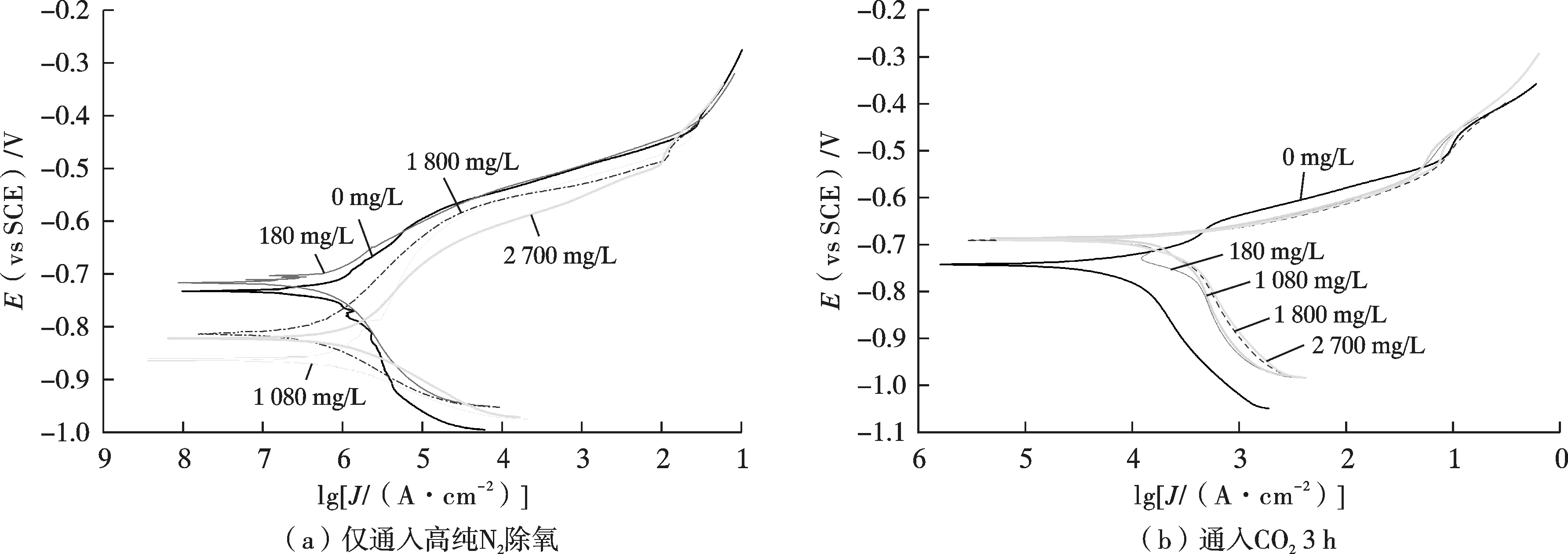
图9 不同体系中3Cr 试样的极化曲线Fig.9 Polarization curves of 3Cr samples in different systems
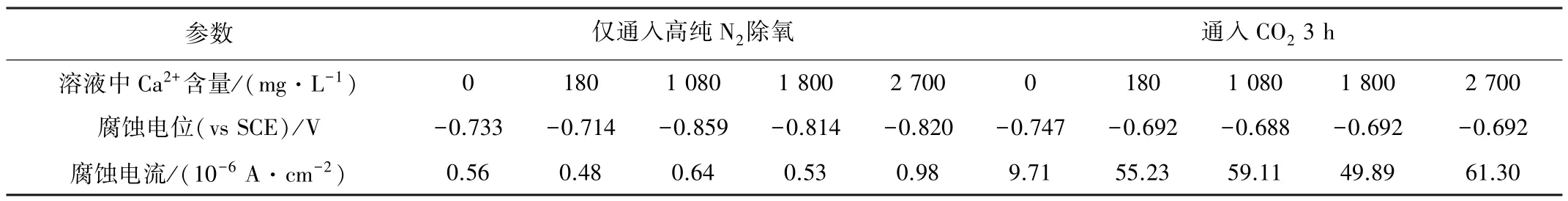
表6 极化曲线拟合结果Table 6 Polarization curve fitting results
3.2 Ca2+的存在对3Cr 钢腐蚀行为的影响
当将3Cr 钢放入通入CO2的无Ca2+的溶液中时,试样表面会发生式(6)、(7)所示反应:
相对于Fe 而言,Cr 的溶解电位较低,在溶液中优先发生腐蚀。对于测试溶液,其中的阴离子主要包括Cl-,CO32-以及水电离形成的OH-,3Cr 钢中的Fe、Cr 元素在产物中将以FeCO3和Cr(OH)3的形式存在,反应式见式(8)、(9):
试验过程中溶液流速约为0.125 m/s,较高的流速会加速试样表面离子的交换,降低试样表面水化膜层的厚度。由Cr 元素生成的Cr(OH)3会被溶液裹挟离开试样表面,进入溶液。随着FeCO3在试样表面的沉积,在FeCO3膜层的松散或堆积不完整的区域,溶液的流态将受到影响,Cr(OH)3可能会在这些区域发生沉积。在Cr(OH)3的沉积区,FeCO3因局部溶液酸化发生溶解,基体表面露出,腐蚀加速,从而形成局部腐蚀特征明显的均匀腐蚀。
当将3Cr 钢放入通入CO2的含有Ca2+的溶液中时,CO2的通入会导致腐蚀溶液中有CaCO3生成。CaCO3的存在会对试样表面生成物FeCO3的沉积产生影响。按照分子运动论,如果2 个粒子间要发生反应,则必须碰撞,因此一个反应的反应速率与单位体积单位时间内的发生反应的粒子之间的碰撞数成正比,即单位体积单位时间内的碰撞数与发生反应的粒子浓度的乘积成正比,因此反应物的消耗速度与粒子浓度乘积成正比。
沉积物CaCO3的生成反应属一级反应。对应的速率方程可描述为:

沉积物FeCO3的生成反应属多级反应。最简化的二级反应如下:
对应的速率方程可描述为:
其中vFeCO3为FeCO3的形成速率;K1,K2为中间反应过程(11)和(12)的反应速率常数;CFe2+为Fe2+的浓度。
当将3Cr 钢放入通入CO2的含有Ca2+的溶液中时,如式(10)和(13),由于早期溶液中Ca2+具有较高的浓度,vCaCO3比vFeCO3高,CaCO3会优先沉积于试样表面。在流体的冲刷作用下,CaCO3膜层存在局部脱附、破裂、剥落、再沉积的动态过程。在剥落或裂隙处,在Cl-的作用下,金属基体加速溶解。随后在CaCO3和FeCO3的共沉积阶段,由于CaCO3和FeCO3具有类似的六方晶格构造,在CaCO3和FeCO3的沉积过程中,会发生Ca2+/Fe2+的相互置换,形成FexCa1-xCO3化合物。如图3,当溶液中Ca2+的含量极低时可形成扇柱形的FeCO3,当溶液中Ca2+的含量较高时可形成纺锤形和尖锥形的CaCO3。当将3Cr 钢放入通入CO2的含有Ca2+的溶液中时,3Cr 钢表面形成FexCa1-xCO3化合物,Fe/Ca 之间并无严格的比例,产物形态取决于溶液中的Ca2+含量。
金属的腐蚀速率由金属/溶液界面处的电化学反应速率和膜层性质共同决定。由图2 和图9 可知,3Cr 钢在含Ca2+溶液中的失重速率比在不含Ca2+溶液中高,Ca2+的添加显著增加了金属/溶液界面的腐蚀速率,同时Ca2+的添加所导致的溶液pH 值的降低也不利于FeCO3在试样表面的沉积,形成致密有效膜层的难度增大。
Ca2+浓度的变化对早期裸露金属表面的腐蚀速率的影响不大,更多是对后期膜层的影响。当溶液中Ca2+浓度较低时(180 mg/L 和1 080 mg/L),优先沉积的极薄CaCO3层不能有效阻碍腐蚀的进一步进行,同时也不利于FeCO3或FexCa1-xCO3在试样表面的有效吸附。腐蚀至72 h 时,试样表面的产物膜层的平均厚度约为4~5 μm。这层由非晶Cr 化合物、FeCO3和Fe3C所组成的极薄膜层与基体的结合力较弱,在流体的冲击下易于脱落。同时较低的vFeCO3和vCaCO3也使新膜层的形成速率较低,因此不能及时修复膜层破损的区域,导致3Cr 钢在Ca2+浓度相对较低时具有较高的失重速率。当溶液中Ca2+的含量较高时(2 700 mg/L),体系中CaCO3含量的增加使得试样表面CaCO3的附着量增加,松散的CaCO3膜层并不能有效阻碍离子的进出,在Cl-的协同作用下,为点蚀的形成提供了条件。同时CaCO3的大量附着也促进了FexCa1-xCO3的形成,其中以Fe 元素置换CaCO3晶体中的Ca 元素为主,形成尖锥形的FexCa1-xCO3产物,覆盖在试样表面,降低了试样表面的有效腐蚀面积,使试样的平均失重速率降低。
4 结 论
本工作以3Cr 钢为研究对象,采用高温高压釜模拟井下流态环境,分析了Ca2+浓度和暴露时间对3Cr钢腐蚀行为的影响,得出以下结论:
(1)Ca2+的存在促使溶液酸化,加速金属/溶液界面的反应速率,但3Cr 钢在含Ca2+溶液中的腐蚀速率更多取决于试样表面膜层的结构;
(2)当溶液中总Cl-浓度为128 000 mg/L,Ca2+浓度在0~3 600 mg/L 的范围内时,3Cr 钢在Ca2+浓度为1 080 mg/L 时平均失重速率最大,为2.2 mm/a;
(3)在Ca2+含量为180 mg/L 的环境中,3Cr 钢的失重速率曲线显示3Cr 钢的失重速率随时间呈反“V”变化趋势,当腐蚀时间为240 h 时,试样的平均失重速率达到最大值;
(4)当将3Cr 钢放入通入CO2的含有Ca2+的溶液中时,3Cr 钢表面形成FexCa1-xCO3化合物,Fe/Ca 之间并无严格的比例,产物形态取决于溶液中的Ca2+含量。

