Nrf2与p53/p21信号通路在肿瘤中作用的研究进展
张高山,蒋青青,陈 敏,罗 琳
0 引言
随着全球老龄化的加剧,恶性肿瘤的社会经济负担也在逐年增加[1]。2020年全球新发癌症病例数约为19 292 789例[2]。肿瘤细胞的主要特征是增殖不受控制、对凋亡有抵抗、转移、逃避免疫监视等[3]。由活性氧(Reactive oxygen species,ROS)引起的高水平氧化应激也是癌细胞的主要特征之一[4]。Keap1 (Kelch-like ECH associated protein)/Nrf2 (NFE2 p45-related factor 2)/ARE (Antioxidant response element,抗氧化反应元件)信号通路在保护细胞免受氧化应激损伤中起着核心作用,是细胞抵抗氧化性损伤的主要途径之一[5],且被认为是细胞存活的主要防御机制和调节因子[6]。Nrf2可以通过结合Notch1启动子区的ARE序列和p53抑制剂MDM2(Mouse double minute 2)而诱导恶性肿瘤[7]。p21作为p53直接调控的靶基因,其抗细胞凋亡功能与致癌特性有关。研究发现,上调p53及其靶蛋白p21的表达能增加Nrf2和p53之间的相互作用,而p53和p21的敲除则降低了抗氧化和凋亡因子的表达水平[8],可能会稳定Nrf2的表达。但Nrf2与p53/p21在肿瘤中的作用有待深入研究[8-10],本文就Nrf2与p53/p21信号通路之间相互调控作用进行综述。
1 Keap1/Nrf2/ARE信号通路
1.1 Nrf2结构与调控 Nrf2/Keap1通路是一种遗传防御系统,提供对多种应激源的保护,包括氧化应激和化学应激[5]。Nrf2属于碱性区域亮氨酸拉链转录因子的帽“n”环亚家族[5],其拥有7个保守的Nrf2-ECH同源(Neh)结构域(见图1),它们具有不同的功能。Neh1结构域中包含碱性亮氨酸链(Basic leucine zipper,bZip)与小分子肌腱纤维瘤蛋白(Muscle aponeurotic fibrosarcoma protein,Maf)[11];Neh2结构域包含2个ETGE和DLG基序,它们特异性结合Keap1的结构域,介导Nrf2泛素化和降解[11];C末端Neh3结构域是转录激活结构域[10];Neh4和Neh5可通过与cAMP反应元件结合蛋白(cAMP response element binding protein,CREB)相互作用支持转录激活,该蛋白具有组蛋白乙酰转移酶活性[10];Neh6结构域富含丝氨酸残基,并包含2个β-转导素重复序列包含蛋白(β-TrCP) DSGIS和DSAPGS,参与Nrf2降解[12-13];Neh7结构域与视黄酸X受体α (Retinoid X receptor α,RXRα)相互作用,抑制Nrf2的细胞保护活性[14]。
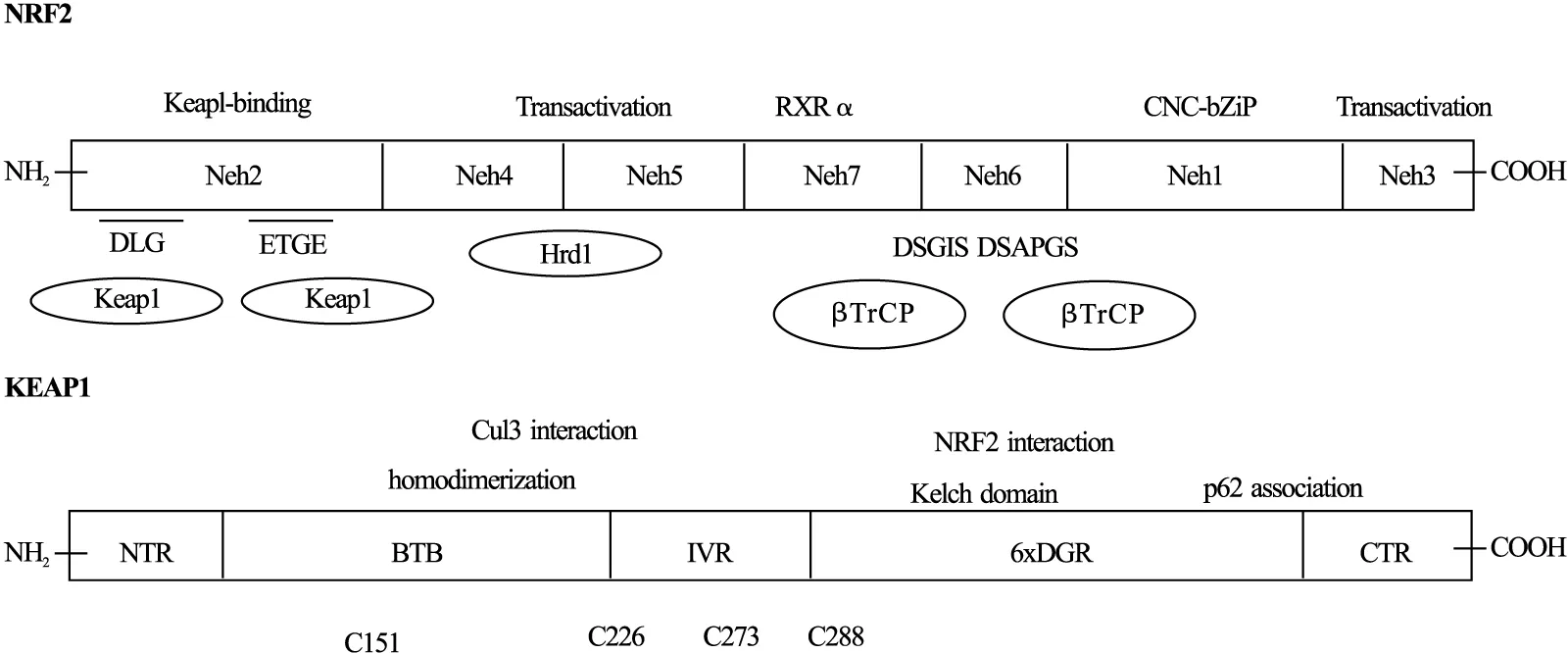
图1 Nrf2、Keap1结构示意图
正常生理条件下,Nrf2与富含半胱氨酸的蛋白Keap 1结合,通过清选蛋白3(Cullin 3,CUL3)的E3连接酶促进其泛素化,并通过泛素-蛋白酶体途径促进其降解[15-16]。然而,当受到氧化作用产生应激时,Keap1的活性半胱氨酸残基就会被修饰,Nrf2从Keap1释放,并进一步转移到细胞核,通过与靶基因调控区的ARE结合,触发细胞的细胞保护[15-16]。
Nrf2/Keap1通路调控多种细胞保护和解毒酶的基因表达,在维持氧化还原细胞内稳态方面发挥重要作用[17]。事实上,Nrf2的靶基因通过激活和产生不同的蛋白质、酶和谷胱甘肽、调节药物转运以及代谢基因和转录因子的活性而参与抗氧化活性[18]。因此,Nrf2激活剂和抑制剂可用于治疗多种疾病。
1.2 Nrf2与肿瘤的关系 癌变过程的3个主要阶段包括:起始、促进和发展[19]。氧化应激在癌症发生和发展中均具有关键作用[20-21]。氧化应激产生的水平以及持续的时间可能导致肿瘤的形成或严重的细胞损伤和细胞死亡[22]。Nrf2/Keap1信号通路是调节氧化应激的关键分子[5],因此,目前干扰Keap1/Nrf2/ARE通路已经成为一种潜在的预防和治疗癌症的策略[23]。研究表明,在较低的稳态水平下,Nrf2能消除ROS、致癌物和其他DNA损伤剂,从而抑制肿瘤的发生和转移[24]。但Nrf2/Keap1信号通路的激活并非对所有肿瘤都是有利的[20]。在不同类型的癌症中,Nrf2活性的增加可能有助于恶性肿瘤细胞抵御过度的氧化应激、化疗药物和放射治疗,其机制可能与体细胞突变、Keap1与Nrf2的结合中断、癌细胞中Nrf2过度激活有关[16,25-26]。此外,Nrf2还通过激活促进增殖相关的细胞保护基因来避免肿瘤细胞凋亡[27]。因此,研究与Nrf2相关的抗肿瘤药物时,必须慎重考虑Nrf2在癌症中的双重作用[23]。
1.3 p53/p21信号通路
1.3.1 p53结构及功能 p53蛋白由393个氨基酸组成,主要有4个功能域:转录区、DNA结合区、四聚区和调控区[28]。该蛋白由5个保守区(Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ)和环状螺旋结构(L、S、H)组成。环状结构域与高度保守的结构域重叠,是蛋白质三维结构的一部分[27]。
p53抑制肿瘤最重要的途径是诱导细胞凋亡和细胞周期阻滞[29]。细胞周期停滞可以通过消耗细胞周期进程所需的调节蛋白来实现。在p53激活后,许多中枢细胞周期蛋白的基因被转录下调。p53诱导后被抑制的基因包括细胞周期蛋白A[30]、polo样激酶1(Polo-like kinase 1,PLK1)[30]、细胞周期蛋白B1[31]、细胞周期蛋白B2[32]、细胞周期蛋白依赖性激酶1(Cyclin dependent kinase 1,CDK1)[33]、细胞分裂周期蛋白20(Cell division cycle 20,CDC20)[32]。对这些不同基因的选择性,表明p53依赖的表达下调会影响细胞周期调控的许多方面。
p53属于一种双向转录因子,即野生型的p53可以促进细胞凋亡,而突变型的p53可以抑制细胞凋亡,影响分子基础p53的凋亡可能取决于细胞类型和p53蛋白水平[34]。
1.3.2 p21结构及功能 细胞周期蛋白依赖性激酶抑制剂p21,是一种含有165个氨基酸的小蛋白质,属于CDKs抑制剂的CIP/KIP(CDK interacting protein/Kinase inhibition protein)家族[35]。p21不仅是一种细胞周期抑制剂、衰老诱导剂和肿瘤抑制剂,还是一种更复杂和更广泛的调节剂[36]。其在诱导凋亡、分化、多功能干细胞的重编程、DNA修复、转录和细胞迁移中具有十分关键的作用[37]。p21对于G2/M过渡和有丝分裂进程是重要的,它的缺失会导致有丝分裂缺陷,并可能导致基因组不稳定[38]。p21诱导在癌细胞增殖和肿瘤发生的过程中发挥了重要作用[39]。细胞质的p21有利于抗凋亡活性[40],而细胞核的p21与细胞周期停滞有关[41]。所以,区分p21是致癌蛋白还是肿瘤抑制因子,取决于其在细胞质还是细胞核中[42]。
p21的关键调节因子是p53,其在控制细胞周期进程、分化、DNA修复和细胞凋亡的过程中起重要作用[43]。目前,针对p21位置和p53蛋白条件导致p21作用不同的观点存在争议[44]。
1.3.3 p53与p21的相互关系 研究表明,p53和p21都能对氧化应激产生反应,p21表达受p53依赖性和p53非依赖性机制的调控。p53诱导p21的表达,以响应细胞应激,例如DNA损伤。在p53转录因子活性的影响下,一方面,p21诱导可通过抑制细胞周期蛋白激酶复合物、增殖细胞核抗原 (Proliferating cell nuclear antigen,PCNA)、转录因子和共激活因子导致肿瘤生长停滞[45];另一方面,p21可以通过减缓 DNA 损伤的积累来促进肿瘤向癌症发展[46]。而正常组织发育过程中,p21不依赖于p53,其可以通过血清诱导直接进行细胞分化[47]。
1.4 Nrf2信号通路与p53/p21信号通路相互调控对肿瘤的作用 在功能水平上,p53和Nrf2发挥着相似的作用,都能增强细胞减轻氧化应激的能力。研究结果表明,p21作为p53靶基因,通过与Keap1结合并干扰其促进Nrf2泛素化和蛋白酶体降解来稳定Nrf2表达[48]。NAD(P)H醌氧化还原酶1(NAD(P)H quinone oxidoreductase 1,NQO1)作为Nrf2的靶标,与p53相互作用并阻止其被20S蛋白酶体降解[8],而该降解过程与MDM2和泛素化无关[49]。基于此,研究者提出:Nrf2和p53之间是否存在正反馈环,以及癌细胞是否利用这一正反馈环来增强其对氧化应激的抵抗力。p53缺失的HCT116结肠癌细胞在受到氧化应激攻击后,表现出对Nrf2靶基因的诱导减少[50],表明p53可能在肿瘤细胞Nrf2的激活中起重要作用。但是,这个模型可能不完整,因为MDM2也是Nrf2的转录靶点,Nrf2通过该靶点负调控p53[51]。在另一项研究中,p53与Nrf2激活的启动子元件结合,因此,p53可能也是Nrf2靶基因的转录抑制因子[52](见图2)。有研究者将p53对Nrf2的调节总结为2个阶段:第一阶段是低水平的p53诱导p21,第二阶段则是当存在严重DNA损伤和p53的高表达时,其会抑制Nrf2介导的存活反应并诱导细胞死亡[53]。综上,Nrf2和p53之间的确切关系很可能依赖于细胞和生物学环境。
p21调节细胞周期、细胞分化、衰老和凋亡等多种细胞过程[43]。对于氧化应激,p21被上调以促进细胞存活[54]。然而,具体的p21保护细胞免受氧化损伤的潜在机制仍不明确。有研究者提出分子和遗传证据,表明氧化应激下,p21依赖性细胞存活是通过激活Nrf2信号通路介导的[55]。通过p21和Nrf2之间的直接相互作用,p21上调Nrf2的蛋白质水平[55]。在p21敲除时,基础和诱导的Nrf2转录激活效率显著降低,而在p21高表达时Nrf2活性增加。此外,使用p21缺陷小鼠的相关试验也证实p21介导Nrf2在基础和诱导条件下的调节[55]。p21在增强Nrf2活化中的作用不仅为其ROS保护作用提供了简单的解释[56],更重要的是通过ROS和氧化还原稳态的细胞保护途径来扩大p53的存活功能[54]。如果ROS水平影响p53介导的细胞状态,那么Nrf2可能在这个过程中起关键作用。
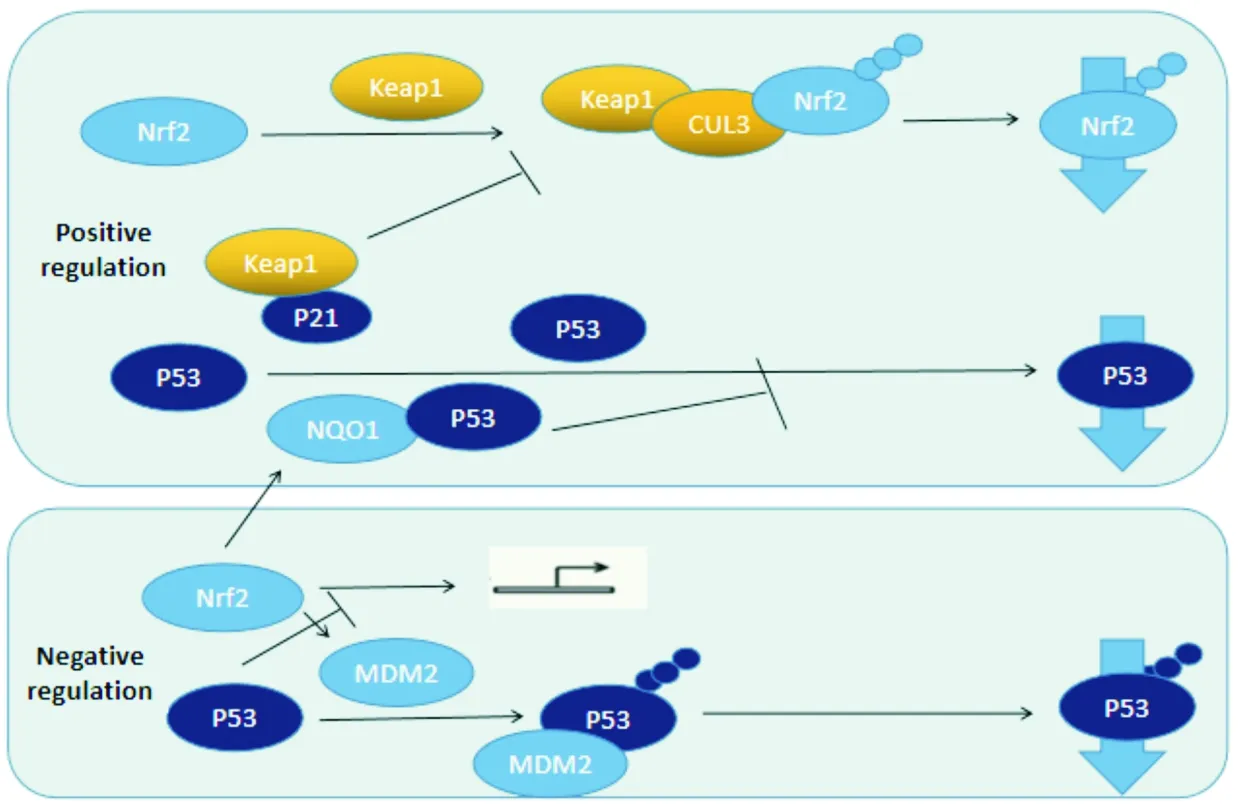
图2 Nrf2、p53作用示意图
综上,Nrf2表达上调是一把双刃剑,可抑制化学致癌作用,也可以增加癌细胞存活率并促进耐药性[57]。这一特点可通过癌症细胞突变来说明,而癌细胞突变恰好位于Keap1和Nrf2调节区内,并引起Nrf2组成型激活。鉴于p21的Nrf2依赖性促存活作用,应当针对p53/p21的突变和功能状态,进一步评估与Keap1/Nrf2相关的癌症体细胞突变来寻找相关治疗药物。
2 与Nrf2信号通路和p53/p21信号通路相关的肿瘤治疗药物
2.1 槲皮素 槲皮素是膳食植物(如苹果、洋葱、樱桃等[58])中发现的黄酮,具有抗炎、抗糖尿病、抗肥胖和抗癌活性[59]。槲皮素通过激活Nrf2信号通路发挥抗氧化应激活性[60]。
有报道,槲皮素可以靶向抗凋亡激酶和选择性癌基因(如Mcl-1、Ras、MEK和PI3K)或上调肿瘤抑制基因(p53、p21),从而导致选择性消除癌细胞[61]。槲皮素可通过抑制肝癌细胞(HepG2)中的RNA降解和蛋白质泛素化来激活和稳定p53,从而促进p21表达和细胞周期蛋白D1抑制,有利于细胞周期停滞[62]。
2.2 雷公藤内酯 雷公藤内酯是雷神藤中天然的二萜类化合物,其能够诱导有毒的细胞效应,如在肝细胞系中诱导Nrf2及其靶基因[63]。雷公藤内酯能够减少线粒体呼吸,上调Nrf2及其靶基因HO-1和NQO1[63]。通过靶向p53/p21和BCL-2途径,该化合物在癌症中诱导细胞凋亡和细胞周期停滞[64]。相反,在耐药性髓细胞白血病细胞系中,雷公藤内酯通过下调Nrf2及其靶基因来增强对多柔比星和伊马替尼诱导的细胞凋亡的敏感性[65]。
2.3 木犀草素 木犀草素是一种来自蔬菜、水果和草药的膳食黄酮,具有抗炎、抗过敏、抗癌和抗氧化等有益作用,可预防退行性疾病[66-67]。其通过抑制转录因子、激酶修饰、细胞周期停滞和诱导凋亡来抑制癌症的发生[68]。木犀草素上调p53及其靶蛋白p21的表达,并增加Nrf2和p53之间的相互作用,从而增加了抗氧化酶和凋亡相关蛋白的表达[8]。
2.4 姜黄素 姜黄素是从姜黄植物的根中提取的多酚,具有抗氧化、抗凋亡和抗炎的特性[69]。其可激活Nrf2途径,触发细胞抗氧化损伤保护,在晚期癌症中,抗氧化损伤可诱导化学抗性[70]。另一方面,姜黄素可能通过自噬诱导突变型p53降解或将突变型p53蛋白转化为转录活性的野生型p53,逆转治疗耐药性并促进癌细胞死亡[71-72]。
2.5 大豆抗毒素 大豆抗毒素是一组植物抗毒素,属于异戊烯化的黄酮类化合物,是大豆中存在的最重要的生物活性化合物,在暴露于某些真菌和一些非生物诱导剂(如紫外线、氯化铝或茉莉酸甲酯)时存在[73-74]。有研究表明,其可诱导Nrf2信号通路,参与致癌物质的解毒和ROS的去除,在调节人类结肠癌小鼠异种移植模型中的肿瘤发展和生长的过程中存在一定的剂量相关性,即低剂量的大豆抗毒素对肿瘤生长没有影响,而高剂量的大豆抗毒素可能通过激活 Nrf2介导的信号转导途径促进p53野生型结肠癌的生长[75]。
3 结语
肿瘤的发病机制涉及氧化应激,防御氧化应激反应的重要信号通路 Nrf2/ARE通路在肿瘤的治疗中起着至关重要的作用,然而,Nrf2在晚期癌细胞中的构成性激活可能会产生耐药性。同时p53/p21作为重要的抑癌基因与细胞周期抑制因子,对肿瘤的产生和发展都具有“双重作用”,对细胞的凋亡以及分化的控制也起到了非常重要的作用。研究表明,Nrf2通路和p53/p21通路间可能存在相互调节,而且均参与了很多具有临床应用价值的天然药物的抗肿瘤作用机制,但是这两条通路之间具体的作用机制尚不明确。因此,探索Nrf2与p53/p21相互调控从而开发新型防治肿瘤的药物越来越受到重视。

