丁苯酞联合依达拉奉对急性脑梗死患者脑血管功能及NLRP3炎性小体信号通路的影响
高伟,刘震宇,姚淑芳,嵇朋,汤雪丽
1.义马煤业集团股份有限公司总医院神经内科,河南 三门峡 472300;2.三门峡市中心医院神经内科,河南 三门峡 472100;3.郑州市第三人民医院神经内科,河南 郑州 450000;
急性脑梗死(acute cerebral infarction,ACI)是由脑动脉血管狭窄所致脑组织缺血缺氧的脑血管疾病,其占据全部脑血管疾病发病率的75%左右,且具有高度致残率、致死率,临床表现为头晕、肢体麻木、偏瘫、恶心呕吐等[1]。该病目前以溶栓、抗凝等治疗为主,但单药治疗效果不佳。依达拉奉可清除脑组织内氧自由基,减轻神经细胞氧化损伤,保护神经功能[2]。丁苯酞可降低花生四烯酸水平,提高一氧化氮(NO)、前列环素水平,降低钙离子浓度,增强抗氧化酶活性,维持血管结构完整性,改善重构缺血区微循环、脑部血供,保护神经元[3]。NOD 样受体热蛋白结构域相关蛋白3(NLRP3)炎性小体主要由NLRP3、凋亡相关斑点样蛋白(ASC)、半胱氨酰天冬氨酸特异性蛋白酶1 (Caspase-1)组成,NLRP3 活化后可激活ASC、Caspase-1,促进白细胞介素-8(IL-8)等炎性因子由前体转变为成熟体,参与脑组织缺血损伤发生过程[4]。目前丁苯酞、依达拉奉联合治疗ACI的研究较多,但尚未完全阐明其可能作用机制。本研究主要探讨其联合治疗对ACI脑血管功能、NLRP3炎性小体信号通路的影响。
1 资料与方法
1.1 一般资料 选取2020 年1 月至2022 年1月义马煤业集团股份有限公司总医院收治的120 例ACI 患者为研究对象。纳入标准:符合ACI 诊断标准[5];经CT 或磁共振成像证实为ACI;格拉斯哥昏迷量表(GCS)评分>9 分[6];首次发病者;发病至入院时间<48 h;符合药物治疗指征者;所有患者及其家属均签署同意书。排除标准:肝、肾等器官功能缺损者;血管畸形者;精神或意识障碍者;严重药物过敏史者。采用奇偶数分组法将患者分为单一组和联合组各60 例。两组患者的一般资料比较差异均无统计学意义(P>0.05),具有可比性,见表1。本研究经本院医学伦理委员会批准。
表1 两组患者的一般资料[例(%),±s]Table 1 General information of the two groups of patients[n(%),±s]
表1 两组患者的一般资料[例(%),±s]Table 1 General information of the two groups of patients[n(%),±s]
组别例数性别 合并症年龄(岁)病理类型单一组联合组t/χ2值P值60 60男性38(63.33)32(53.33)女性22(36.67)28(46.67)1.234 0.267 55.36±3.25 55.18±3.10 0.310 0.757发病至入院时间(h)2.65±0.38 2.78±0.40 1.825 0.071腔隙性脑梗死14(23.33)16(26.67)0.178 0.673脑血栓20(33.33)22(36.67)0.147 0.702脑栓塞26(43.33)22(36.67)0.556 0.456高血压10(16.67)12(20.00)0.223 0.637糖尿病13(21.67)11(18.33)0.208 0.648冠心病11(18.33)14(23.33)0.455 0.500
1.2 治疗方法 两组患者均接受抗凝、溶栓等基础治疗。单一组患者静脉滴注依达拉奉右莰醇注射液(江苏正大丰海制药有限公司,国药准字H20193434,规格:100 mL:30 mg),30 mg/次,2 次/d。联合组患者予以丁苯酞+依达拉奉治疗,依达拉奉治疗时口服丁苯酞软胶囊(石药集团恩必普药业有限公司,国药准字H20050299,规格:0.1 g/粒),2 粒/次,3 次/d。两组连续治疗14 d。
1.3 观察指标与评价方法 (1)临床疗效[7]:显效:临床症状、体征明显改善,45%<美国国立卫生研究所脑卒中评分(NIHSS)[8]改善幅度≤90%;有效:临床症状、体征有所改善,20%≤NIHSS 改善幅度在20%~45%;无效:不符合上述标准。(2)脑血管功能:于治疗前后使用Multi-DOP×4 TCD 检测仪(德国DWL 公司)检测两组患者搏动指数(PI),分别记录静息态、屏气1 min 时大脑中动脉平均流速(分别设为Vm1、Vm2),计算脑血管储备功能(CVR)[(Vm1-Vm2)/Vm2×100%]、屏气指数(BHI) [(Vm2-Vm1)×100%/(Vm1×屏气时间)]。(3)神经功能:于治疗前后抽取两组患者空腹静脉血3 mL分离血清(3 000 r/min、5 min)并保存待测。ELISA 法检测中枢神经特异蛋白(S-100β)、神经元特异性烯醇化酶(NSE)、脑源性神经营养因子(BNDF)水平,上海酶联生物提供S-100β、NSE 检测试剂盒,上海研生实业有限公司提供BNDF检测试剂盒。(4)氧化应激指标水平:于治疗前后抽取两组患者空腹静脉血3 mL分离血清(3 000 r/min、5 min)并保存待测。采用比色法检测两组患者血清谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)水平,南京建成生物研究所提供检测试剂盒。(5)NLRP3 信号通路相关蛋白表达量:治疗前后,采集两组患者外周静脉血3 mL,加入EDTA 抗凝后使用全血RNA 提取试剂盒(北京索莱宝)提取总RNA,按照cDNA 合成试剂盒(美国Thermo Fisher 公司)将总RNA反转录合成cDNA,使用荧光定量检测试剂盒(美国Thermo Fisher 公司)检测NLRP3、凋亡相关斑点样蛋白(ASC)、半胱氨酰天冬氨酸特异性蛋白酶1(Caspase-1)mRNA 相对表达量。(6)神经功能缺损的日常生活能力:于治疗前后采用NIHSS评估两组患者的神经缺损程度,总分为42 分,分值高表明神经功能缺损程度重。采用Barthel指数评分(BI)评估日常生活能力,包括穿衣、大小便、进食等方面,总分为100 分,分值高表明生活能力良好。
1.4 统计学方法 应用SPSS24.0 统计软件分析数据。计数资料比较采用χ2检验,计量资料以均数±标准差(±s)表示,组间比较采用t 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者的治疗效果比较 联合组患者的治疗总有效率为95.00%,明显高于单一组的83.33%,差异有统计学意义(χ2=4.227,P=0.040),见表2。
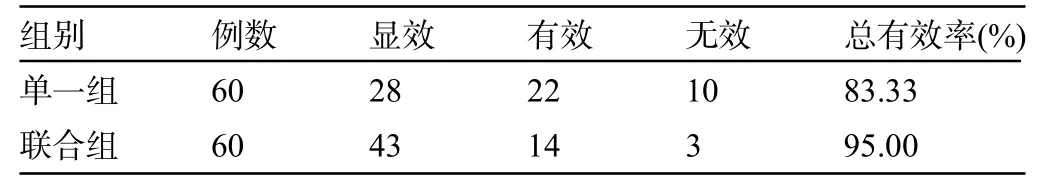
表2 两组患者的治疗效果比较(例)Table 2 Comparison of treatment effects between the two groups of patients(n)
2.2 两组患者治疗前后的脑血管功能比较 治疗前,两组患者的脑血管功能指标比较差异均无统计学意义(P>0.05);治疗后,两组患者的CVR、BHI 明显高于治疗前,PI 明显低于治疗前,且联合组患者的改善幅度明显大于单一组,差异均有统计学意义(P<0.05),见表3。
表3 两组患者治疗前后的脑血管功能比较(±s)Table 3 Comparison of cerebrovascular function between the two groups(±s)

表3 两组患者治疗前后的脑血管功能比较(±s)Table 3 Comparison of cerebrovascular function between the two groups(±s)
注:与同组治疗前比较,aP<0.05。Note:Compared with that in the same group before treatment,aP<0.05.
时间 组别 例数CVR(%)BHI PI治疗前60 60治疗后联合组单一组t值P值联合组单一组t值P值60 60 7.72±1.54 7.68±1.52 0.143 0.886 12.36±2.12a 10.24±2.01a 5.621 0.001 0.71±0.18 0.73±0.19 0.592 0.555 1.16±0.28a 0.84±0.22a 6.961 0.001 0.82±0.17 0.85±0.19 0.911 0.364 0.51±0.10a 0.62±0.13a 5.195 0.001
2.3 两组患者治疗前后的神经功能指标比较 治疗前,两组患者的血清S-100β、NSE、BNDF 水平比较差异均无统计学意义(P>0.05);治疗后,联合组患者的血清S-100β、NSE水平明显低于单一组,BNDF水平明显高于单一组,差异均有统计学意义(P<0.05),见表4。
表4 两组患者治疗前后的神经功能指标比较(±s)Table 4 Comparison of nerve function indexes between the two groups(±s)

表4 两组患者治疗前后的神经功能指标比较(±s)Table 4 Comparison of nerve function indexes between the two groups(±s)
注:与同组治疗前比较,aP<0.05。Note:Compared with that in the same group before treatment,aP<0.05.
时间治疗前联合组单一组t值P值联合组单一组t值P值60 60治疗后60 60 1.19±0.26 1.17±0.23 0.446 0.656 0.41±0.09a 0.56±0.12a 7.746 0.001 25.67±5.36 25.71±5.42 0.041 0.968 15.03±3.01a 18.75±3.08a 6.691 0.001 1.46±0.28 1.49±0.30 0.566 0.572 2.86±0.42a 2.30±0.31a 8.310 0.001组别例数S-100β(ng/mL)NSE(ng/mL)BNDF(U/mL)
2.4 两组患者治疗前后的氧化应激指标比较 治疗前,两组患者的MDA、GSH-Px、SOD 水平比较差异均无统计学意义(P>0.05);治疗后,联合组患者的MDA 水平明显低于单一组,GSH-Px、SOD 水平明显高于单一组,差异均有统计学意义(P<0.05),见表5。
表5 两组患者治疗前后的氧化应激指标比较(±s)Table 5 Comparison of oxidative stress indexes between the two groups(±s)

表5 两组患者治疗前后的氧化应激指标比较(±s)Table 5 Comparison of oxidative stress indexes between the two groups(±s)
注:与同组治疗前比较,aP<0.05。Note:Compared with that in the same group before treatment,aP<0.05.
时间治疗前例数60 60治疗后组别联合组单一组t值P值联合组单一组t值P值60 60 MDA(nmol/mL)13.64±2.55 13.71±2.57 0.150 0.881 4.78±1.03a 8.96±1.38a 18.803 0.001 GSH-Px(U/L)47.82±9.85 48.03±9.96 0.116 0.908 113.02±17.62a 79.08±12.36a 12.215 0.001 SOD(U/mL)175.26±28.42 180.02±30.06 0.891 0.375 328.16±50.38a 255.08±40.12a 8.790 0.001
2.5 两组患者治疗前后的NLRP3信号通路相关蛋白表达量比较 治疗前,两组患者的NLRP3、ASC、Caspase-1 表达量比较差异均无统计学意义(P>0.05);治疗后,两组患者NLRP3、ASC、Caspase-1 表达量明显低于治疗前,且联合组明显低于单一组,差异均有统计学意义(P<0.05),见表6。
表6 两组患者治疗前后的NLRP3信号通路相关蛋白表达量比较(±s)Table 6 Comparison on the expression of NLRP3 signal-related protein between the two groups(±s)

表6 两组患者治疗前后的NLRP3信号通路相关蛋白表达量比较(±s)Table 6 Comparison on the expression of NLRP3 signal-related protein between the two groups(±s)
注:与同组治疗前比较,aP<0.05。Note:Compared with that in the same group before treatment,aP<0.05.
时间治疗前例数60 60治疗后组别联合组单一组t值P值联合组单一组t值P值60 60 NLRP3 mRNA 1.00±0.09 1.01±0.10 0.576 0.566 0.36±0.02a 0.52±0.05a 23.014 0.001 ASC mRNA 1.01±0.07 1.00±0.05 0.900 0.370 0.41±0.03a 0.68±0.07a 27.462 0.001 Caspase-1 mRNA 1.01±0.08 1.00±0.06 0.775 0.440 0.21±0.01a 0.40±0.02a 65.818 0.001
2.6 两组患者治疗前后的NIHSS 和BI 评分比较 治疗前,两组患者的NIHSS评分和BI评分比较差异均无统计学意义(P>0.05);治疗后,两组患者的NIHSS 评分明显低于治疗前,BI 评分明显高于治疗前,且治疗后,联合组患者的NIHSS 评分明显低于单一组,BI 评分明显高于单一组,差异均有统计学意义(P<0.05),见表7。
表7 两组患者治疗前后的NIHSS和BI评分比较(±s,分)Table 7 Comparison of NIHSS and BI scores between the two groups(±s,points)

表7 两组患者治疗前后的NIHSS和BI评分比较(±s,分)Table 7 Comparison of NIHSS and BI scores between the two groups(±s,points)
注:与同组治疗前比较,aP<0.05。Note:Compared with that in the same group before treatment,aP<0.05.
时间治疗前例数60 60治疗后组别联合组单一组t值P值联合组单一组t值P值60 60 NIHSS 17.86±3.16 17.64±3.08 0.386 0.700 5.30±1.06a 8.79±1.33a 15.895 0.001 BI 47.58±6.63 47.43±6.76 0.123 0.903 78.63±7.01a 66.34±6.82a 9.734 0.001
3 讨论
ACI发病机制较为复杂,血流动力异常、脑部动脉粥样硬化、血管狭窄、神经元细胞凋亡、血小板活化/聚集等均与ACI 发生发展密切相关。脑组织缺血后产生大量过氧化氢、羟自由基、过氧亚硝基阴离子,经过脂质过氧化,可促进蛋白质氧化、硝化,激活炎性反应,造成线粒体损伤,导致神经功能损伤。
依达拉奉作为氧自由基清除剂,可降低氧化酶活性,减弱脑胶质细胞神经毒性,减轻神经或血管损伤[9]。丁苯酞可抑制血栓形成,提升脑组织血流储备量,维持线粒体结构完整性,抑制谷氨酸释放、四烯酸形成,减轻半暗带细胞炎性损伤,还可缩小梗死病灶面积,减轻血脑屏障损伤,促进神经功能恢复[10]。本研究结果显示联合组总有效率高于单一组,与上述研究结果相似[10],进一步研究发现联合组脑血管功能改善幅度优于单一组,表明联合治疗可提高临床疗效,改善脑血管功能。依达拉奉可减轻脑水肿,改善脑部微循环,其与丁苯酞联合作用可促进神经功能恢复,保护线粒体功能,调节脑组织能量代谢,进一步减改善脑血管功能。S-100β、NSE、BNDF 属于神经功能指标,可反映ACI中枢神经系统损伤、血脑屏障损伤[11]。本研究发现治疗后联合组血清S-100β、NSE 水平低于单一组,BNDF水平高于单一组,证实联合治疗对ACI患者神经功能具有保护、改善作用。推测其原因可能为丁苯酞、依达拉奉联合治疗ACI可发挥协同作用,增强治疗效果,促进脑组织血液循环恢复,改善神经功能。
MDA、GSH-Px、SOD属于氧化应激指标,MDA可反映脂质过氧化程度,GSH-Px、SOD可反映机体抗氧化能力,可用于评估ACI疗效、预后[12]。本研究结果显示联合组治疗后MDA 水平低于单一组,GSH-Px、SOD水平高于单一组,表明联合治疗可降低氧化应激水平,抑制血管内皮细胞、神经细胞过氧化损伤,可清除氧自由基,抑制其对炎性因子的激活、释放,抑制氧化应激、炎性反应。NLRP3 炎性小体活化可激活ASC、Caspase-1,促进内皮素、促炎细胞因子合成、分泌,增加氧自由基生成量,直接损伤血管内皮细胞,并可促进血小板黏附、聚集,进一步参与ACI 发生发展进程[13]。体内实验证实依达拉奉[14]、丁苯酞[15]可抑制NLRP3 炎性小体信号通路活化,调节脑组织能量代谢,抑制神经元凋亡。由此推测联合治疗可能通过干预NLRP3 炎性小体信号通路发挥作用。本研究进一步分析显示治疗后联合组NLRP3、ASC、Caspase-1 表达量低于单一组,表明联合治疗可能通过抑制NLRP3炎性小体信号通路活化保护脑细胞,改善神经功能,减轻脑组织氧化损伤。同时本研究结果显示治疗后联合组NIHSS 评分低于单一组,BI 评分高于单一组,表明联合治疗可改善ACI 患者神经功能缺损程度、预后,促进病情恢复。
综上所述,丁苯酞联合依达拉奉治疗ACI 可提高临床疗效,改善脑血管功能、神经功能,抑制氧化应激水平,提升日常生活能力,其作用机制可能与抑制NLRP3炎性小体信号通路活化有关。

