鸡成纤维细胞生长因子家族生物信息学特性及表达调控
曹玉珠, 贾其辉, 邢雨欣, 夏天, 王丹丹, 张珂,王阳阳, 田亚东,2,3, 康相涛,2,3, 刘小军,2,3, 李红,2,3
(1.河南农业大学动物科技学院,河南 郑州 450046;2.河南省家禽育种国际联合实验室,河南 郑州 450046;3.河南省鸡种质资源创新与利用重点实验室,河南 郑州 450046)
成纤维细胞生长因子[1-2](fibroblast growth factor, FGF)是一种能够调节细胞增殖和分化的多肽,由多个受体和配体组成,广泛分布于机体多个组织和器官中[3]。FGF家族作为多功能蛋白家族,对不同类型的细胞作用不同,因此也被称为混杂生长因子[4-5]。在哺乳动物上FGF家族有23个成员,各成员之间具有一定的序列同源性和结构相似性[6]。作为具有多种功能的信号分子,FGF家族参与了多种重要的生物学过程,包括生长发育[7-10]、血管形成[11-12]、细胞分化[13]、细胞增殖和细胞凋亡[14]、调节钙磷平衡[15]、葡萄糖代谢平衡[16]及组织损伤修复[17-18]等。目前,FGF家族成员的相关研究主要集中在哺乳动物上,而对于该家族成员在鸡上的生物学特性研究较为少见。通过整合相关肝脏转录组数据和基因组数据库分析发现,鸡FGF家族存在19个成员[19]。在此基础上,对鸡FGF家族19个成员进行系统研究,利用氨基酸序列分析构建系统发育进化树、预测保守基序和蛋白质结构;基于基因组重测序数据,利用该家族成员上的遗传变异位点对10个鸡品种的形成分类贡献进行了主成分分析;利用实时荧光定量PCR(quantitative real-time PCR, qRT-PCR)技术分析了FGF家族在固始鸡脂质代谢相关器官上的表达分布,以及在20周龄和30周龄卢氏鸡肝脏的表达水平变化;分别在细胞水平和活体水平研究了雌激素对鸡肝脏FGF表达的影响;将FGF19基因上的遗传变异与固始鸡不同阶段的产蛋量进行了关联分析。本研究为进一步探究FGF家族相关成员的功能奠定了重要基础。
1 材料与方法
1.1 试验样品及重测序数据收集
试验对象(固始鸡)来自河南农业大学原阳种质资源场,在相同饲养管理环境下,自由采食和饮水。将43周龄体质量相近的健康固始鸡(n=8)颈部放血处死,采集肝脏、肾脏、卵巢、腹脂和十二指肠,放在液氮中,存于-80 ℃冰箱,用于基因组织表达谱分析。试验过程均在河南农业大学机构动物护理和使用委员会(Institutional animal care and use committee, IACUC)(编号 11-0085)批准下进行。
20周龄(n=8)和30周龄(n=8)的卢氏鸡肝脏及对应的转录组数据由河南省鸡种质资源创新与利用重点实验室(以下简称实验室)保存提供[19]。雌激素处理组(n=8)和对照组(n=8)10周龄卢氏鸡的肝脏及对应的高通量数据[20]用于基因表达验证。
重测序数据包括肉鸡(科宝KB,n=30)、蛋鸡(白来航WL和洛岛红RIR,n=20)、地方鸡(固始鸡GS、卢氏鸡LS、淅川乌骨鸡XCBB和正阳三黄ZYSH,n=40)和野生型鸡(红原鸡RJF,n=5)。其中,KB重测序数据由中国农业大学提供,WL、RIR和RJF重测序数据从公共数据集获取[21],其他4个河南省地方品种重测序数据由实验室前期测序所得[22],用于主成分分析。
900只固始鸡的重测序数据,以及对应的21~25周龄、26~30周龄、31~35周龄、36~43周龄和21~43周龄不同阶段的产蛋数均由实验室保存提供[23],用于基因的遗传变异与表型的关联分析。
1.2 鸡肝癌细胞系培养与处理
使用10%完全培养基(10%胎牛血清、1%青霉素/链霉素双抗、89%DMEM/F12培养基)在25 cm2培养瓶中培养鸡肝癌细胞系(leghorn male hepatoma cell line, LMH),待细胞融合80%时,采用细胞计数的方法以1×106个·mL-1的细胞密度接种至12孔板中,放入37 ℃、体积分数5% CO2和95%空气的标准培养箱培养6 h,待细胞融合度为70%~80%时,用PBS液洗涤1次,用不含双抗的完全培养基代替完全培养基。根据徐春林等[24]研究结果,选取最佳处理浓度100 nmol·L-1的17β-雌二醇(Sigma,美国)处理鸡肝癌细胞系LMH,对照组用等量的无水乙醇处理,24 h后用Trizol裂解液收集细胞,存于-80 ℃冰箱用于后续试验。
1.3 生物信息学分析
利用NCBI(https://www.ncbi.nlm.nih.gov/)下载人、鼠、鸡、斑马鱼、非洲爪蟾、火鸡和野鸭7个物种FGF家族的氨基酸序列。使用在线软件MEME(https://meme-suite.org/meme/tools/meme)对鸡FGF家族进行氨基酸保守基序分析,保守基序个数设置为10,其余参数采用默认值;利用MEGA11.0软件中的邻接法构建不同物种间FGF家族系统发育树,基于ClustalW氨基酸序列比对结果,检验算法中Bootstrap method设置为2 000,其余参数采用默认值;使用SMART在线软件(http://smart.embl.de/smart/set_mode.cgi?NORMAL=1)对鸡FGF家族各成员的蛋白质功能结构域进行预测。
1.4 引物设计及合成
参照NCBI数据库中公布的鸡FGF1~FGF10、FGF12~FGF14、FGF16、FGF18~FGF20、FGF22~FGF23基因和内参基因GAPDH(GenBank)的mRNA序列,采用BLAST-Primer在线软件设计qRT-PCR引物(表1)。引物由尚亚生物公司(上海)合成。

表1 qRT-RCR引物信息
1.5 总RNA提取和反转录
参照Trizol试剂盒(南京,诺唯赞)说明书提取器官和细胞总RNA,分别利用琼脂糖凝胶电泳和NanoDrop 2000紫外分光光度计检测RNA质量,并稀释至相同的浓度,按照PrimeScriptTM RT reagent Kit(南京,诺唯赞)说明书反转录合成cDNA,-20 ℃保存。
1.6 qRT-PCR反应
根据QuantiFast SYBR Green PCR试剂盒(南京,诺唯赞)说明书,以GAPDH基因作为内参基因,利用qRT-PCR技术检测基因的相对表达水平。qRT-PCR反应体系:2×QuantiFast SYBR Green Master Mix 5 μL,10 μmol·L-1上、下游引物各0.5 μL,cDNA 1 μL,用无RNase水补足至 10 μL。qRT-PCR反应程序:95 ℃预变性5 min;95 ℃变性30 s,最适温度60 ℃退火30 s,72 ℃延伸 30 s,共35个循环;72 ℃终延伸10 min。
1.7 数据分析
使用2-ΔΔct方法计算基因相对表达量。使用SPSS软件对基因验证的定量数据进行单因素方差分析和t检验,P<0.05表示组间差异显著,P>0.05表示组间无差异,使用GraphPad Prism软件作图。
利用R软件中的FactoMine和Factoextra包对FGF家族的单核苷酸多态性(single nucleotide polymorphism,SNP)位点进行主成分分析并绘图。利用SPSS软件中的混合线性模型进行关联分析,结果以平均值±标准误表示,不同基因型之间采用成对比较,显著性用小写字母表示;单变量检验显著性用P值表示,P<0.01为差异极显著,P<0.05为差异显著,P>0.05为无差异。
2 结果与分析
2.1 鸡FGF家族系统发育进化树
为探讨鸡FGF家族的进化关系,利用NCBI数据库公布的人、鼠、鸡、斑马鱼、非洲爪蟾、火鸡和野鸭7个物种FGF家族的氨基酸序列进行亲缘进化分析。如图1所示,不同物种的FGF家族成员聚类为3个分支。其中,FGF3、FGF7、FGF10和FGF22聚在1个分支,FGF15、FGF19、FGF21和FGF23聚在1个分支,其余成员聚在1个分支中。
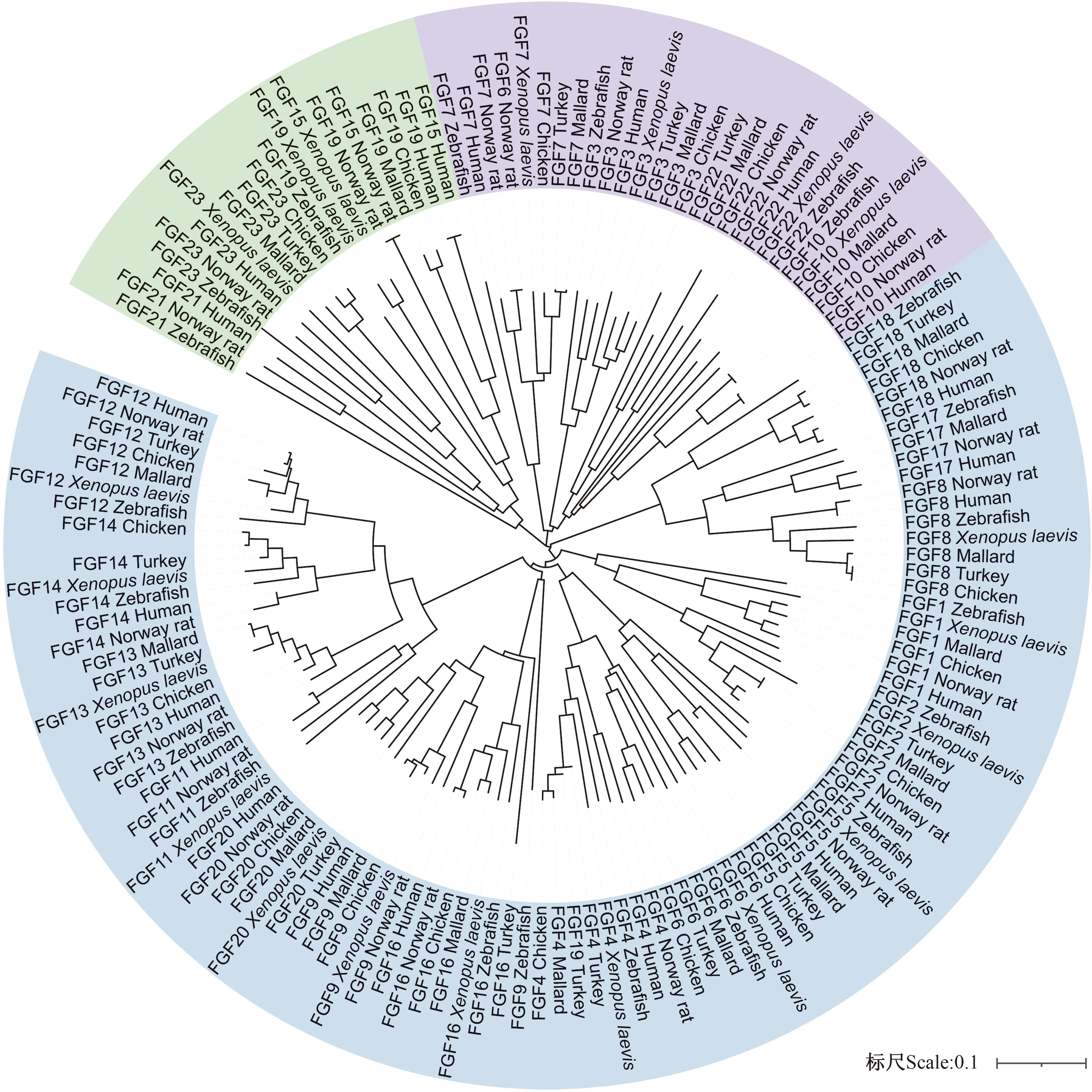
FGF1~FGF23为FGF家族氨基酸序列;英文为7个不同物种(人、鼠、鸡、斑马鱼、非洲爪蟾、火鸡和野鸭)。
2.2 鸡FGF家族的保守基序分析
利用在线软件MEME对鸡FGF家族成员进行了保守基序预测,如图2所示。FGF家族有10个保守基序,Motif 1(SVAVGVVAIKGVKSGLYLAMNKKGKLYGS)保守程度最高,为FGF家族成员共有;Motif 2和Motif 3保守程度较高;FGF22基因不存在Motif 2,FGF18基因不存在Motif 3;FGF22和FGF23基因不存在Motif 4;8个成员含有Motif 5,10个成员含有Motif 6,12个成员含有Motif 7。其中,Motif 8仅存在于FGF12、FGF13和FGF14基因中,Motif 9仅存在于FGF7和FGF10基因中,而Motif 10仅存在于FGF9、FGF16和FGF20基因中。
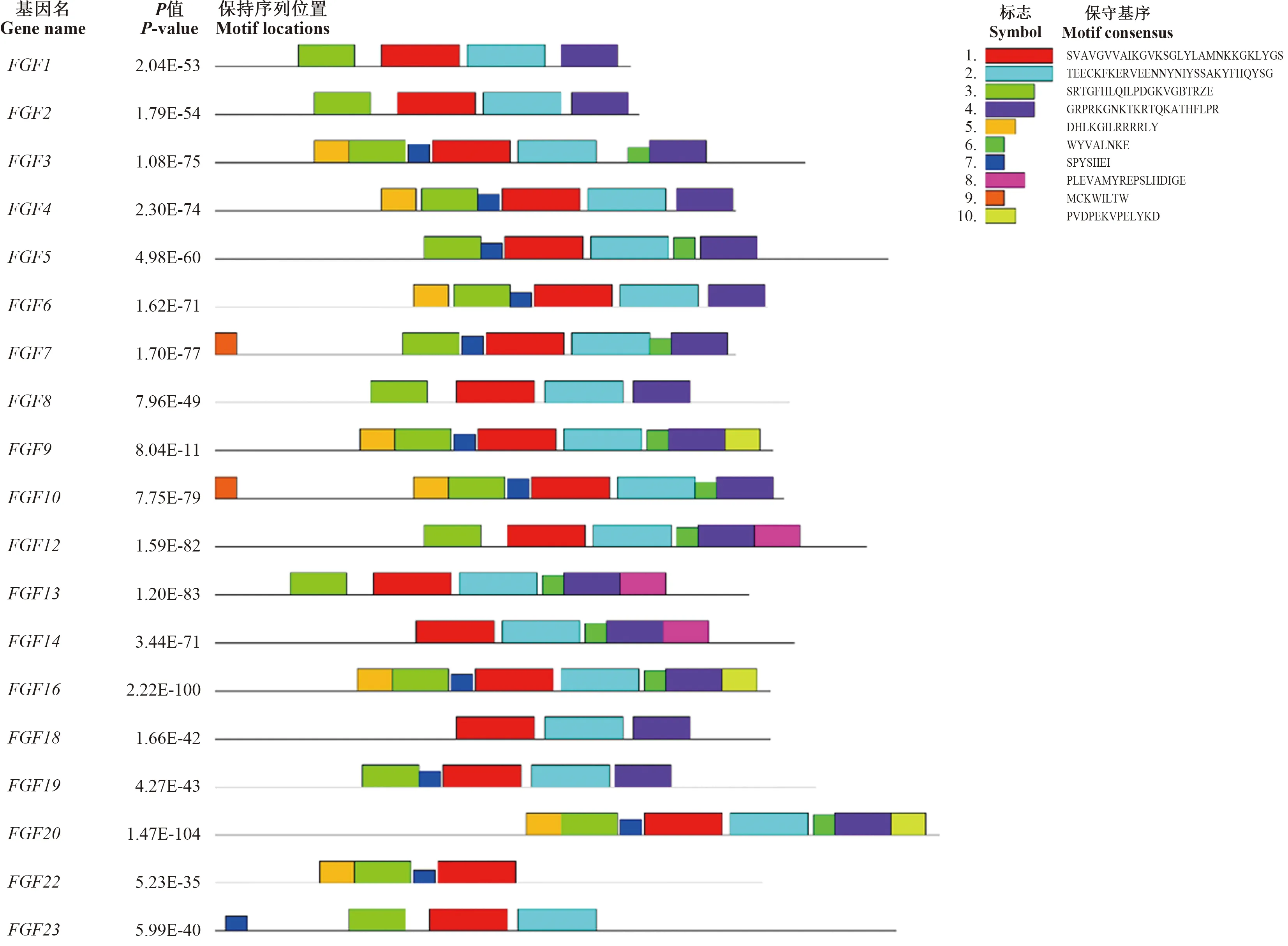
图2 鸡FGF家族保守基序预测
2.3 鸡FGF家族蛋白功能结构域分析
利用SMART软件对FGF家族的氨基酸序列进行蛋白功能结构域预测,进一步探究鸡FGF家族潜在的生物学功能,结果如图3-A所示。FGF家族成员都含有1个相同的核心区域(FGF),其中FGF6、FGF7和FGF10具有跨膜区。进一步探究鸡2个内分泌型成员FGF19和FGF23与人和鼠之间的结构相似性,结果如图3-B所示。人、鼠和鸡的FGF19、FGF23都有共同的结构域,但只有人FGF19有跨膜区。
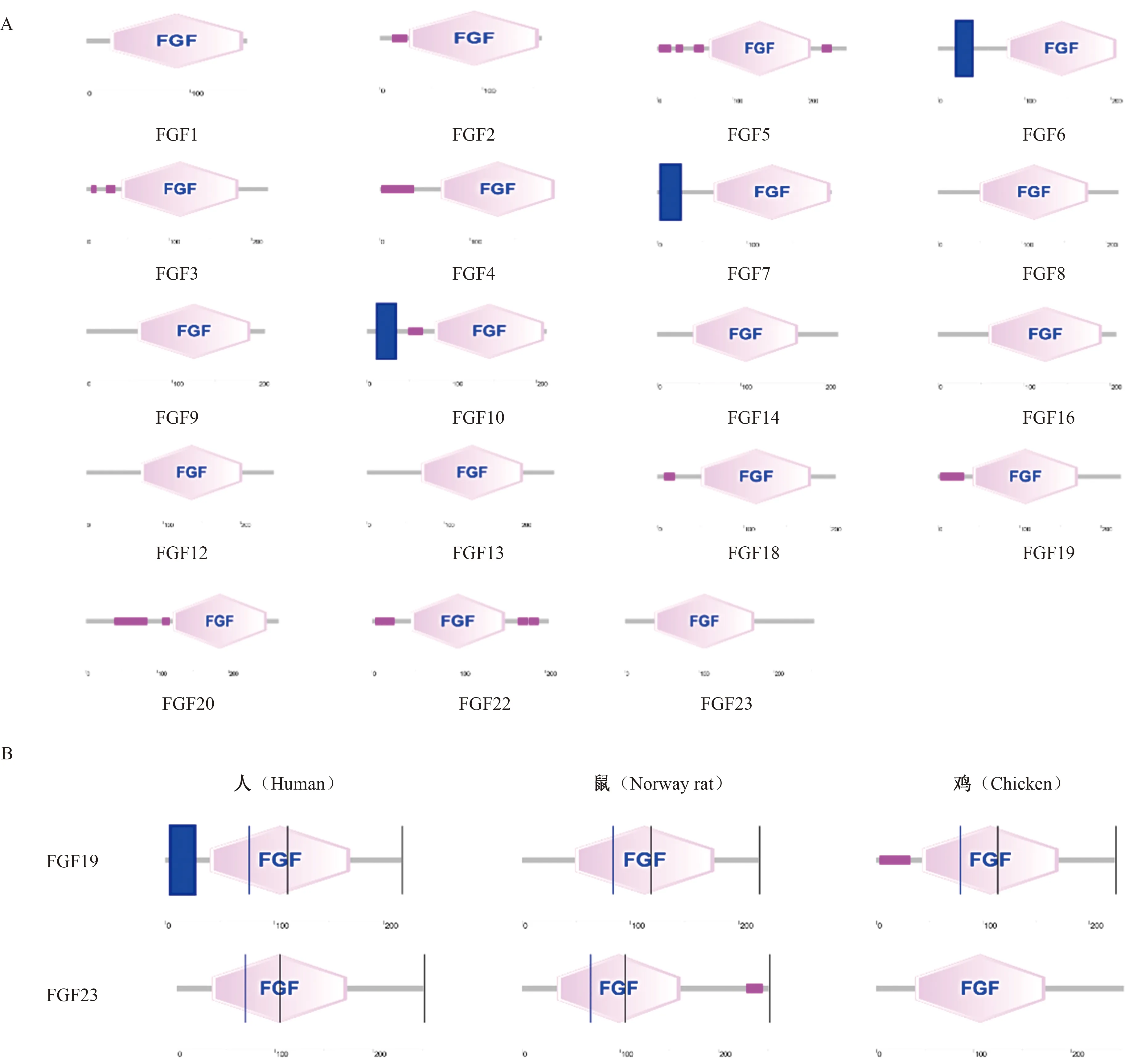
A:鸡FGF家族功能结构域;B:FGF19和FGF23在人、鼠、鸡上的功能结构域分析;数字表示氨基酸位置。
2.4 鸡FGF家族在不同品种间的主成分分析
基于实验室保存的10个品种鸡的基因组重测序数据[22],进一步对鸡FGF家族各成员的遗传变异位点进行分析。对鸡FGF家族各成员所有SNP位点进行主成分分析,选择总方差解释31.89%的前2的2个主成分(PC1、PC2)使用R绘图。如图4所示,鸡FGF家族成员所有的SNP位点可以明显将肉鸡和蛋鸡品种分开。
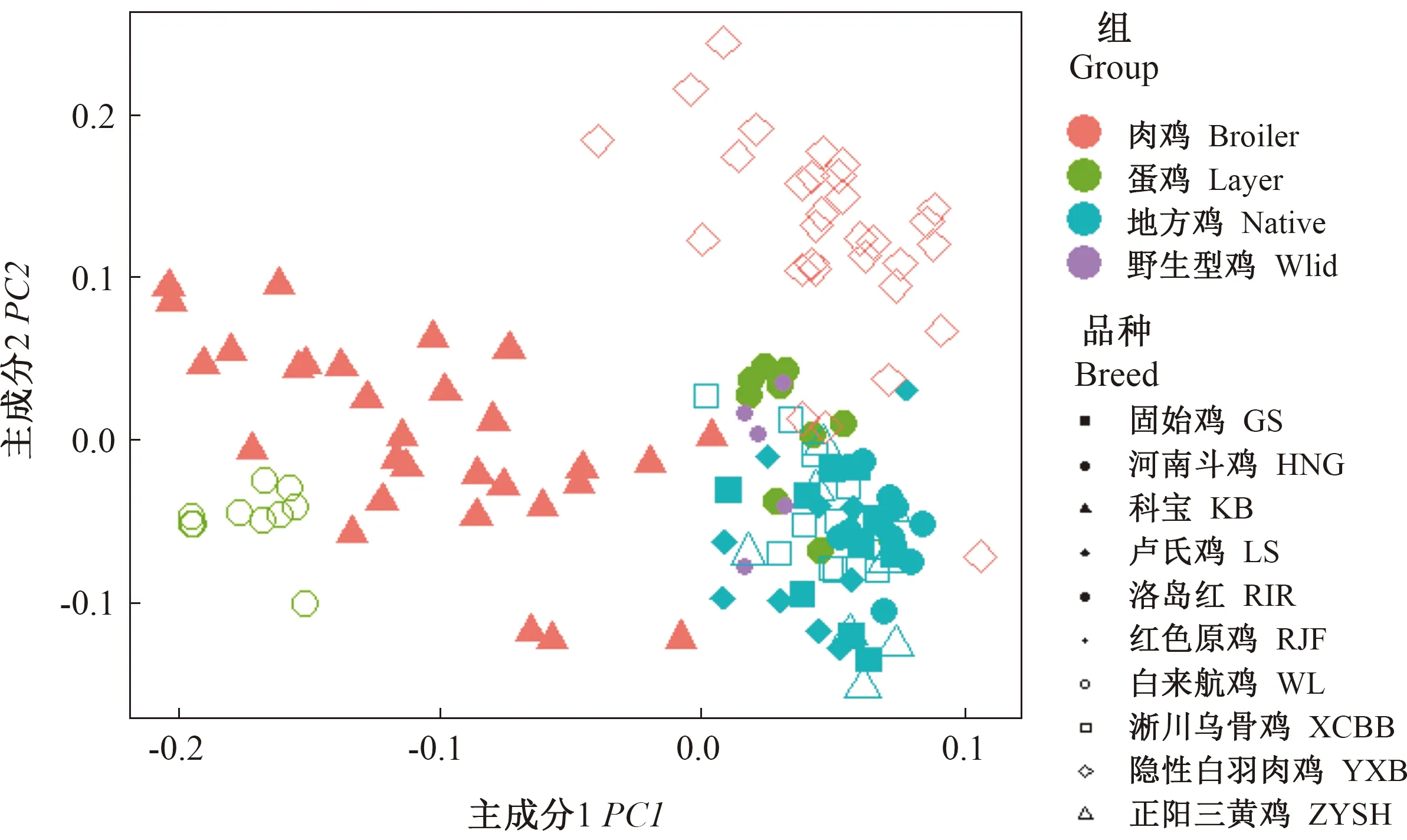
图4 FGF家族所有SNP位点的主成分分析
2.5 鸡FGF家族基因在不同器官中表达分布
为了分析鸡FGF家族成员的表达模式,对其在43周龄固始鸡的肝脏、肾脏、卵巢、腹脂和十二指肠中的mRNA表达水平进行分析。如图5所示,鸡FGF家族基因在检测的各个器官中均有表达。其中,FGF4和FGF23基因在肝脏中表达水平较高;FGF12基因在肾脏表达较高;FGF20基因在卵巢中表达水平较高;FGF1、FGF6、FGF7、FGF9、FGF10、FGF13、FGF14和FGF19基因在十二指肠中表达水平较高;FGF2、FGF3、FGF5、FGF8、FGF12、FGF16、FGF18和FGF22基因在腹脂中表达水平较高。
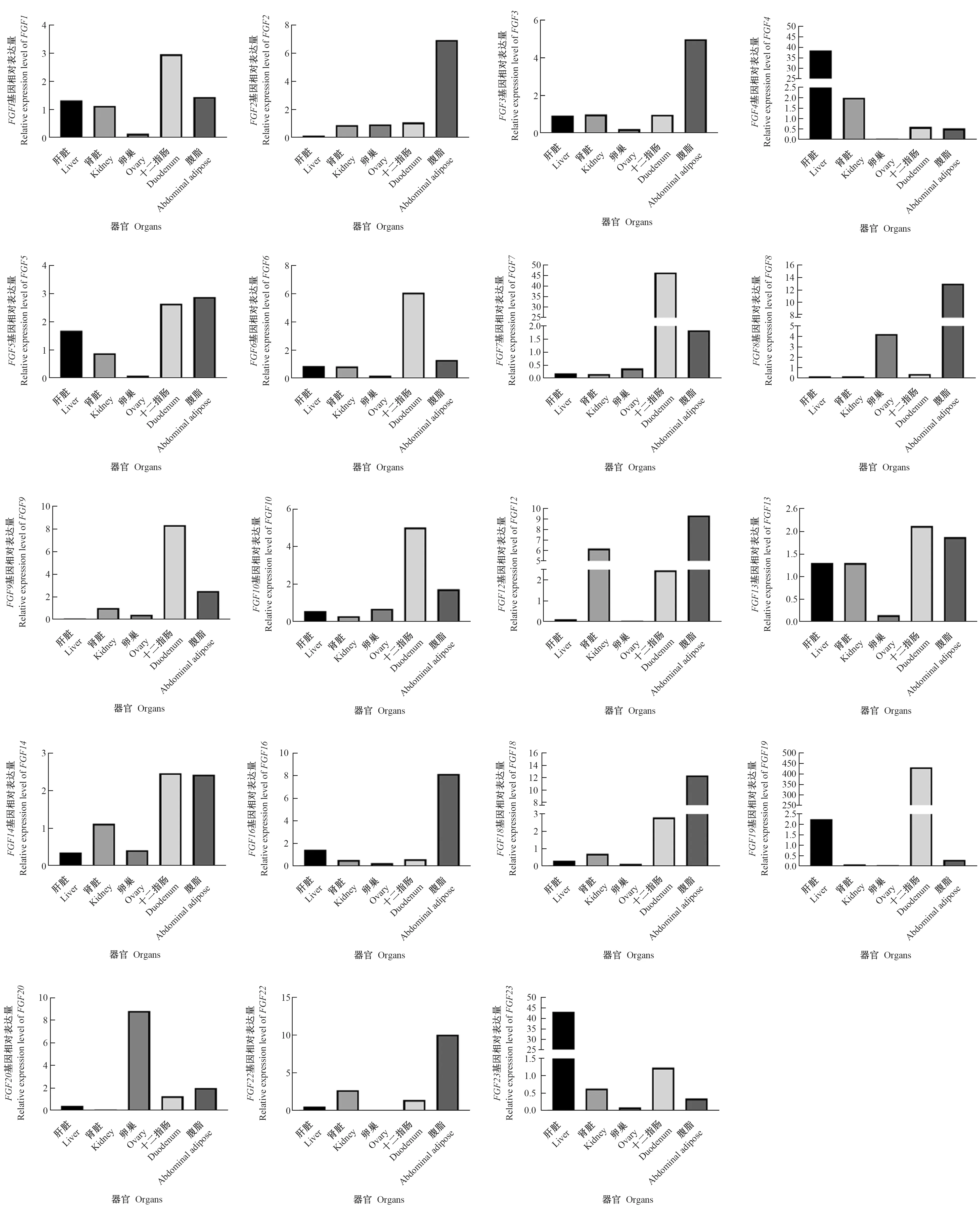
图5 鸡FGF家族基因在不同器官中的表达分析
2.6 鸡FGF家族基因在鸡肝脏中的表达模式
使用实验室前期卢氏鸡产蛋前期(20周龄)和产蛋高峰期(30周龄)肝脏转录组数据,探讨鸡FGF家族基因在鸡肝脏中的表达特性,如表2所示。转录组数据中有12个FGF家族基因在鸡肝脏中表达。其中,FGF19和FGF23基因在30周龄的FPKM值极显著高于20周龄。利用qRT-PCR进一步在卢氏鸡20周龄和30周龄的鸡肝脏中对FGF19和FGF23基因表达水平进行验证,如图6所示。FGF19基因在30周龄鸡肝脏中的相对于GADPH表达量显著高于20周龄,而FGF23基因在20周龄和30周龄鸡肝脏中相对于GADPH表达量无显著变化,但在30周龄有升高趋势,这与转录组结果一致。
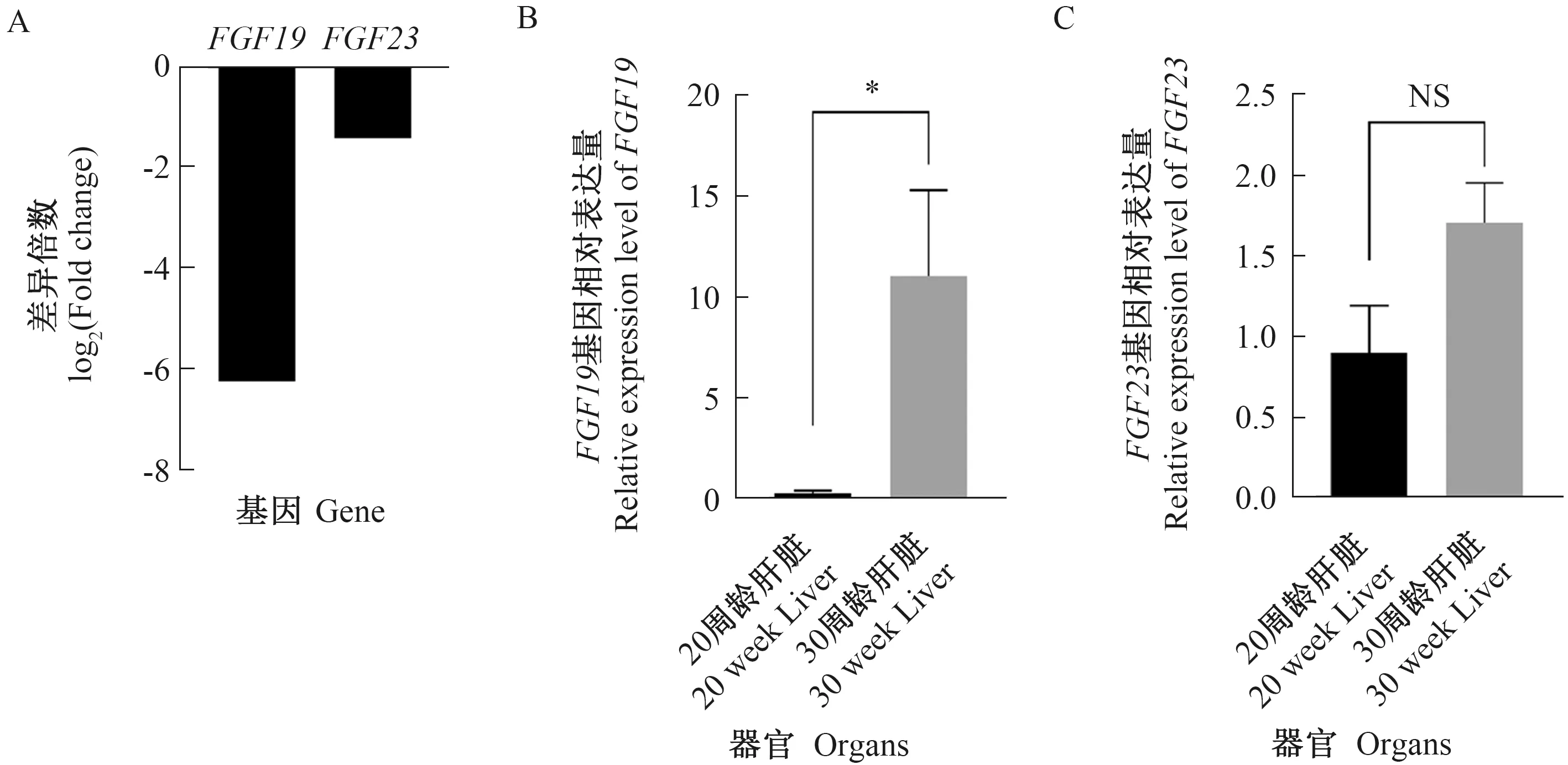
A: FGF19和FGF23基因在转录组数据中的变化倍数(20周龄/30周龄);B、C:FGF19和FGF23基因在20周龄和30周龄卢氏鸡肝脏中的相对表达水平。误差线表示标准差,*表示P<0.05,NS表示P>0.05。
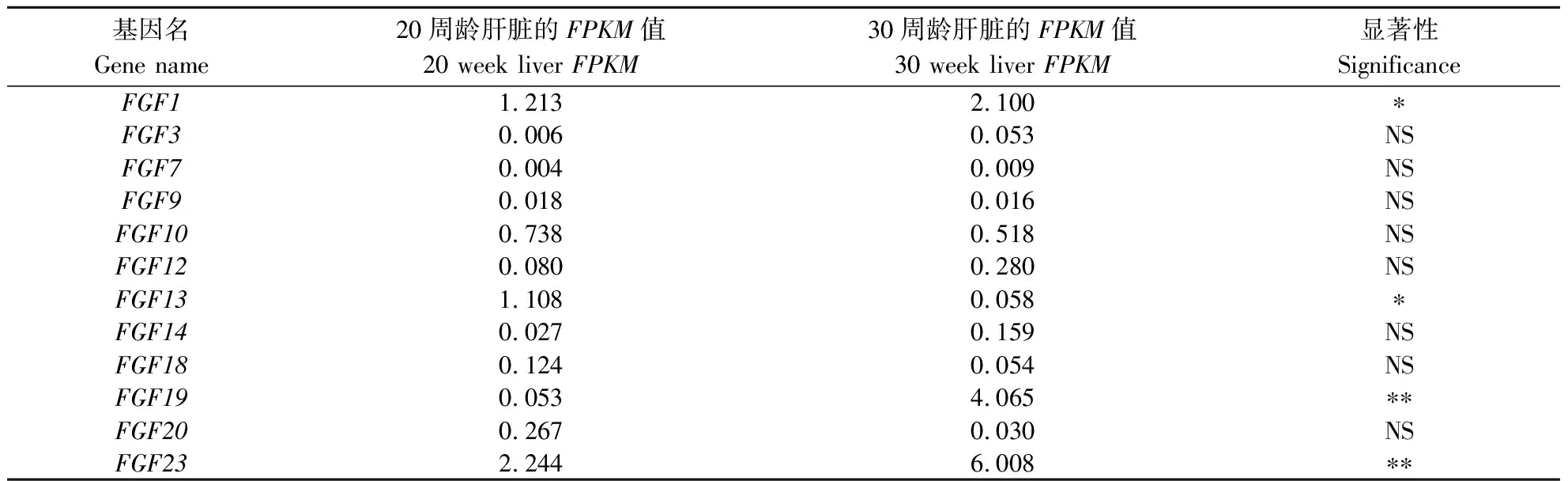
表2 鸡FGF家族基因在卢氏鸡肝脏转录组测序数据中的FPKM值
2.7 17β-雌二醇对鸡FGF家族基因表达的影响
使用实验室前期雌激素处理个体的肝脏高通量数据,探讨雌激素对鸡FGF家族基因的表达特性。在高通量数据中查找发现(图7-A),雌激素处理组FGF19和FGF23基因的表达丰度显著高于对照组。为了进一步验证雌激素对鸡FGF家族基因表达的影响,用100 nmol·L-1的17β-雌二醇处理LMH细胞系24 h。qRT-PCR分析结果表明,雌激素可显著上调雌激素应答标志基因(ApoVLDLⅡ)的表达,表明外源雌激素发挥了生物学功能(图7-B)。与对照组相比,雌激素处理组FGF19基因的表达水平显著上调,而FGF23基因的表达显著下调(图7-C~D)。
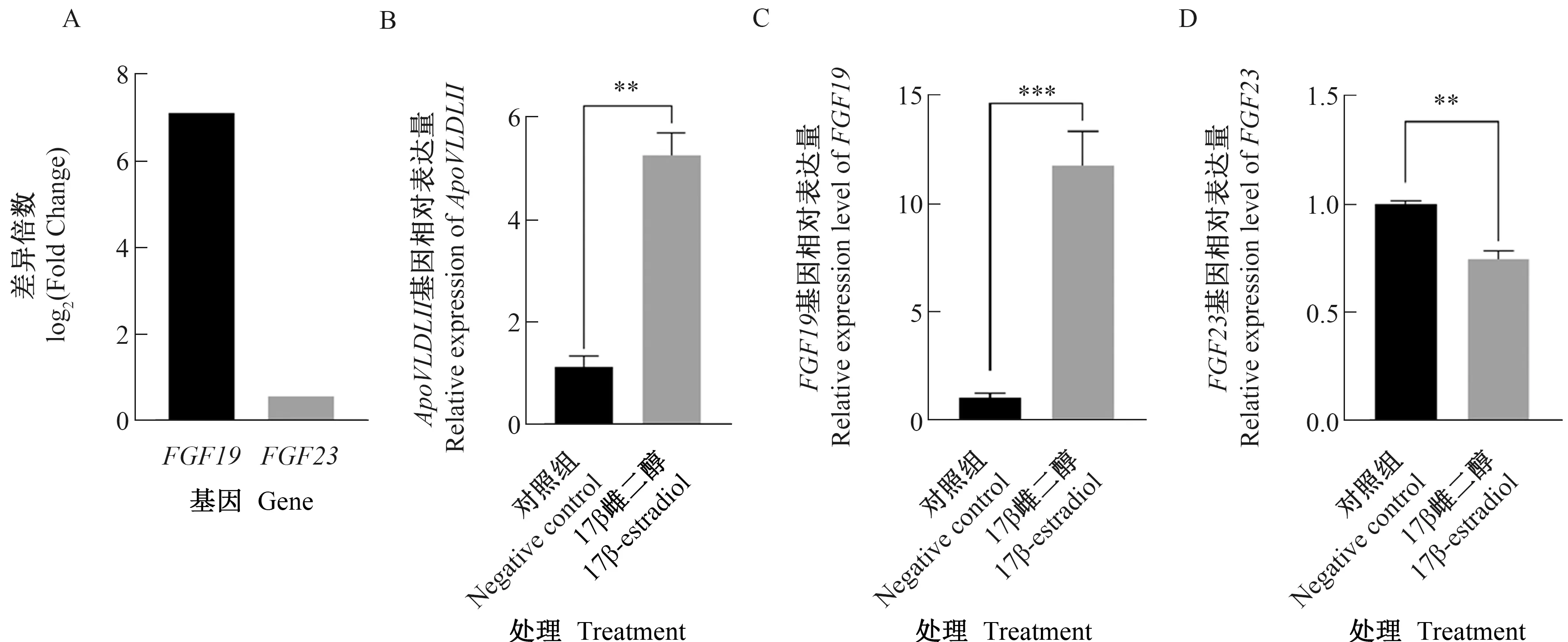
A:FGF19和FGF23基因在雌激素处理个体肝脏高通量数据中的变化倍数(雌激素处理组/对照组);B:雌激素处理LMH对标志基因ApoVLDLII表达的影响;C,D:分别表示雌激素处理LMH对FGF19和FGF23基因表达的影响。误差线表示标准差,**表示P<0.01,***表示P<0.001。
2.8 鸡FGF19基因遗传变异位点与不同阶段产蛋量的关联分析
使用实验室保存的900只固始鸡重测序数据对FGF19基因进行分析,获得5个SNP位点,分别是rs17814792、rs17816980、rs17814792、rs17814446和rs17811770,除了rs17814792和rs17814792在固始鸡群体中有2种基因型外,其余3个SNPs位点均有3种基因型存在(表3)。将这5个位点的不同基因型分别与固始鸡不同阶段的产蛋数进行关联分析。如表4—表8所示,rs17814792与21~25周龄和21~43周龄产蛋量存在极显著相关、与26~30周龄产蛋量存在显著相关,rs17816980与36~43周龄产蛋量存在极显著相关,rs17817557与21~25周龄和21~43周龄产蛋量存在极显著相关、与26周龄~30周龄产蛋量存在显著相关,rs17814446与不同时期的产蛋量不差异,rs17811770与21~25周龄和21~43周龄产蛋量存在显著差异。
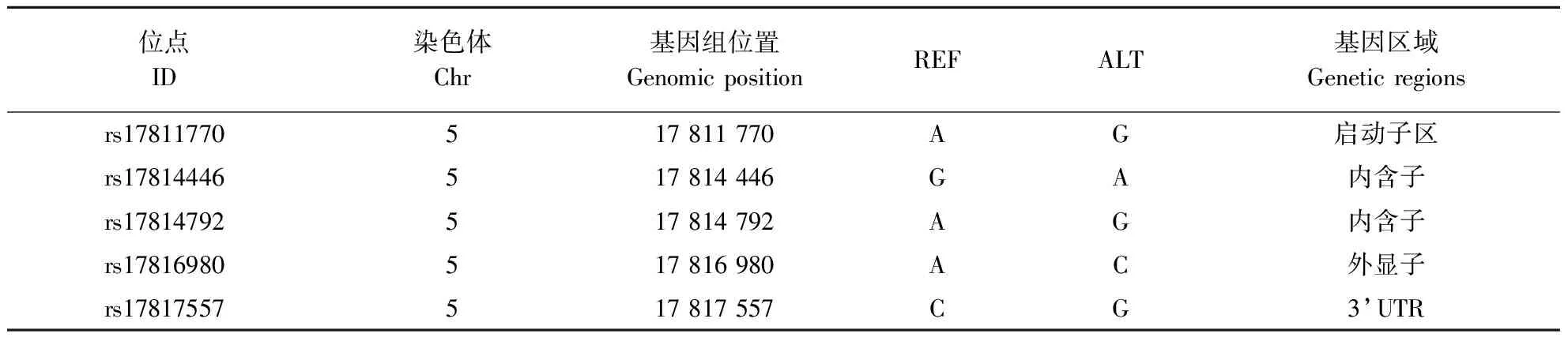
表3 FGF19基因上SNP位点信息
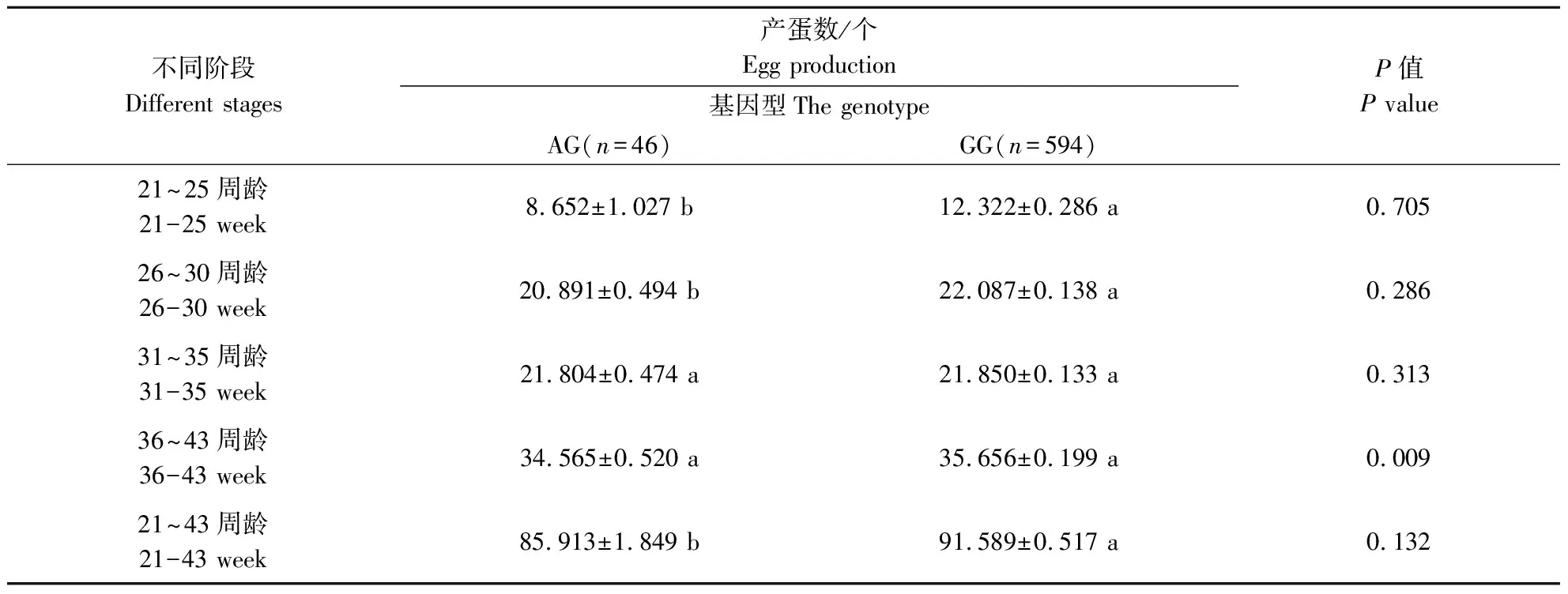
表4 FGF19基因遗传变异位点(rs17814792)与固始鸡产蛋量的关联分析
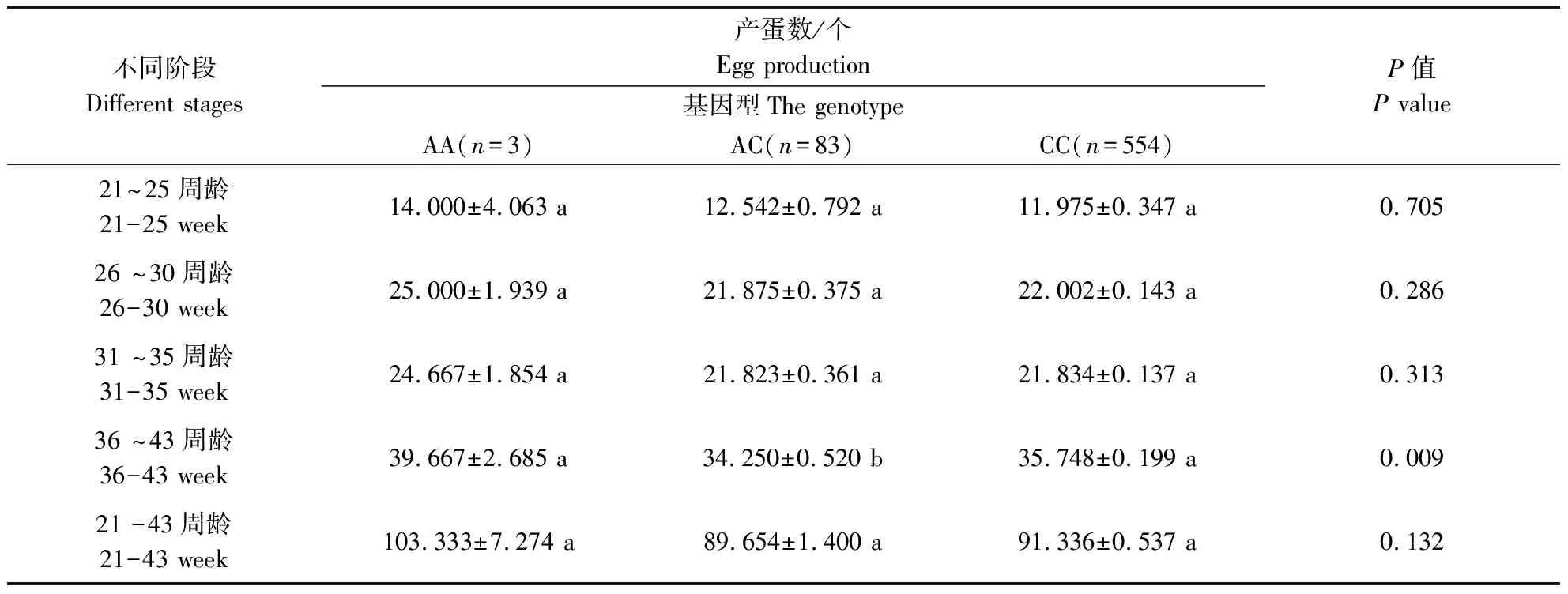
表5 FGF19基因遗传变异位点(rs17816980)与固始鸡产蛋量的关联分析
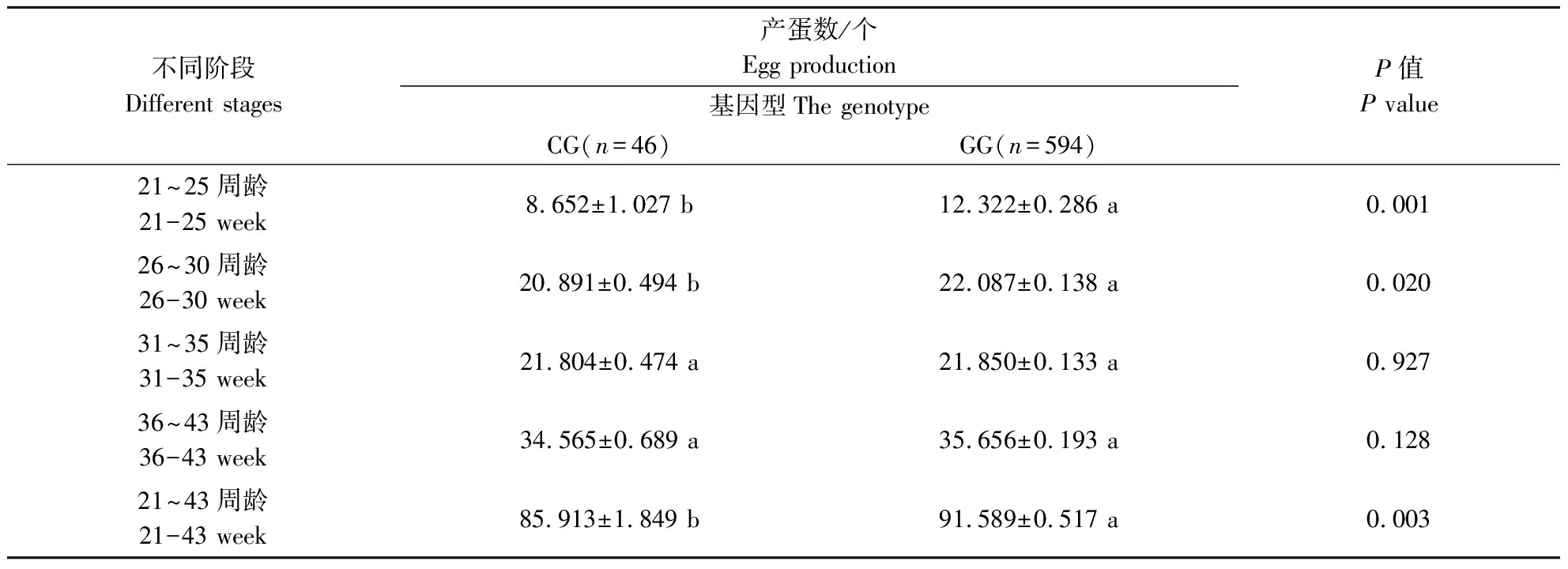
表6 FGF19基因遗传变异位点(rs17817557)与固始鸡产蛋量的关联分析
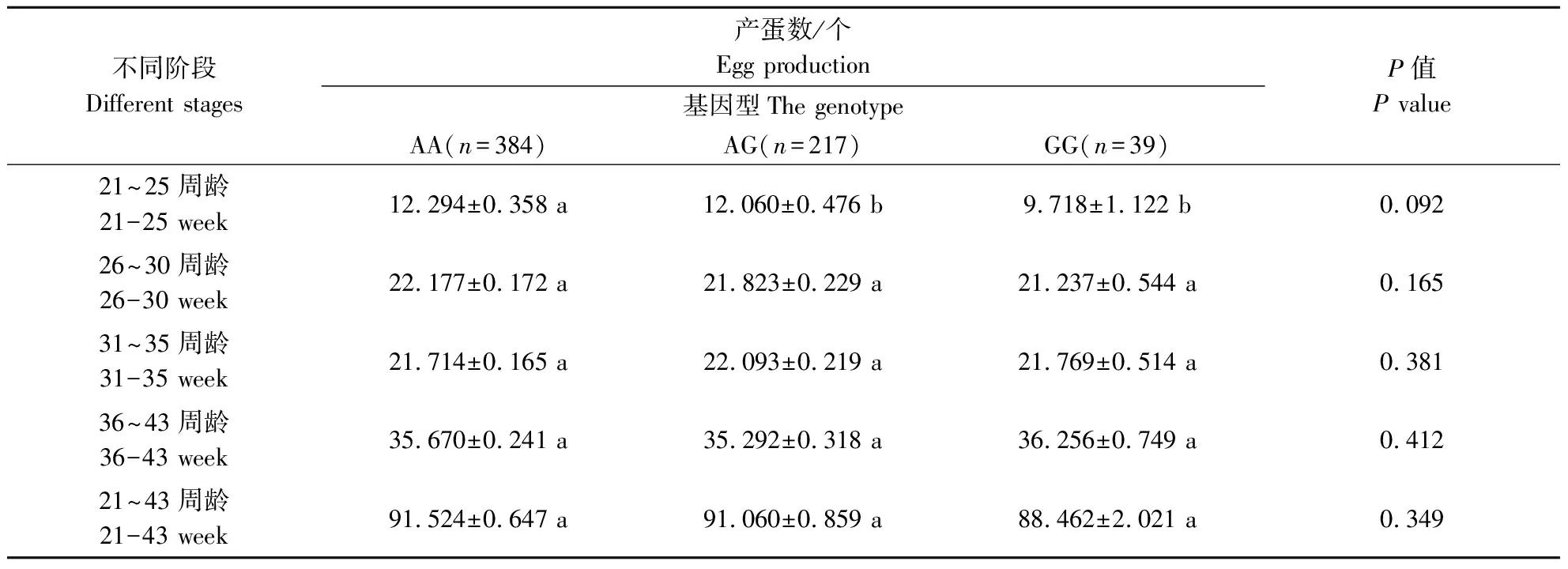
表7 FGF19基因遗传变异位点(rs17814446)与固始鸡产蛋量的关联分析
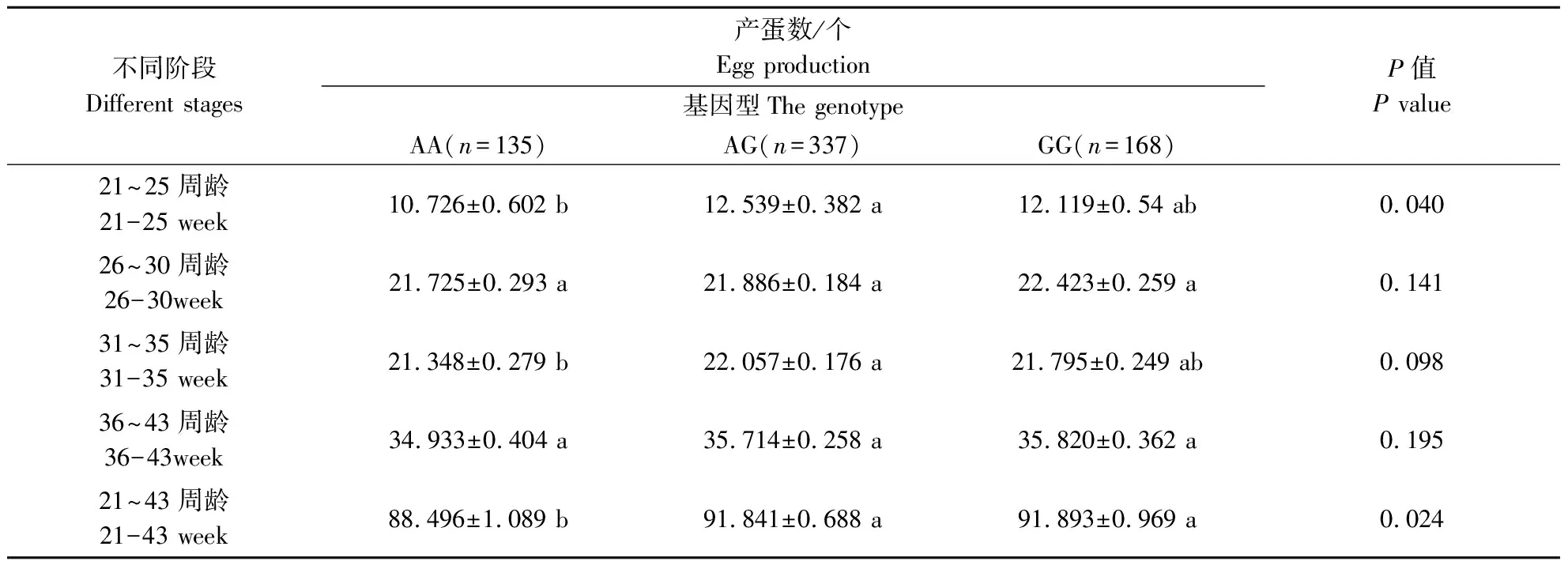
表8 FGF19基因遗传变异位点(rs17811770)与固始鸡产蛋量的关联分析
3 结论与讨论
FGF家族是高度保守的多基因家族,迄今为止已经在多个物种中被鉴定,在个体发育中起着重要作用,可以调节动物的发育和生理过程[25-26]。目前,FGF家族成员在人,小鼠、牛、绒山羊、斑马鱼、拟南芥和人参等多个动植物中已有研究。本研究首次对鸡FGF家族的生物学特性及雌激素对该家族成员的表达调控进行了系统研究。
本研究利用鸡基因组数据库中已注释的19个FGF家族基因进行生物信息学分析发现,该家族均具有SVAVGVVAIKGVKSGLYLAMNKKGKLYGS的保守序列和1个相似的FGF功能结构域。此外,FGF19在人上有跨膜区,而在鸡和小鼠上没有跨膜区;在系统进化树分析中,FGF19在人、小鼠和鸡不在同一小支。这表明FGF19可能在3个物种中的生物学功能不同。
为更深一步了解FGF家族基因成员,利用10个鸡品种的重测序数据对该家族基因成员进行主成分聚类分析,19个基因在基因组范围全部SNP位点可以将蛋鸡和肉鸡分类,推测该家族可能对鸡繁殖或者生长性状形成有重要的影响。ANDERSON等[27]研究表明,FGF3和FGF4基因在小鼠的发育过程中起着重要的作用。FGF4基因在肝脏表达量最高,且FGF4基因能够增强脂肪酸氧化、减少肝细胞凋亡和减轻肝损伤[28],影响肝脏脂代谢。FGF16基因在腹脂中表达量较为丰富。HUANG等[29]研究发现,山羊FGF16基因通过受体FGFR4表达介导脂肪细胞分化,暗示FGF16基因在脂肪形成中发挥着一定作用。PORTELA等[30]在健康牛闭锁卵泡的研究中,检测到黄体细胞FGF18基因高表达,推测FGF18基因可能参与颗粒细胞的凋亡。卵巢发育相关研究表明,FGF2、FGF7以及FGF10等基因具有促进有丝分裂的作用。PORTELA等[31]证明了FGF18基因能促进细胞凋亡,最终导致卵泡闭锁。
目前,已经报道了FGF家族各成员在多种动物中各有不同的表达特性[32],具有明显的器官特异性,说明该家族可能参与不同器官的生长发育。本研究发现,FGF基因在各器官中均有表达,大部分基因在十二指肠中表达量最高;十二指肠是小肠消化吸收的重要部位,推测其在鸡生长发育中具有重要作用。有研究证明,FGF13和FGF14基因与牛的生长相关,FGF4和FGF23基因在肝脏中表达量较高[7-8]。此外,FGF23基因在哺乳动物的骨中表达量显著高于其他组织[33-35],在肝脏中表达量极低。FGF23基因在鸡的各器官中广泛分布,肝脏表达量最高,在心脏和肾脏等中表达量相对较低[36]。FGF23基因通过AMPK/乙酰辅酶α羧化酶和ERK1/2胞内通路作用于骨骼肌细胞和肝细胞,从而影响游离脂肪酸和脂质的代谢过程,间接调节脂质代谢[37-39]。肝脏是鸡脂质代谢的中心场所,表明鸡FGF23基因在肝脏脂质代谢过程中发挥着重要的作用。
FGF19基因在基因30周龄鸡肝脏中的表达水平显著高于20周龄,而FGF23基因表达量无显著变化但在30周龄有上升的趋势。在产蛋高峰期,鸡肝脏中FGF19基因表达量显著高于产蛋前期。FGF19基因是FGF21和FGF23基因亚家族的成员,该家族成员都是营养代谢的重要调节器,对肝素的亲和力低,这使得其能够逃离细胞外基质,作为内分泌激素循环[40-41]。研究发现,FGF19基因作为一种回肠来源的肠因子,能够控制胆汁酸代谢[42]。陆江等[43]研究表明,胆汁酸可能抑制脂肪酸的从头合成,促进肝脏脂肪酸β-氧化,从而降低海兰褐蛋鸡血液和肝脏中的甘油三酯含量。KIR等[44]证明了FGF19基因刺激肝脏蛋白和糖原合成,但不诱导脂肪生成,FGF19基因激活了胰岛素独立的内分泌通路,调节了肝脏蛋白和糖原代谢。BHATNAGAR等[45]利用肥胖小鼠模型证实了FGF19基因抑制胰岛素激活肝脏脂肪酸合成,这是控制肝脏、血液和脂肪中的三酰甘油积累的关键过程。KIR等[46]还发现,FGF19基因诱导蛋白质和糖原合成并抑制肝脏中的糖异生,对肝脏代谢产生有益的作用。这些表明FGF19基因可能参与鸡肝脏脂质代谢。对于蛋鸡来说,脂肪在肝脏中合成以后,转化为极低密度脂蛋白定向转运到肝脏外。极低密度脂蛋白作为卵黄前体物质运输到卵巢内,形成卵泡,最终形成蛋黄。主成分分析结果显示,FGF19基因可以将蛋鸡和肉鸡分类,且FGF19基因上的5个SNP位点(rs17814446除外)均与固始鸡产蛋量显著相关。这表明FGF19基因可能通过调控肝脏脂质代谢从而影响蛋鸡的产蛋性能。
雌激素是机体代谢的一种重要调控因子,不仅可以调控卵黄前体相关合成基因的表达,还可以调控脂蛋白分解[46]。产蛋期雌激素可促进鸡肝中ApoB及其他卵黄前体物的合成。雌激素可上调青年鸡肝脏FGF19和FGF23基因的表达,在细胞水平上验证雌激素可调控FGF19和FGF23基因的表达,但雌激素处理LMH细胞后FGF19基因表达量显著升高,FGF23基因表达量显著下降。FGF23基因在细胞水平上的结果与高通量数据相反,推测FGF23基因在个体和细胞水平上的作用方式不同,具体的作用机制还需进一步研究。
FGF家族成员在肉鸡和蛋鸡品种形成中有重要贡献,各成员在肝脏、肾脏、卵巢、腹脂和十二指肠脂质代谢相关器官中均表达。FGF19基因能够将蛋鸡和肉鸡进行分类,在鸡产蛋高峰期肝脏表达量高于产蛋前期,且与固始鸡不同产蛋期产蛋数显著相关,暗示FGF19基因对鸡产蛋性能有重要的作用。本研究结果为进一步研究FGF19基因及其他成员的生物学功能及作用机制奠定基础。

