幽门螺杆菌感染与自身免疫性肝病关系的分析
李庆鑫 尹卿 关瑛琦 邵春红
自身免疫性肝病(AILD)是由针对自身细胞的机体免疫过度激活引起的一类肝病,包括AIH、PBC以及PSC[1-3]。有研究表明,AILD与微生物感染、生物异源物质、营养不良以及环境因素等关系密切[4]。Hp感染除与胃肠系统疾病相关外,尚有不少研究试图分析其与其他器官的关联[5-6]。本研究Hp感染对探讨AILD发生、发展的影响。
资料与方法
一、研究对象
回顾2015年9月—2022年2月期间于聊城市中医医院首诊AILD患者74例,其中男性43例、女性31例,年龄(58.2±12.5)岁。AIH、PBC及PSC诊断符合标准[7-8]。排除标准:①合并其他慢性肝病、梗阻性胆道疾病;②恶性肿瘤史;③近期抗生素、抑酸剂、X线钡剂及免疫抑制剂使用;④组织活检禁忌者。
二、Hp检测
使用HTY101 np测试仪(海得威生物科技有限公司,深圳)施行14C-UBT试验,评价标准:测试值100 dpm为Hp阳性。另有部分病例经胃镜(GIF-XQ-260型,Olympus Corporation,日本)下在胃窦部钳取适量组织,随即快速尿速酶试验(北京康美天鸿生物科技有限公司)并作病理组织学观察,当黏膜组织由黄色转为红色时为Hp阳性。
三、研究方法
记录病历资料。使用7180型生化分析仪(Hitachi公司,日本)检测肝功能;使用抗肝抗原自身抗体试剂(EUROIMMUN,德国)按照检测自身抗体;使用Simulset TM IMK免疫荧光试剂盒(BD公司,USA)经FACSCalibur流式细胞仪(BD公司,USA)按照ELISA法检测淋巴细胞亚群。入院后进行肝活检,固定、石蜡包埋随后连续切片染色,使用METAVIR评分系统评价肝组织纤维化分期及炎症活动分级[9]。
四、统计学方法
使用SPSS 24.0处理数据。根据资料类型,采用t检验或卡方检验比较。P<0.05为差异有统计学意义。
结 果
一、肝功能、自身抗体比较
74例AILD患者中AIH、PBC及PSC分别为34例(45.9%)、33例(44.6%)及7例(9.5%),依据14C-UBT结果分为Hp阳性组(44例,59.5%)、Hp阴性组(30例,40.5%)。如表1所示,自身抗体分析:与Hp阴性组相比,Hp阳性组ANA、AMA、SMA、ANCA、AMA-M2及LKM-1阳性比例明显增加(P<0.05)。
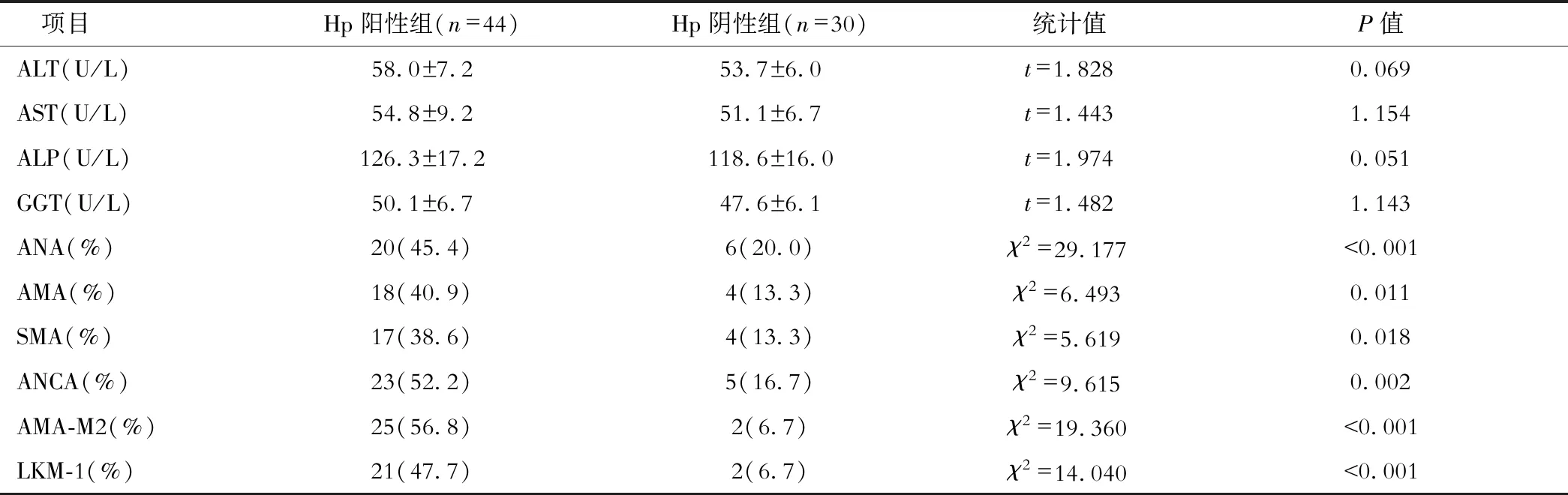
表1 Hp阳性组、Hp阴性组肝功能、自身抗体[%,M(P25,P75)]比较
二、淋巴细胞亚群比较
由表2可知,两组CD3+CD4+T细胞、CD4+/CD8+、CD3-CD19+B细胞、CD3+CD8+T细胞及CD3-CD16+CD56+NK细胞差异有统计学意义(P<0.05)。

表2 Hp阳性组、Hp阴性组淋巴细胞亚群(%)比较
三、肝组织肝纤维化分期、炎症活动分级比较
Hp阳性组≥F3期、≥G3级比例显著高于Hp阴性组(P<0.05,见表3)。

表3 Hp阳性组、Hp阴性组肝脏组织学特征(%)比较
讨 论
众所周知,肝功能水平与肝细胞受损情况关系紧密。不过作为常规检验指标,临床特异性一般。如本研究所示,Hp阳性、阴性组AILD患者各项肝功能指标被发现均不存在明显差异,因此需要结合其他项目来对不同分层AILD患者肝脏状态进行了解剖析。一方面,CD4+T细胞辅助T细胞转化成目标效应细胞,还赋予活化巨噬细胞等相关细胞功能。另一方面,CD8+T细胞抑制杀伤T细胞、阻碍B细胞抗体形成,对宿主细胞体液免疫形成抑制效应。随着CD4+/CD8+比例失调,因此造成的免疫功能紊乱形势更为紧迫。与此同时,NK细胞也可借助于细胞因子的大量释放来调控机体免疫功能,包括但不限于抑制B细胞分化、增殖。研究表明,Hp感染能够下调特异性1型辅助性T淋巴细胞因子以及T淋巴细胞抑制效应,参与介导体内肝组织实质损伤机制形成[10]。结合上述论点,本研究发现,Hp阳性组CD3+CD4+T细胞、CD4+/CD8+比例及CD3-CD19+B细胞升高,但CD3+CD8+T细胞及CD3-CD16+CD56+NK细胞呈现下降态势。既往两项研究(Utiyama等[11]、Vuerich等[12])得出类似结论:Hp阳性ALD病例T淋巴细胞亚群改变及NK细胞频率下降,致使自身免疫耐受机制缺失、B淋巴细胞活化增加,循环血液中自身抗体形成增加,随即对肝组织形成损害。
先前有研究报道,CHB患者感染Hp后并不会对肝脏组织学状态产生显著改变,关联性不显著,得出Hp感染并不能作为评价CHB肝组织病理改变程度的指标[13]。不过我们的研究发现与Hp阴性组相比,Hp感染AILD患者肝组织纤维化分期、炎症活动分级均显著提高,提示肝损伤程度增加。既往研究表明,Hp感染可增加肝细胞坏死风险,再与自身抗体结合后加重肝损伤,加速肝纤维化甚或是肝硬化病情演变[14-15]。
综上所述,超半数AILD患者存在Hp,与多种自身抗体增加和淋巴细胞亚群紊乱密切相关,可导致肝组织纤维化分期、炎症活动分级增加。
利益冲突声明:所有作者均声明不存在利益冲突。

