成像生物标记物预测肝细胞癌免疫治疗反应的研究进展
陈克敏
作者单位:200235 上海交通大学医学院附属瑞金医院放射科
肝细胞癌是全球癌症相关死亡的第三大原因。原发性肝癌是一组肝内异质性癌症,其中肝细胞癌(HCC)是最常见的肿瘤[1],占原发性肝癌的90%。虽然病毒性肝炎仍是我国HCC发生最常见的危险因素,但伴有代谢综合征的酒精相关性肝病(ALD)和非酒精性脂肪性肝病(NAFLD)正在增加,其中NAFLD已取代病毒性肝炎成为我国最常见的慢性肝病[2],这也是目前非病毒性HCC迅速增长的原因。
目前,早期肝癌的首选治疗方法仍是肝切除术、肝移植和局部消融,但仍有50%~60%的患者因确诊时处于晚期或因局部治疗后疾病进展而必须接受全身系统性治疗。随着肿瘤分子信号通路和肿瘤微环境研究的不断深入,目前靶向治疗和免疫治疗成为晚期 HCC 临床研究的热点[3]。2007年,索拉非尼通过血管内皮生长因子受体2 (VEGFR2)靶向RAS-RAF-MEK-ERK级联反应和血管生成的机制将HCC患者的中位总生存期从8个月提高到11个月,获批作为晚期HCC的一线治疗[4]。自那时以来,一系列靶向药物,如一线治疗的仑伐替尼、多纳非尼以及二线治疗的瑞戈非尼、卡博替尼、雷莫芦单抗,为晚期 HCC患者带来了更多的临床获益[5]。
除靶向治疗外,肝癌免疫治疗也逐渐成为目前研究的热点,并在临床上取得了积极的效果,部分患者在接受免疫治疗后生存周期延长,复发率降低,使晚期HCC的治疗方法发生了革命性的变化。2017年和2018年,纳武单抗[6][抗程序性细胞死亡1(PD-1)]和派姆单抗培溴利珠单抗(抗PD-1)[7]被批准作为治疗晚期HCC的二线治疗方法。随后,在2020年批准了纳武单抗联合伊匹单抗[抗细胞毒性T淋巴细胞抗原4(CTLA-4)]作为HCC的二线治疗方法。2020年,在3期IMBRAVE-150研究中,阿替利珠单抗[抗程序性死亡配体1(PD-L1)]与贝伐珠单抗[抗血管内皮生长因子(抗VEGF)]的联合治疗显示出了其高于索拉非尼的优势(中位无进展生存期为6.8个月,而索拉非尼为4.3个月),被加速批准作为治疗晚期HCC的一线治疗药物[8]。这些研究证明了HCC患者对免疫疗法的客观反应率(objective response rates)约为20%~30%,但仍有大约70%~80%的患者对这些治疗无反应。这可能是由于免疫受到一系列高异质性的肿瘤免疫微环境(TIME)、宿主和环境因素的影响,这些因素决定了抗癌反应的强度和时间[9-11]。Chen等[11]根据肿瘤浸润淋巴细胞(TILs)水平和免疫检查点(immune checkpoint)表达水平,将肿瘤分为免疫炎症型(immune-inflamed tumor),免疫豁免型(immune-exclude tumor)和免疫沙漠型(immnue-desert tumor)三种表型。其中免疫炎症型的肿瘤内部、基质、周围环境均有大量的免疫细胞浸润,处于激活或半激活状态。ICI容易在该免疫表型中发挥抗肿瘤效应。免疫豁免型肿瘤细胞周围也有大量免疫细胞存在,但免疫细胞不能渗透到肿瘤细胞内核,而是被限制在肿瘤细胞的外围基质。免疫沙漠型无论在肿瘤细胞内核和外围基质均缺乏T细胞。免疫沙漠型和免疫豁免型均被认为是非免疫感染表型。荟萃分析显示,TIL水平和PD-1/PD-L1表达与多种癌症对免疫检查点抑制剂(ICIs)的反应类型正相关[12-13]。然而,Pfister等[14]研究发现,非病毒性HCC,特别是NASH-HCC对免疫治疗反应较差,虽然肿瘤组织中存在高水平的CD8+/PD1+T细胞,但由于免疫监测受损,T细胞介导的组织损伤增强,触发了NASH小鼠向HCC的转变,这表明NASH-HCC的TIME具有其独特性。所以如何能筛选出免疫治疗优势人群的生物标志物,优化HCC患者的治疗方案成为了目前的研究重点。
如前所述,由于NAFLD/ NASH和代谢综合征等危险因素,非病毒性HCC的流行率正在上升。为了研究哪些HCC亚型对免疫治疗敏感,Murai等[15]通过多组学对113例非病毒性HCC肿瘤标本进行了分子和免疫学分析,将非病毒性HCC分为三个预后亚型。第Ⅰ类与TP53突变及Chiang[16]分子分类中的增殖亚型相关,该类型HCC肿瘤体积更大,门静脉浸润概率更高,GAGE分析显示,细胞周期和有丝分裂相关基因集随着FOXM1和AURKB上调而富集,是三类分型中预后最差的。第二类与Chiang分子分类中的IFN亚型[16],Hoshida分类中的S1亚型[17]相关,免疫细胞相关转录本表达显著增高,表明该类型免疫细胞向肿瘤的浸润增加,另外Murai等还发现他们所研究的非病毒HCC中细胞毒性T细胞衰竭和基质/TGF?激活信号显著增高,与第二类明显相关。第三类与Chiang分类中的钙黏蛋白相关蛋白1(CTNNB1)亚型和Hoshida提出的S3亚型相关,GAGE分析显示,免疫细胞激活相关基因耗竭而WNT-β-catenin信号通路基因GLUL、SPARCL1、AXIN2、GREB1上调,树突状细胞向肿瘤细胞迁移相关基因CCL4、CCL5下调,这与之前文献报道的HCC中CTNNB1激活导致树突状细胞迁移到TIME功能受损,导致肿瘤特异性细胞毒性T细胞减少(即免疫沙漠型)相符,其预后也是最好的。
Murai进一步发现,脂肪变性型HCC占非病毒性HCC的 23%,瘤内免疫细胞水平更高,呈现出免疫富集但免疫耗竭的TIME。ssGSEA和通路分析显示,脂肪变性型HCC的T细胞耗竭和基质信号以及TGF-β激活水平显著升高,这些都是肿瘤免疫耗竭的特征[18-21],另外还显示与T细胞耗竭有关的多种免疫检查点,癌症相关成纤维细胞(CAFs)(图1E)和参与巨噬细胞M2极化的转录本水平上调,免疫组化分析证实,在GPC3+的HCC细胞中PD-L1表达上调,且非病毒性肝癌标本中可见CAFs和M2巨噬细胞大量浸润。总的来说,脂肪变性型HCC表现出耗竭型T细胞增多、PD-L1高表达、TGF-?信号激活的特征。Cassidy等[22]分析了20例手术切除的HCC,发现组织学脂质沉积与化学位移MR成像测量的脂肪分数之间存在很强的正相关,这表明HCC的脂肪变性实际上可以通过临床无创MR成像来识别。Murai随后回顾性分析了30例接受阿替唑珠单抗和贝伐珠单抗治疗的晚期HCC患者,其中7例为脂肪变性型HCC。与非脂肪变性型HCC患者相比,脂肪变性型HCC患者对使用抗PD-L1和抗VEGF抗体的联合免疫治疗敏感(图1),患者的无进展生存期显著提高(在5.4个月的观察期间,脂肪变性HCC患者中无一例发生疾病进展)。
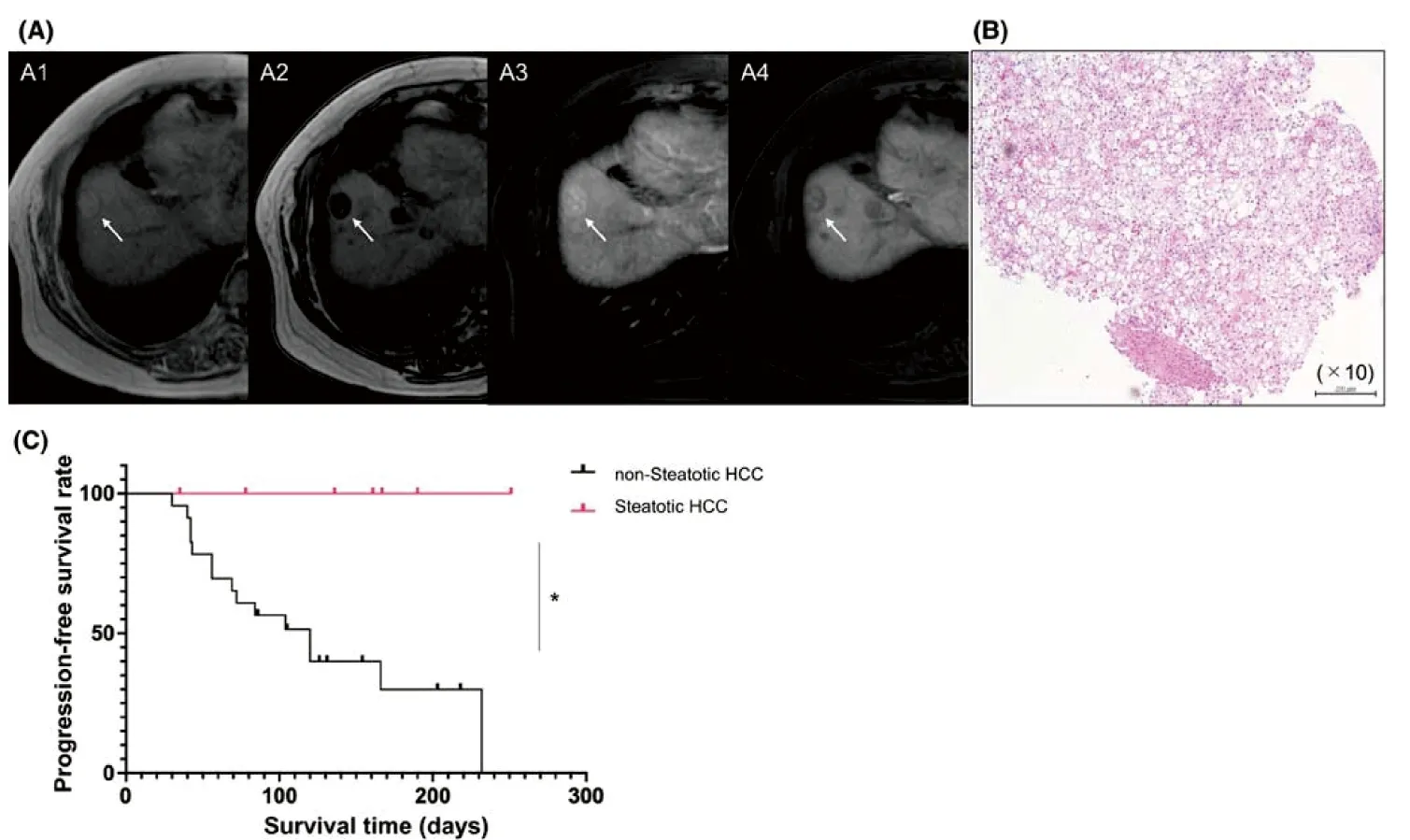
A:脂肪变性型HCC的典型MR。A1:MR T1W正相位图像显示膈肌下方肝S8段边界清晰的高信号肿块(箭头);A2:与A1同层面的T1W反相位图像显示肿瘤信号下降(箭头);A3:Gd-EOB-DTPA动脉期MR增强图像显示肿瘤动脉期明显强化(箭头);A4:Gd-EOB-DTPA肝胆期图像显示肿瘤呈低信号改变(箭头)。B:肿瘤穿刺标本的HE图像。C:无脂肪变性型和脂肪变性型HCC的无进展生存期(PFS)的Kaplan-Meier分析(*P<0.05)。
综上所述,非病毒性HCC肿瘤细胞中脂肪变性可能和免疫衰竭免疫治疗易感的TIME相关,这表明HCC肿瘤细胞内脂肪变性可能是预测免疫治疗疗效的新型成像生物标志物。
利益冲突声明:所有作者均声明不存在利益冲突。

