慢性肝病合并慢性肾脏病患者的临床特征分析
康玮玮 刘立伟 张嫄 钟蕊 冯丽丽 陈煜
慢性肝病每年在全世界造成200万人死亡[1],慢性肾脏病(chronic kidney disease, CKD)也是公认的全球公共卫生问题,二者均带来了较高的社会经济负担。临床上慢性肝病合并急、慢性肾脏疾病患者逐渐增多,占慢性肝病患者的20%~25%[2]。目前较多研究着眼于肝病合并急性肾损伤(acute kidney injury,AKI)的识别及评估,有数据显示肝硬化住院患者中约20%合并AKI,但慢性肝病合并CKD的现状也不容乐观,我国东部地区慢乙肝人群中CKD患病率为11.37%,肝硬化住院患者合并CKD的比率更是高达46.8%[3-5]。所以关注慢性肝病合并CKD患者肾脏疾病,可以更好地指导诊断、治疗及预后评估。
资料与方法
一、研究对象与纳入排除标准
本研究为前瞻性队列研究,纳入2020年6月至2021年12月在首都医科大学附属北京佑安医院肝病中心四科就诊的慢性肝病合并CKD患者65例。入组标准:①符合《慢性乙型肝炎防治指南(2019年版)》[6]《丙型肝炎防治指南(2019年版)》[7]《酒精性肝病防治指南2018更新版》[8]《非酒精性脂肪性肝病防治指南(2018更新版)》[9]《药物性肝损伤诊治指南》[10]《肝硬化诊治指南》[11]、美国胃肠病学学会(ACG)与慢性肝病基金会(CLDF)专家合作组《原发性胆汁性胆管炎的诊断与治疗》[12]中关于各种病因所致慢性肝病、肝硬化的诊断标准;②符合改善全球肾脏病预后组织(KDIGO)2012年发布的《慢性肾病的评估和管理:肾病概要:改善全球结果临床实践指南》[13]中CKD的诊断标准。排除标准:①需接受肾脏替代治疗如腹膜透析、血液透析或肾移植术后的患者;②各种影响肾脏功能的泌尿外科疾病,如肾动脉狭窄、肾积水、肾肿瘤、独肾等;③妊娠及哺乳妇女;④合并人类免疫缺陷病毒(HIV)感染。
二、研究方法
收集患者的一般资料、体液检查结果及辅助检查结果,主要包括患者性别、年龄、慢性肝病疾病程度、CKD的病因及分期。记录患者肝功能包括ALT、AST、白蛋白、总胆红素等,凝血功能,血常规,肾功能包括血尿素(UREA)、血肌酐(CREA)、肾小球滤过率(eGFR)等;肾脏病相关生物标记物包括血视黄醇结合蛋白、血β2微球蛋白,尿特种蛋白(尿免疫球蛋白G、尿转铁蛋白、尿微量白蛋白、尿α1微球蛋白、尿β2微球蛋白)、尿生化(尿肌酐、尿电解质)等;记录患者肾脏影像检查结果包括肾动脉阻力指数(renal artery resistance index,RRI)、肾脏声脉冲辐射力成像(ARFI)值等。
三、统计学方法
使用SPSS 26.0软件分析。偏态分析的计量资料以M(P25,P75)表示,比较采用Kruskal-Wallis检验,计数资料以例数(%)表示,组间比较采用卡方或Fisher精确检验。CKD进展与主要参数的相关性采用logistic回归分析。P<0.05为差异有统计学意义。
结 果
一、慢性肝病合并CKD患者肾脏疾病临床特征
纳入慢性肝病合并CKD患者65例,患者年龄为52.2(42.5,61.0)岁,男性48例(73.8%)。CKD病因分析,肾病综合征30例、肾炎综合征26例、慢性小管间质病4例、肝肾综合征5例。肾脏功能评估,CKD1期23例、CKD2期9例、CKD3期24例、CKD4期7例、CKD5期2例。
二、慢性肝病患者不同CKD分期肾脏功能变化的相关因素分析
65例患者根据肾功能CKD分期分为3组,CKD 1-2期组32例、CKD3期组24例、CKD 4-5期组9例,3组男性分别为28例(87.5%)、14例(58.3%)和6例(66.7%,χ2=6.453,P=0.038)。慢性肝病患者不同CKD分期肾脏功能比较见表1。
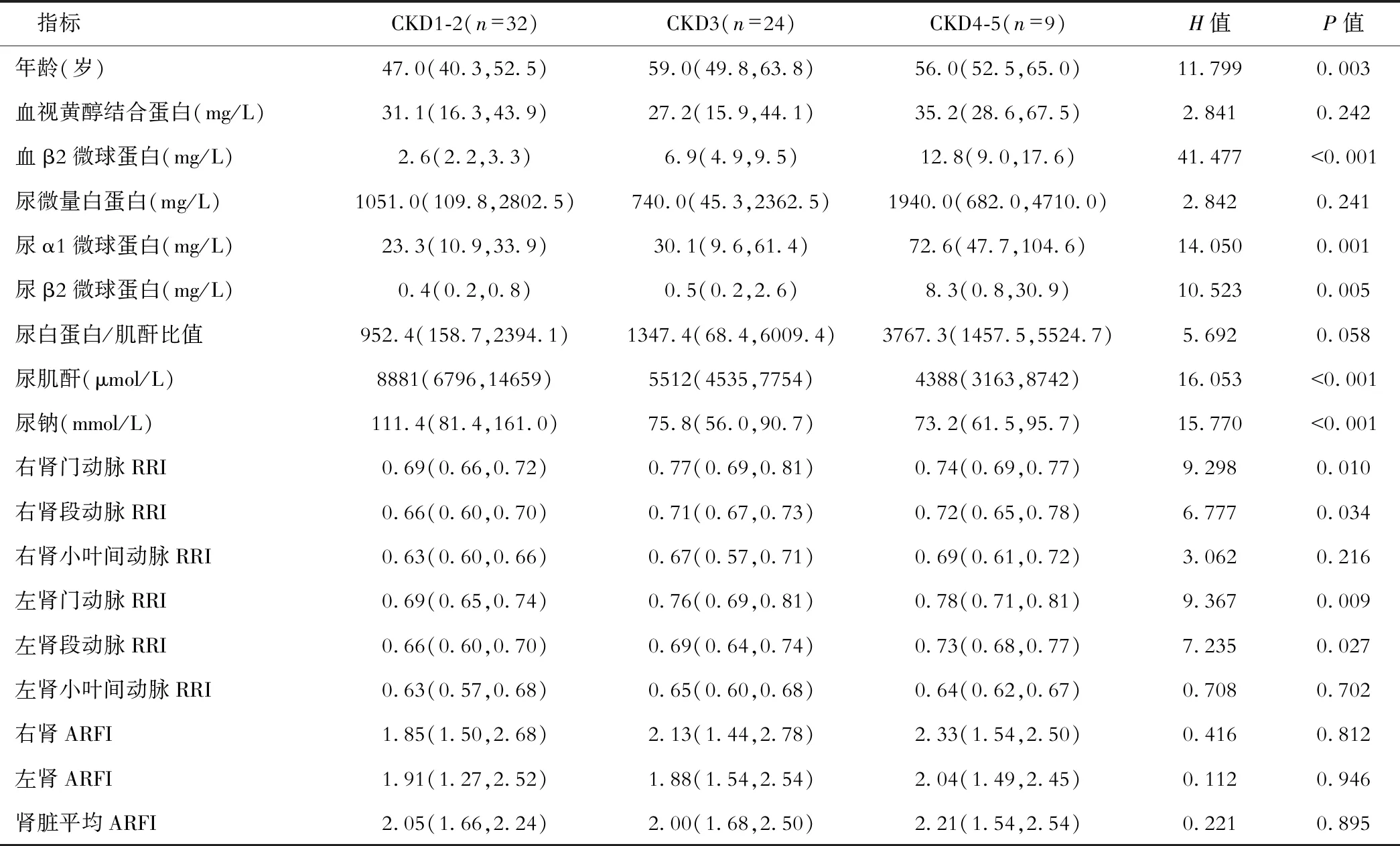
表1 慢性肝病不同CKD分期患者各指标比较[M(P25, P75)]
在慢性肝病患者中,CKD1-2期进展至CKD3-5期与血β2微球蛋白(H=41.477、P<0.01)呈正相关,与尿肌酐(H=16.053、P<0.01)、尿钠(H=15.770、P<0.01)呈负相关;CKD1-3期进展至CKD4-5期与尿α1微球蛋白(H=14.050、P=0.001)、尿β2微球蛋白(H=10.523、P=0.005)呈正相关;慢性肝病患者CKD进展与双侧肾门动脉RRI(右侧H=9.298、P=0.010,左侧H=9.367、P=0.009)、段动脉RRI(右侧H=6.777、P=0.034,左侧H=7.235、P=0.027)呈正相关。
三、慢性肝病患者CKD进展至4-5期的危险因素
在单因素logistic回归分析中,血视黄醇结合蛋白、血β2微球蛋白、尿α1微球蛋白、左肾段动脉RRI是慢性肝病患者CKD进展至4-5期的危险因素。在多因素logistic回归分析中,血β2微球蛋白和血视黄醇结合蛋白是慢性肝病合并CKD患者进展至CKD4-5期的风险因素,见表2。

表2 logistic回归分析慢性肝病患者进展到CKD4-5期的危险因素
讨 论
CKD会影响慢性肝病患者的临床表现、治疗策略和结局。所以要重视慢性肝病合并CKD患者疾病特征、评估肾功能及肾病进展风险。
原发肾小球疾病、糖尿病肾病、高血压肾损伤是CKD疾病的最常见病因[14]。慢性肝病合并CKD患者,除上述致病因素外,还需要考虑肝炎病毒相关性肾小球肾炎、肝硬化相关肾小球病、HRS等。慢性肝病尤其是肝硬化患者因存在出凝血功能障碍、侧枝循环丰富等问题,不易获取肾脏病理,肾脏疾病诊断的确立更多是依靠临床分析。本研究依据蛋白尿种类及定量对CKD病因进行临床分类,分为肾小球损伤(包括肾病综合征及肾炎综合征)、肾小管间质损伤、肝肾综合征。研究发现在慢性肝病不同阶段合并CKD均以慢性肾小球损伤为主,占比均超过80%。失代偿期肝硬化合并肾病综合征的患者,由于肝功能差、并发症多,很难耐受激素和(或)免疫抑制剂的治疗,势必会影响CKD的疾病进程。在CKD病因中HRS通常被认为是功能性肾功能不全,也有学者认为HRS患者肾损伤存在球管失衡、微血栓形成等病理改变。国内外文献报道肝硬化HRS发病率为8.0%~10.8%[15-17],本研究39例失代偿期肝硬化合并CKD患者中HRS占12.8%。目前这部分患者的治疗仍以控制原发病、血管活性药物应用及肝移植为主。
KDIGO指南关于肾功能的评估基于血肌酐及估算的肾小球滤过率,但对于慢性肝病患者而言,尤其是肝硬化、终末期肝病患者,营养不良可能伴随血肌酐下降,使患者的肾功能被高估。本研究发现慢性肝病患者随着CKD分期进展,血β2微球蛋白、尿α1微球蛋白、尿β2微球蛋白水平显著增加,尿肌酐、尿钠水平显著降低;较高的血β2微球蛋白水平、血视黄醇结合蛋白水平增加慢性肝病合并CKD患者进展至CKD4-5期的风险。肾脏调节机体水分及电解质平衡,尿钠和尿肌酐的降低提示肾小球滤过功能下降。β2微球蛋白、α1微球蛋白和视黄醇结合蛋白都是小分子蛋白质,可以自由通过肾小球滤过膜,在近端小管几乎全部重吸收并被分解,血中浓度升高提示肾小球滤过功能受损,尿中浓度升高是近曲小管早期受损的敏感指标[18-21]。HIV感染者较高的尿α1微球蛋白与CKD发病风险的增加和适度改善的CKD风险区分相关[22];美国学者的研究发现较高的血β2微球蛋白、尿β2微球蛋白水平均与更快的eGFR下降相关[23-24];英国的研究也得出相同结论[25]。
RRI是收缩期峰值血流速度与舒张末期血流速度之差除以收缩期峰值血流速度,通过多普勒超声在肾动脉各段测得,可作为CKD早期肾损伤的敏感检测指标[26]。本研究结果显示,慢性肝病患者随着CKD进展双侧肾门动脉及段动脉RRI逐渐增加,但小叶间动脉RRI结果尚不足以显示与CKD进展相关。ARFI是超声评估组织弹性的新技术,通过短时间的声波辐射力使局部组织产生位移,通过测得横向剪切波速度值的大小反映组织的硬度或弹性。Cui等[27]对比肾脏AFRI与肾脏病理纤维化相关性,与非纤维化组相比,弹性值在轻度和中度纤维化组明显增加,但差异无统计学意义。本研究也提示随着CKD进展ARFI值呈逐渐升高趋势,说明伴随肾小球硬化及小管间质纤维化的发生,肾脏硬度增加,但是差异无统计学意义,这可能与入组患者少、CKD病因复杂等因素有关。
慢性肝病患者肾功能的进展除与年龄增长、基础肾脏疾病进展等因素有关,也可能与肝病进展过程中,肝硬化相关肾小球疾病、HRS等疾病引起的有效循环血容量变化、神经内分泌功能变化、血流动力学变化相关[28];与失代偿期肝硬化患者更多合并腹水、消化道出血、细菌感染等并发症加速肾病进展有关[29];并且慢性肝病与CKD对视黄醇结合蛋白、β2-MG等生物标志物的影响机制复杂,所以判断慢性肝病合并CKD的患者肾损伤及肾功能能否照搬非肝病的CKD患者也有待商榷。
伦理声明:本研究方案于2020年06月经由首都医科大学附属北京佑安医院伦理委员会审批,患者均签署知情同意书。
利益冲突声明:所有作者均声明不存在利益冲突。

