稗JS12 种群对噁唑酰草胺的抗性水平及机理分析
杨 倩, 朱锦磊, 卫 甜, 刘怀阿, 吕 敏
(江苏里下河地区农业科学研究所,江苏 扬州 225007)
稗Echinochloa crus-galli是我国水稻产区分布最广泛、危害最严重的恶性杂草之一,严重威胁我国水稻的品质和产量。研究表明,田间稗种群密度达到4 株/m2时,优质水稻减产率高达55.2%,稻米加工与食味品质也严重下降[1-2]。江苏省是我国粮食主产区之一,水稻是江苏省最重要的粮食作物。近年来,受水稻机械化、轻简化栽培技术应用的影响,稻田杂草群落结构复杂多变,恶性杂草发生密度不断增加,稻田主要杂草的抗性持续上升,给水稻生产安全带来严重威胁[3-4]。
杂草对ACCase 抑制剂类除草剂产生抗性的机理主要包括两个方面:靶标抗性和非靶标抗性[7]。靶标抗性是指除草剂靶标酶基因ACCase突变,导致酶结构发生变化,使除草剂与之亲和力下降,从而杂草对除草剂产生抗性;或者靶标基因过量表达合成更多的酶蛋白,从数量上弥补被除草剂钝化的酶,从而补偿除草剂抑制而产生抗性。目前,在ACCase 基因的CT 结构域上,已报道了7 个保守氨基酸位点 (Ile-1781、Trp-1999、Trp-2027、Ile-2041、Asp-2078、Cys-2088 和Gly-2096) 的突变可以导致杂草对ACCase 抑制剂类除草剂产生抗性[7,12]。左平春[13]发现,稗对唑酰草胺产生高水平抗性的主要原因是抗性稗靶标基因ACCase上发生Ile-1781-Leu 和Trp-2027-Cys 突变。Fang 等[14]报道了安徽省稻田抗性稗种群ACCase基因上Asp-2078-Glu 的突变,对ACCase 抑制剂唑酰草胺、氰氟草酯和精唑禾草灵分别产生了1.7、5.7 和7.5 倍的低到中等水平抗性。非靶标抗性是指杂草通过减少除草剂到达靶标的量而引起的抗性,主要包括对除草剂的代谢能力增强、吸收和运输受阻以及对除草剂的隔离作用[15]。目前报道最多的是细胞色素P450 (cytochrome P450 monooxygenase,P450) 和谷胱甘肽-S-转移酶(glutathione-S-transferase,GST) 等代谢酶介导的代谢抗性[7,15]。细胞色素P450 基因CYP81A 家族参与杂草对ACCase 类除草剂的代谢抗性机制已经在水田稗Echinochloa phyllopogon[16-18]、稗[19]和硬直黑麦草Lolium rigidum[20]等禾本科杂草中被验证。此外,AmGSTF1 可以介导大穗看麦娘Alopecurus myosuroides对光合抑制剂和细胞分裂抑制剂等不同作用机理除草剂的多抗性[21]。马拉硫磷 (malathion)和4-氯-7-硝基-2,1,3-苯并氧杂二唑 (4-chloro-7-nitro-1,2,3-benzoxadiazole,NBD-Cl) 分别是P450 和GST 活性抑制剂,可以用来抑制植物体内相应代谢酶的活性,提高杂草对除草剂的敏感性,在杂草抗性研究中被广泛应用于证实P450或GST 参与的代谢抗性[22-24]。
1 材料与方法
1.1 供试材料
供试稗:稗敏感种群JS8 于2018 年采自江苏省扬州市邗江区 (119.47° E;32.49° N),疑似抗性种群JS12 于2020 年采自扬州市宝应县稻田 (119.38° E;33.34° N),种子采集后置于阴凉处自然风干并于4 ℃冰箱中储存。
试剂和仪器:马拉硫磷 (malathion) 和98%NBD-Cl,上海阿拉丁试剂有限公司;高效植物基因组DNA 提取试剂盒、2 × Taq PCR MarkerMix、普通琼脂糖DNA 回收试剂盒、pLB 零背景快速克隆试剂盒、大肠杆菌TOP 感受态细胞、FastQuant cDNA 第一链合成试剂盒 (with gDNAase) 和SuperReal 荧光定量试剂盒,北京天根生化科技有限公司;MiniBEST Plant RNA Extraction 试剂盒,宝日医生物技术 (北京) 有限公司;CFG 型智能光照培养箱,常州海博仪器设备有限公司;3WPSH-5000 型生测喷雾塔,南京农业机械化研究所;TC-96 梯度PCR 仪,杭州博日科技股份有限公司;EPS-300 电泳仪,上海天能科技有限公司;ChampGel 6000 全自动凝胶成像仪,北京赛智创业科技有限公司;ABI7500 Real Time PCR 扩增仪,美国应用生物系统公司。
1.2 试验方法
采用SigmaPlot 12.0 软件的双逻辑非线性方程y=C+ {(D-C)/[1 + (x/GR50)b]}计算抑制杂草50%生长所需的除草剂剂量 (herbicide rate causing growth reduction by 50%,GR50)。其中,x为除草剂剂量 (g/hm2),y为除草剂处理组鲜重与对照组鲜重的百分比,C和D分别代表剂量反应下限和上限,b表示在GR50处的斜率。抗性指数 (resistance index,RI) = 抗性种群GR50/敏感种群GR50。
1.2.2 稗抗性和敏感种群ACCase基因的克隆和比对 基于1.2.1 节抗性水平测定结果,选取敏感种群和推荐剂量下存活的抗性种群各6 株,剪取叶片组织并用植物基因组DNA 试剂盒提取稗的基因组DNA。由于稗是六倍体植物,其ACCase基因有6 个拷贝。参考Yang 等[10]的引物序列,使用3 对引物 (EcACCase-F1/R1、EcACCase-F3/R3 和EcACCase-F5/R5) 分别扩增稗ACCase基因的6 个拷贝,每对引物的扩增区域均覆盖了ACCase基因上7 个已报道的突变位点,引物由生工生物工程 (上海) 股份有限公司合成。PCR扩增反应体系为50 μL,包括:25 μL 2 × Taq PCR MarkerMix,1 μL 正向引物 (10 μmol/L),1 μL 反向引物 (10 μmol/L),21 μL ddH2O 和2 μL cDNA模板。PCR 反应条件为:95 ℃预变性3 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸90 s,重复35 个循环;最后72 ℃ 延伸 5 min。得到的PCR 产物经1%琼脂糖电泳检测,使用普通琼脂糖凝胶DNA 回收试剂盒回收PCR 产物,将其构建到pLB 克隆载体上,并转化至大肠杆菌TOP10感受态细胞中,将获得的新鲜菌液交由生工生物(上海) 股份有限公司进行双向测序并拼接。测序引物为pLB-F (forward: 5′-CGACTCACTATAG GGAGAGCGGC-3′) 和pLB-R (5′-AAGAACA TCGATTTTCCATGGCAG-3′)。为了尽可能多的获得稗ACCase基因的不同拷贝,每个DNA 样本至少挑选12 个单克隆菌落。测序得到的核苷酸序列文本使用DNAMAN 6.0 软件进行序列比对,并用Chromas 2.33 软件查看ACCase基因的测序峰图。
1.2.3 稗抗性和敏感种群ACCase基因表达量测定 将稗植株按照1.2.1 节的条件培养至2~3 叶期,取新鲜叶片0.1 g,按照植物RNA 提取试剂盒说明书方法提取抗性和敏感稗植株总RNA,反转录获得第一链cDNA。参照Fang 等[14]的荧光定量PCR 特异性引物F:CAAGGGAAATGGTTG GGTGG 和R:CTCATGGGAATCAAGCTGGC,以稗肌动蛋白β-actin作为内参基因 (F:GTG CTGTTCCAGCCATCGTTCAT;R:CTCCT TGCTCATACGGTCAGCAATA),测定ACCase在抗性和敏感稗植株中的表达量。唑酰草胺处理剂量为120 g/hm2,分别在除草剂处理前和处理后24 h 剪取新鲜叶片样品,用液氮冷冻并保存至-80 ℃冰箱备用,每个样品为来自6 株稗植株叶片的总和。荧光定量反应体系包括:10 μL 2 ×SuperReal PreMix Plus、0.4 μL 50 × ROX Reference Dye、1 μL 模板cDNA 以及10 μmol/L 的上下游引物各0.6 μL,加7.4 μL ddH2O 至终体积20 μL。荧光定量PCR 反应程序为:95 ℃预变性15 min;95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸32 s,循环40 次。试验结果采用2-△△Ct法分析ACCase基因在抗性和敏感植株中的相对表达量,每个种群3 个生物学重复,每个样本4 个技术重复。
1.2.4 P450 和GST 抑制剂增效试验 采用整株水平测定法[25]测定P450 抑制剂马拉硫磷和GST 抑制剂NBD-Cl 处理后敏感和抗性稗种群对唑酰草胺的敏感性。马拉硫磷和NBD-Cl 分别用去离子水和丙酮溶解,然后用0.2%吐温-80 水溶液分别稀释至1 000 和300 g/hm2[11]。根据预试验结果,单独喷施上述剂量的抑制剂对稗草的生长无显著影响。将稗植株按照1.2.1 节的条件培养至3 叶期,分别用马拉硫磷和NBD-Cl 提前1 h 和48 h 进行预处理。然后按照1.2.1 节的梯度剂量和方法喷施唑酰草胺,以无抑制剂唑酰草胺处理组为对照组,于药剂处理后21 d 剪取植株地上部分并称量鲜重,计算各处理组抗性和敏感稗种群对唑酰草胺的抑制中量GR50。每个试验重复2 次,每个处理剂量重复3 次。
1.2.5 稗JS12 种群对ACCase 抑制剂的交互抗性测定 选取与芳氧苯氧丙酸类 (aryloxyphenoxypropionates,APPs) 的唑酰草胺相同作用机理的4 种除草剂,包括APPs 类的氰氟草酯、精唑禾草灵,环己烯酮类 (cyclohexanediones,CHDs) 的烯草酮,以及新苯基吡唑啉类 (phenylpyrazoline,DEN) 的唑啉草酯。按照1.2.1 节的方法将稗JS8 和JS12 种群培养至2~3 叶期进行茎叶喷雾处理。按照每种除草剂的有效成分用量设置梯度剂量,对JS8 种群喷施氰氟草酯的剂量分别为0、1.30、3.89、11.67、35 和105 g/hm2;对JS12 种群的施药剂量为0、3.89、11.67、35、105 和315 g/hm2;精唑禾草灵的剂量分别为0、0.26、0.77、2.3、6.9、20.7 g/hm2和0、0.77、2.3、6.9、20.7、62.1 g/hm2;烯草酮的剂量分别为0、0.30、0.89、2.67、8、24 g/hm2和0、0.89、2.6、8、24、72 g/hm2;唑啉草酯的剂量分别为0、0.56、1.67、5、15、45 g/hm2和0、1.67、5、15、45、135 g/hm2。以清水处理为对照,每处理3 个重复。于药后21 d 剪取稗地上部分并称量鲜重,采用SigmaPlot 12.0 软件计算各处理的GR50,计算方法同1.2.1 节。分析JS12 种群对不同ACCase 抑制剂类除草剂的交互抗性。
1.2.6 稗抗性和敏感种群对水稻田其他除草剂的敏感性测定 选取与唑酰草胺不同作用机理的4 种除草剂,包括乙酰乳酸合成酶 (acetolactate synthase,ALS) 抑制剂类的五氟磺草胺、合成激素类除草剂二氯喹啉酸和氯氟吡啶酯,以及对-羟苯基丙酮酸双氧化酶 (4-hydroxyphenylpyruvate dioxygenas,HPPD) 抑制剂类的三唑磺草酮。按照1.2.1 节的方法培养幼苗至3 叶期时,分别按照每种除草剂田间最高和最低两个有效成分推荐剂量为处理剂量喷施。五氟磺草胺的处理剂量为15 和30 g/hm2,二氯喹啉酸的剂量为337.5 和450 g/hm2,氯氟吡啶酯的剂量为18 和36 g/hm2,三唑磺草酮的剂量为103.5 和135 g/hm2。于药剂处理后21 d 统计各处理稗死亡数并称量地上部分鲜重,分别按公式 (1) 和 (2) 计算死亡率 (Rm) 和鲜重抑制率 (I)。
式中:Rp表示植株死亡数;n表示植株总数;mt表示处理组鲜重;mc表示对照组鲜重。
1.3 数据分析
分别使用Excel 2010 和SPSS 20.0 软件进行数据统计及单因素方差分析,采用最小显著差数(LSD) 法进行差异显著性检验。
2 结果与分析
2.1 稗JS12 种群对噁唑酰草胺的抗性水平

图1 稗抗性和敏感种群对唑酰草胺的剂量-反应曲线Fig.1 Dose-response curve of susceptible and resistant Echinochloa crus-galli populations to metamifop
2.2 稗抗性和敏感种群的ACCase 基因序列分析
利用3 对引物 (EcACCase-F1/R1、EcACCase-F3/R3 和EcACCase-F5/R5) 从抗性种群JS12 和敏感种群JS8 中均成功扩增到目的片段。测序结果显示获得了稗ACCase基因的6 个拷贝,BLAST比对结果表明与NCBI 上已公开的稗ACCase基因核苷酸序列 (LC006070、LC006071、LC006072、LC006073、LC006074 和LC006075) 的同源性均大于99%。对比抗性种群JS12 和敏感种群JS8 的ACCase序列片段发现,两者在目前已报道的7 个保守位点处的核苷酸序列并无差异 (图2),说明靶标基因ACCase突变不是导致稗种群JS12 对唑酰草胺产生抗性的原因。
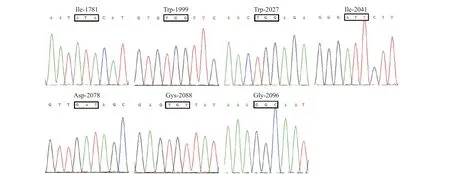
图2 稗抗性种群JS12 的ACCase1 基因在7 个已知抗性突变位点处的测序峰图Fig.2 Sequence chromatograms of ACCase1 at seven target mutation sites in JS12 population of E. crus-galli
2.3 稗抗性和敏感种群的ACCase 基因表达量分析
未用药处理时,稗敏感种群JS8 和抗性种群JS12 的ACCase基因表达量基本一致;唑酰草胺处理24 h 后,抗性和敏感稗草的ACCase基因表达量均有所下降,分别降低了10%和29%,但敏感种群的表达量仍显著高于抗性种群 (图3)。由此说明,靶标基因ACCase过量表达不是导致稗种群JS12 对唑酰草胺产生抗性的原因。除草剂处理后ACCase基因表达量下降可能与唑酰草胺处理剂量过高,抑制了基因表达有关。
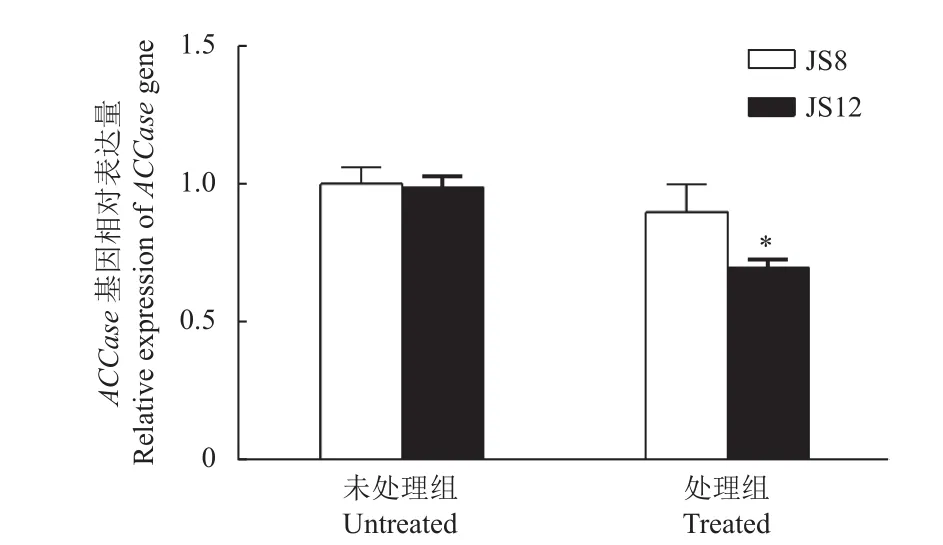
图3 噁唑酰草胺处理前后稗抗性和敏感种群的ACCase 基因相对表达量Fig.3 Relative expression of ACCase gene in susceptible and resistant E. crus-galli populations before and after metamifop treatment
2.4 马拉硫磷和NBD-Cl 对稗抗噁唑酰草胺种群抗性水平的影响
试验结果表明,代谢酶抑制剂能够显著提高抗性稗种群JS12 对唑酰草胺的敏感性,对敏感种群JS8 无显著性影响 (表1)。相比于唑酰草胺直接处理,喷施马拉硫磷和NBD-Cl 后,JS12 种群的GR50从227.90 g/hm2分别下降为77.51 和137.93 g/hm2;抗性指数由原来的13.71 倍分别降低到4.30 和9.03 倍,降幅分别为69%和34% (表1)。图4 也表明,在唑酰草胺推荐剂量120 g/hm2下,代谢酶抑制剂马拉硫磷和NBD-Cl 可以显著逆转稗JS12 种群对唑酰草胺的抗性水平。

表1 稗抗性和敏感种群在代谢酶抑制剂处理下对噁唑酰草胺的抗性水平Table 1 Resistance levels to metamifop under metabolic inhibitors pretreatment of tested E. crus-galli populations JS12 and JS8

图4 马拉硫磷和NBD-Cl 对稗抗噁唑酰草胺JS12 种群抗性水平的影响Fig.4 Effects of malathion and NBD-Cl on resistance levels of metamifop in E. crus-galli JS12 population
2.5 稗抗噁唑酰草胺种群JS12 对ACCase 抑制剂类除草剂的交互抗性

图5 稗抗噁唑酰草胺种群JS12 对ACCase 抑制剂类除草剂的交互抗性Fig.5 Cross-resistance of metamifop-resistant population JS12 to ACCase-inhibiting herbicides
2.6 稗抗性和敏感种群对水稻田其他除草剂的敏感性
稗敏感种群JS8 在喷施低推荐剂量和高推荐剂量的五氟磺草胺、二氯喹啉酸、氯氟吡啶酯和三唑磺草酮后死亡率均为100%,鲜重抑制率均大于90% (表2)。对于稗抗性种群JS12,五氟磺草胺在低推荐剂量下对其防效为0,鲜重抑制剂率低于50%;在高剂量下死亡率也仅有22.22%,鲜重抑制剂率为64.48%;二氯喹啉酸在低和高推荐剂量下均不能完全杀死JS12 种群,死亡率分别为83.34%和89.45%;氯氟吡啶酯和三唑磺草酮在低推荐剂量下,死亡率分别为76.39% 和76.71%,在高推荐剂量下死亡率均为100%。由此说明,稗JS12 种群对ALS 抑制剂类除草剂五氟磺草胺和激素类除草剂二氯喹啉酸均产生了不同程度的多抗性,其中对五氟磺草胺的抗性程度高于二氯喹啉酸,田间按推荐剂量施用这两种除草剂已经不能控制其抗性种群的生长;而对新型除草剂氯氟吡啶酯和三唑磺草酮的抗性仍在发展阶段,可以通过适当提高施药量来防治该抗性种群。

表2 稗敏感种群JS8 和抗性种群JS12 对其他除草剂的敏感性Table 2 Sensitivities to other herbicides in susceptible population JS8 and resistant population JS12 of E. crus-galli
3 讨论
靶标基因突变是杂草对ACCase 抑制剂类除草剂报道最多的抗性机制[7],但在本研究中,抗性稗种群的6 个ACCase基因拷贝均未发生氨基酸的改变,并且唑酰草胺处理后,敏感种群JS8 的ACCase基因表达量显著高于抗性种群JS12,这与其对唑酰草胺的抗性表型相反,说明ACCase基因突变和表达量变化并不是导致稗JS12 种群对唑酰草胺产生抗性的原因。因此,稗JS12 种群对唑酰草胺产生抗性的原因很可能是非靶标抗性机制。不同于靶标抗性机制可以通过单个基因的改变来降低杂草对除草剂的敏感性,非靶标抗性机制通常是多个基因家族共同积累、协同作用的结果,因此其机理更加复杂也很难在分子水平上进行鉴定[15,36]。左春平等[34]发现,在喷施细胞色素P450 抑制剂杀草强后,2 个抗性稻稗种群对唑酰草胺的GR50值分别由600 和297 g/hm2降至375 和134 g/hm2,证明稻稗对唑酰草胺的抗性与P450 活性增强有关。在本研究中,P450 抑制剂马拉硫磷和GST 抑制剂NBD-Cl 均可提高抗性种群JS12 对唑酰草胺的敏感性,其中马拉硫磷效果更显著,说明JS12 种群对唑酰草胺的抗性机制是P450 和GST 等代谢酶系介导的代谢抗性,且P450 在其中发挥主要作用。此外,抗性稗JS12 种群对芳氧苯氧丙酸类、环己烯酮类和新苯基吡唑啉类等ACCase 抑制剂类除草剂均产生了低水平的交互抗性,这与代谢抗性机制会导致杂草对除草剂产生广谱抗性的结论是一致的[36]。
本研究结果显示,稗JS12 种群不仅对ACCase抑制剂产生了抗性,对ALS 抑制剂类除草剂五氟磺草胺和激素类除草剂二氯喹啉酸也产生了多抗性,这可能与五氟磺草胺和二氯喹啉酸在江苏稻田的常年使用有关。五氟磺草胺和二氯喹啉酸是中国水稻产区防除稻田杂草的主要除草剂,在江苏省使用年限较久,关于稗属杂草对其产生抗性的报道很多[37-38]。由于JS12 种群对五氟磺草胺的抗性程度远高于二氯喹啉酸,所以,该种群很可能是先对五氟磺草胺产生了抗性,轮换使用唑酰草胺和二氯喹啉酸后又逐渐对三者产生了多抗性。此外,水稻田新型除草剂氯氟吡啶酯和三唑磺草酮在高推荐剂量下对抗性稗种群有较好的抑制效果,但相比于敏感种群,这两种除草剂在低剂量下仍不能完全杀死抗性稗种群,说明JS12 种群对这两种除草剂的抗性已经处于早期发展阶段,若不注意控制,迟早会发展成明显的抗性。研究表明,经多年除草剂选择压存活下来的杂草抗性具有遗传性,其抗性基因在停止使用该除草剂后仍然可以保留下来并遗传给下一代,导致多抗性种群的产生[39]。因此,在治理抗性杂草时,应避免简单的轮换其他类型的除草剂或单纯的加大用药量,防止多抗性种群的产生和快速发展,以免最终面临无药可用的困境。大量研究表明,采用多样化的除草策略对田间杂草管理尤其是抗性杂草治理更加有效和经济[40]。除采用化学药剂防除稻田杂草外,农艺学和生态学措施,如不同类型农作物轮作、加强稻田精整细作以及用网打捞杂草种子等方式[40-41],均可以有效提高农田生态系统多样性和降低田块中杂草种子库基数,达到综合防治杂草的目的。因此,在杂草治理过程中,应采取综合的管理体系,通过化学和非化学措施结合的方法,以减少对某一种或某一类除草剂的依赖性,延缓杂草抗性特别是多抗性的发展,保障农田生态系统的多样性和可持续性发展。