以糖尿病酮症就诊的线粒体糖尿病1例并文献复习
马国翠,王珍珍,戴武,曹永红
线粒体糖尿病(mitochondrial diabetes mellitus,MDM)属于特殊类型糖尿病,是一类临床上相对少见的单基因糖尿病,发生糖尿病酮症较少见。本研究报道1 例2020 年5 月入院时有糖尿病酮症、最后确诊线粒体糖尿病,分析其临床特征及诊治过程,并进行相关文献复习,以期有助于临床医师对该病的诊断和治疗。
1 病例资料
先证者,女,31 岁,2020 年5 月2 日因“多尿、多饮、体质量下降1 年余”入院。现病史:病人2018 年底出现多尿、多饮、体质量减轻,查随机血糖20 mmol/L,就诊社区医院予二甲双胍早餐前口服0.75 g 降糖治疗,自测血糖一直控制不佳,空腹血糖18 mmol/L 左右,为进一步调整血糖入住合肥市第二人民医院。病程中,有乏力、听力下降,无视物模糊、手足麻木发凉,近1年体质量下降3 kg。
家族史:母亲确诊糖尿病、50 岁左右发病,伴听力下降,现使用口服药控制血糖,具体不详;弟弟患糖尿病、20 岁左右发病、听力明显下降,现胰岛素降糖;1 姨娘及其子女患糖尿病,其儿子车祸死亡,姨娘为口服药降糖,具体不详;其子女降糖方案不详。
查体:体温36 ℃,脉搏78 次/分,呼吸18 次/分,血压110/72 mmHg,身高1.48 m,体质量42 kg,身体质量指数19.18 kg/m2。神志清楚,查体合作,发育正常,无脱水貌,无多毛及黑棘皮症,无皮下脂肪萎缩。头颈、甲状腺、心肺腹、四肢及脊柱查体(-)。双耳听力下降。四肢触觉、痛温觉、压力觉及震动觉均未见异常。
辅助检查如下。生化:葡萄糖30.56 mmol/L,钾3.91 mmol/L,钠137 mmol/L,氯101 mmol/L,二氧化碳22.0 mmol/L,计算血浆有效渗透压312.38 mOSM/L;尿常规:葡萄糖3+,潜血3+(月经期),酮体2+;血气:pH 7.383,碳酸氢根离子20 mmol/L,二氧化碳总量(TCO2) 21 mmol/L;胰岛自身抗体(胰岛细胞抗体、胰岛素抗体、谷氨酸脱羧酶抗体、酪氨酸磷酸酶抗体、锌转铁蛋白8 抗体)均阴性;乳酸2.6 mmol/L(参考值0.1~2.7 mmol/L);糖化血红蛋白14.5%;尿白蛋白肌酐比值(MA/CR) 33.1 mg/g(参考范围0~30 mg/g);血脂:三酰甘油1.09 mmol/L,总胆固醇3.47 mmol/L,高密度脂蛋白0.88 mmol/L,低密度脂蛋白2.33 mmol/L。病人酮症纠正后完善胰岛功能检查,结果如表1;双耳乳突CT未见明显异常;双耳纯音听域+声阻抗提示:双侧感应神经性耳聋;血管彩超:双侧颈动脉硬化伴右侧斑块形成;诱发电位:交感神经皮肤反应潜伏期延长;眼底检查提示近视眼底病变。

表1 线粒体突变糖尿病先证者馒头餐试验+C-P释放试验结果
考虑先证者起病年轻,体形消瘦,胰岛功能较差,存在典型的母系遗传,伴有听力减退,故予完善基因检测,结果如下:分析了临床全外显子及毗邻剪接区域,并且重点分析了听力异常、感应神经性耳聋、C-肽水平降低、酮尿等相关表型和遗传病的已知致病基因,未检出与受检者临床表型相关或部分相关的核基因组变异。基因组检测结果发现致病变异线粒体的A3243G 位点突变,先证者及其母亲的异质性变异频率分别为34.7%和0.74%。线粒体基因组检测结果(图1~3),基因组变异NC_012920.1:m.A3243G,受检者血液的线粒体中异质性变异频率为34.7%,受检者母亲血液的线粒体中异质性变异频率为0.74%。病人和母亲对研究方案已签署知情同意书。
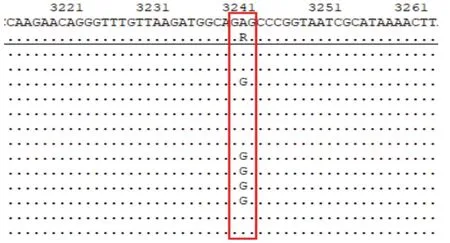
图1 线粒体突变糖尿病先证者基因变异频率结果

图2 线粒体突变糖尿病先证者的母亲基因变异频率结果
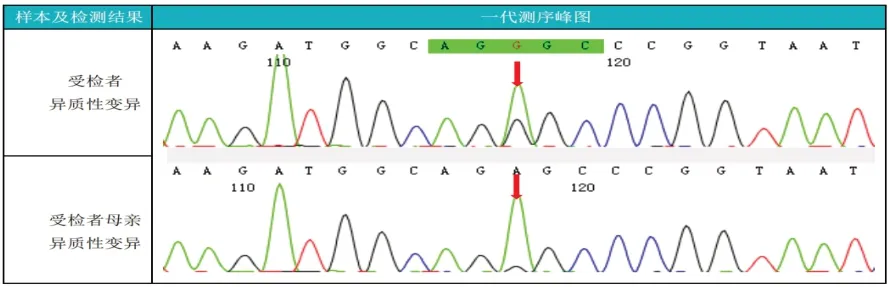
图3 线粒体突变糖尿病先证者及其母亲基因检测异质性变异结果
2 结果
结合病人临床症状及基因检测结果,最终诊断:线粒体糖尿病、糖尿病酮症。治疗方案:晚十点皮下注射甘精胰岛素20 U联合谷赖胰岛素早16 U中8 U晚8 U 餐前皮下注射,控制血糖。随访:先证者出院后半年随访,现降糖方案为甘精胰岛素14 U,谷赖胰岛素早10 U中6 U晚6 U,监测空腹血糖5~7 mmol/L,餐后血糖8~13 mmol/L,无听力进一步下降。
3 讨论
该先证者及母亲确诊线粒体突变糖尿病。目前已报道有20 余种线粒体基因突变与糖尿病的发病相关,如包括m.C12258A、m.T14709C[1]等,本例病人及母亲突变位点A3243G 是国际上公认最常见的突变点。据国内文献MDM 病人在有母系糖尿病家族史中占比5.28%,在随机选择的2 型糖尿病病人中占比0.64%[2]。MDM 常见临床特征有母系遗传、发病年龄早、胰岛β细胞功能逐渐减退、体形消瘦及该病具有很强的异质性,可表现为神经性耳聋、血乳酸水平增高等[3]。其原因如下:①线粒体DNA 主要来自卵母细胞,故MDM 以母系遗传为主,也可经父亲遗传[4]。线粒体DNA 缺少组蛋白保护及精确自我损伤修复机制,易突变,在糖尿病病人中mtD‑NA 突变率约为1.5%。②线粒体基因突变会加重胰岛β 细胞凋亡,减退胰岛功能[5]。③线粒体是体内能量代谢的来源。其基因突变会致呼吸链缺陷、氧化磷酸化及ATP 产生受影响,表现为累及能量需求较高的组织器官,如肌肉、内分泌腺等[6]。葡萄糖有氧氧化不足,无氧氧化增强,会导致乳酸合成增多,出现血乳酸水平增高。
该病例特点:青年女性,入院时有糖尿病酮症,体形瘦小,伴听力下降;母系有糖尿病家族史,母亲及弟弟听力下降;胰岛功能示胰岛素分泌高峰延迟、严重分泌不足;胰岛自身抗体阴性;有糖尿病并发症。病人及母亲基因检测为A3243G,符合MDM临床特征,确诊线粒体糖尿病。病人家系图示:病人母亲及姨娘有糖尿病,其子代均患糖尿病,符合MDM 的母系遗传,即一般是女方的子女肯定发病。此病人确诊MDM,子代患病风险较正常人明显增加,应关注子代血糖、及早干预。该病人此次以糖尿病酮症就诊入院,究其原因在以下几个方面:①病人起病时未能完整收集病史(尤其是体形消瘦的年轻病人,应注意详细询问家族史、有无伴随症状如听力下降等);②病人消瘦的青年起病,但首次就诊时未能完善胰岛功能检测,未及时启用胰岛素治疗;③临床医师尤其是非内分泌专业医师对特殊类型糖尿病的认知不够;④该病人入院后检查胰岛功能差,口服二甲双胍疗效不佳,最终出现此次就诊的急性并发症—糖尿病酮症。故明确糖尿病分型,对病人的治疗及预后至关重要。
先证者较母亲而言,发病年龄早且病情重,基因检测同为A3243G,原因可能与突变位点的异质性有关,两者的异质性变异频率分别为34.7%和0.74%。与芬兰的一项大规模研究A3243G 水平可能随后代逐渐增加一致[7]。异质性是指线粒体基因发生突变后,突变型mtDNA 和野生型mtDNA 混合在群体细胞中的情况[8]。人群中较低水平的mtDNA异质性是普遍存在的。但不同程度的异质性及不同位置的基因突变会出现不同的临床表型,其中mtDNA 突变异质性对表型的影响在当A3243G 更为显著[9]。在一般人群中,m.A3243G 的发生率最高报道为0.06%[10]。有些家系中,当A3243G 突变异质性在10%~30%时,同样的突变会导致母系遗传的糖尿病和耳聋[11]。随着A3243G 突变异质性增加,可表现为致命的儿童利氏综合征、慢性进行性眼外肌麻痹(CPEO)、糖尿病、耳聋及导致围产期死亡[12]。有研究表明A3243G 异质性水平与年龄呈负相关,利用血液异质性水平的年龄校正公式[13],年龄-校正后血液水平=(血液异质性)/0.977(年龄+12),计算校正后病人母亲异质性约为3.54%,仍远低于先证者异质性水平。有Meta 分析研究的结果示,线粒体A3243G 异质性与糖尿病发病显著有关,即异质性越大,发生线粒体糖尿病的概率越大,且在子代中发病年龄年轻化[14]。与该先证者及母亲的病情相符,故基因检测突变异质性有助于预测病人MDM病情及转归,有助于临床早期诊治。
MDM 治疗:(1)饮食及运动:MDM 病人常体形消瘦伴能量合成不足,饮食不宜限制过严,以免造成营养不良,加重病情。适当的锻炼可以改善线粒体功能[15]。为避免运动后血乳酸过度升高、蓄积,甚至乳酸酸中毒,不应剧烈运动。(2)降糖药应个体化治疗:①尚有一定胰岛功能的病人,可予促泌剂。餐后血糖未达标者,可加糖苷酶抑制剂。有研究[16]吡格列酮也可使用。②胰岛功能差、急性起病或危重病人,确诊后立即予胰岛素治疗。因MDM 为进行性胰岛β 细胞分泌缺陷,最终需胰岛素治疗。③避免双胍类降糖,因为二甲双胍通过抑制线粒体甘油磷酸脱氢酶抑制糖异生,可致乳酸酸中毒[17]。(3)其他:①辅酶Q10 能抗氧化及充当线粒体呼吸链的电子传递载体,改善线粒体功能。②硫辛酸通过保护线粒体膜蛋白而发挥抗氧化作用[18]。(4)基因治疗是根本治疗。相关研究报道使用基因编辑技术ZFN 和TALENs 成功在小鼠体内消除了线粒体中致病突变的DNA[19-20],但目前还未有关于基因治疗的人体试验。(5)避免耳毒性药物。
糖尿病病人的发病率较高,但实际临床工作中糖尿病的分型有时仍较难。故当存在发病年龄早、非肥胖体形、胰岛β 细胞功能障碍、母系遗传、伴有听力下降的临床特点时应考虑MDM 的可能,要详细询问病史,尽早完善听力专科及基因检测检查以明确诊断、制定合理诊疗方案,帮助病人控制血糖及并发症、延缓病程及改善预后。

