国产与原研复方缬沙坦氨氯地平片质量对比研究
赵欣,倪薇,宋帆帆,黄雅菲
缬沙坦(valsartan)属于血管紧张素Ⅱ受体拮抗剂(angiotensinⅡreceptor blockers,ARB)类抗高血压类药物[1],氨氯地平(amlodipine)属于钙离子通道阻滞剂(calcium channel blocker,CCB)类抗高血压类药物[2]。复方缬沙坦氨氯地平片(商品名:倍博特)是诺华公司开发的全球第一个由血管紧张素Ⅱ受体阻滞剂和钙拮抗剂构成的单片复方制剂,主要用于治疗原发性高血压[3]。研究表明,本品对近90%高血压病人达到良好的治疗效果[4]。目前,国内已有多家药品生产企业开发了复方缬沙坦氨氯地平片,其质量与原研制剂可能存在一定的差异性,进而会影响到临床治疗效果。为此,2020 年10 月至2022年2月本研究选择了南京市溧水区人民医院现有的国产与原研复方缬沙坦氨氯地平片,通过全面比较制剂的质量,评价二者质量的相似性程度。
1 材料与方法
1.1 仪器LC-20A 型高效液相色谱仪(日本岛津公司);MS204S 型万分之一电子天平(瑞士梅特勒-托利多公司);S220 型pH 计(瑞士梅特勒-托利多公司);Vision G2 Elite 8 型溶出试验仪(美国汉森公司);YD-35 型智能片剂硬度仪(天津市天大天发科技有限公司);KB-1型口崩片崩解仪(天津市天大天发科技有限公司)。
1.2 材料缬沙坦(中国食品药品检定研究院,批号100651-202006,含量99.0%);苯磺酸氨氯地平对照品(中国食品药品检定研究院,批号100374-202106,含量99.9%);复方缬沙坦氨氯地平片(原研制剂,批号BVW83,规格缬沙坦80 毫克/片、氨氯地平5 毫克/片);复方缬沙坦氨氯地平片(国产制剂,批号210421JB,规格含缬沙坦80 毫克/片、氨氯地平5 毫克/片);甲醇、乙腈均为色谱纯,磷酸为分析纯,纯化水自制。
1.3 方法
1.3.1色谱条件优化
1.3.1.1检测波长选择 依次取缬沙坦对照品溶液和苯磺酸氨氯地平对照品溶液,进行全波长扫描,结果显示,缬沙坦在273 nm 波长处有最大吸收,氨氯地平在237 nm 波长处有最大吸收,当检测波长选择为237 nm时,两种药物的检测灵敏度良好。
1.3.1.2柱温优化 分别考察了30 ℃、35 ℃和40 ℃,实验发现,随着柱温升高,两种药物的保留时间均缩短,分离度也减小,综合评估保留时间与分离度情况,确定柱温为30 ℃。
1.3.1.3流速优化 分别考察了0.8、1.0 和1.2 mL/min,实验发现,流速为1.2 mL/min时,两种药物的保留时间较短,分离度较小,而流速为1.0 mL/min 时,两种药物的分离度较好,确定流速为1.0 mL/min。
1.3.1.4色谱条件 色谱柱:Syncronis Hypersil BDS C8色谱柱(5 µm,4.6 mm×250 mm);流动相:乙腈-甲醇-水(磷酸调节pH 至2.8)为20∶33∶47(v/v/v);流速:1 mL/min;检测波长:237 nm;柱温:30 ℃;进样量:20 µL。
1.3.2方法学考察
1.3.2.1对照品溶液配制 称取缬沙坦对照品约80.0 mg 和苯磺酸氨氯地平对照品约7.0 mg(相当于氨氯地平5.0 mg),精密称定,加入到同一个棕色量瓶(100 mL)中,再加入少量乙腈,超声溶解,用流动相定容,摇匀,即得对照品储备溶液(含缬沙坦800 mg/L、氨氯地平50 mg/L)。精密移取上述对照品储备液2.5 mL 置于25 mL 棕色容量瓶中,用流动相定容,摇匀,即得缬沙坦与氨氯地平对照品溶液(每1 mL中含缬沙坦80 µg,氨氯地平5 µg)。
1.3.2.2供试品溶液配制 取复方缬沙坦氨氯地平片10片,精密称定,用研钵研成粉末状,精密称定相当于1 片重量的药物粉末(约相当于缬沙坦80 mg,氨氯地平5 mg)加入到100 mL 棕色量瓶中,再加少量乙腈,水浴超声10 min,放冷至室温,用流动相定容,摇匀,经0.22 µm 微孔滤膜过滤。精密移取续滤液2.5 mL置25 mL棕色量瓶中,加流动相至刻度,摇匀,即得供试品溶液。
1.3.2.3辅料溶液配制 称取除缬沙坦和氨氯地平以外的其他辅料压制成只含有辅料的片剂。取上述片剂10片,用研钵研成粉末状,精密称取相当于1片重量的辅料粉末置100 mL容量瓶中,再加少量乙腈,水浴超声10 min,放冷至室温,用流动相定容,摇匀,经0.22 µm 微孔滤膜过滤。精密移取续滤液2.5 mL 置25 mL 棕色量瓶中,加流动相至刻度,摇匀,即得辅料溶液。
1.3.2.4系统适用性试验 取“对照品溶液”“供试品溶液”以及“辅料溶液”按照“1.3.1.4”项下的色谱条件进样检测,记录色谱图。结果显示,缬沙坦和氨氯地平之间分离度良好(分离度R大于1.5),拖尾因子均在0.95~1.05,理论塔板数均大于8 000,辅料不干扰药物测定。
1.3.2.5线性考察 称取缬沙坦对照品约80.0 mg和苯磺酸氨氯地平对照品约7.0 mg(相当于氨氯地平5.0 mg),精密称定,加入到同一个棕色量瓶(100 mL)中,再加入少量乙腈,超声溶解,用流动相定容,摇匀,即得对照品储备溶液(含缬沙坦800 mg/L,氨氯地平50 mg/L)。精密移取对照品储备液,分别加入pH 1.2 盐酸溶液、pH 4.5 醋酸盐缓冲液、pH 6.8 磷酸盐缓冲液三种介质溶液并定容,配制成含有缬沙坦浓度依次为4.0、8.0、20.0、40.0 和80.0 mg/L 对照品溶液,氨氯地平浓度依次为0.25、0.5、1.25、2.5 和5.0 mg/L 对照品溶液。按照“1.3.1.4”项下的色谱条件进样检测,记录色谱图,以峰面积(A)为纵坐标,以药物浓度(C)为横坐标进行线性回归,绘制标准曲线,见表1。

表1 缬沙坦和氨氯地平在不同pH溶出介质中线性回归方程
结果表明,在三种溶出介质中,缬沙坦浓度在4.0~80.0 mg/L 范围内,氨氯地平浓度在0.25~5.0 mg/L 范围内与峰面积均呈良好的线性关系,符合测定要求。
1.3.2.6精密度试验 取“1.3.2.5”项下采用三种溶出介质配制的缬沙坦和氨氯地平对照品溶液(缬沙坦浓度均为20.0 mg/L,氨氯地平浓度均为1.25 mg/L),按照“1.3.1.4”项下的色谱条件均重复进样6 针,分别记录缬沙坦和氨氯地平的峰面积,计算各自的精密度(RSD)值。结果显示,在pH 1.2盐酸水溶液、pH 4.5醋酸盐缓冲液和pH 6.8磷酸盐缓冲液三种溶出介质中,缬沙坦的峰面积值的RSD(n=6)分别为0.6%、1.0%和1.0%,氨氯地平的峰面积值的RSD(n=6)分别为0.5%、1.0%和0.7%,RSD值均小于2%,说明精密度良好,符合测定要求[5]。
1.3.2.7滤膜吸附性考察 取复方缬沙坦氨氯地平片分别在3 种溶出介质中进行溶出度实验,在每种溶出介质中分别在5、15和30 min取出溶出液,各两份,一份经0.22 µm微孔滤膜过滤,另一份经4 000 r/min 离心10 min 处理,并用对应的溶出介质稀释适当倍数,按“1.3.1.4”项下色谱条件进行检测,分别记录缬沙坦和氨氯地平的峰面积,考察滤膜对药物的吸附性[6]。结果表明,在3 种溶出介质中,低、中、高3 种浓度的缬沙坦和氨氯地平溶液经滤膜过滤和离心处理,其峰面积几乎无差异,本研究采用0.22 µm微孔滤膜过滤溶出介质。
2 结果
2.1 溶解度测定分别取过量的缬沙坦和苯磺酸氨氯地平原料药混合物分别加入到pH 1.2 盐酸溶液、pH 4.5 醋酸盐缓冲液和pH 6.8 磷酸盐缓冲液三种介质溶液中,恒温水浴(37 ℃)振荡器中振荡72 h,离心,取上清液5 mL经0.22 µm滤膜过滤,用对应介质溶液稀释一定倍数,按照“1.3.1.4”项下色谱条件进行检测,分别记录缬沙坦和氨氯地平的峰面积,并计算缬沙坦和氨氯地平在三种介质中的溶解度[7],结果见表2。结果显示,缬沙坦的溶解度呈pH依赖性[8],在pH 6.8磷酸盐缓冲液中的溶解度较高,而在pH 1.2 盐酸溶液中的溶解度较低;氨氯地平的溶解度不具有pH依赖性。

表2 缬沙坦和氨氯地平在不同pH介质中37 ℃溶解度
2.2 质量对比研究
2.2.1硬度及崩解时限对比研究 分别取原研和国产复方缬沙坦氨氯地平片各10 片,通过硬度仪测定片剂硬度;另取上述两种制剂各10 片,通过崩解仪测定片剂的崩解时限[9],结果见表3。测定结果显示,两种复方缬沙坦氨氯地平片的硬度存在一定的差异,国产制剂硬度偏低,而崩解时限基本一致。
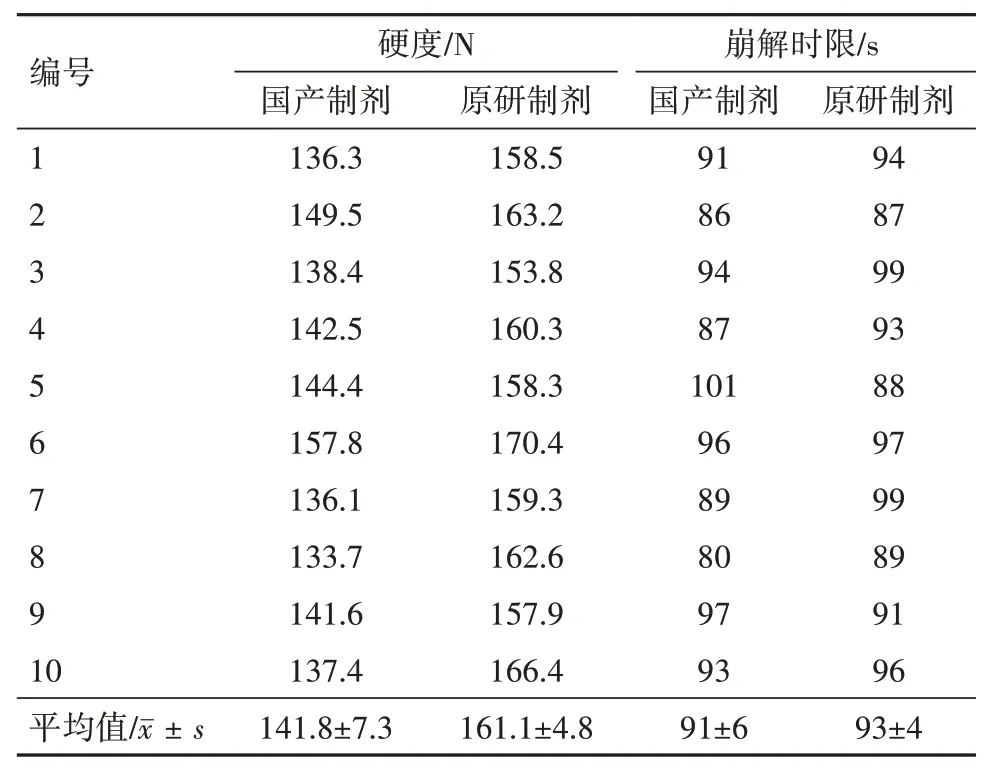
表3 国产和原研复方缬沙坦氨氯地平片硬度及崩解时限检测结果(n=10)
2.2.2溶出度对比研究 依据《美国药典》40 版关于复方缬沙坦氨氯地平片溶出度方法,选择桨法,转速为75 r/min,溶出介质为pH 6.8 磷酸盐缓冲液,体积为1 000 mL,温度为(37.0±0.5)℃。分别取国产与原研复方缬沙坦氨氯地平片各6片加入到溶出杯杯中,启动搅拌桨,在30 min 时间点取溶出介质5 mL,经0.22 µm微孔滤膜过滤,取续滤液稀释一定倍数,按照“1.3.1.4”项下色谱条件进行检测,分别记录缬沙坦和氨氯地平的峰面积,并计算溶出度。要求缬沙坦和氨氯地平的溶出度均不低于标示量的80%。结果见表4。在pH 6.8磷酸盐缓冲液中,国产与原研复方缬沙坦氨氯地平片在30 min 内,缬沙坦和氨氯地平的溶出度均达到80%以上,且二者溶出度均值较为相似。
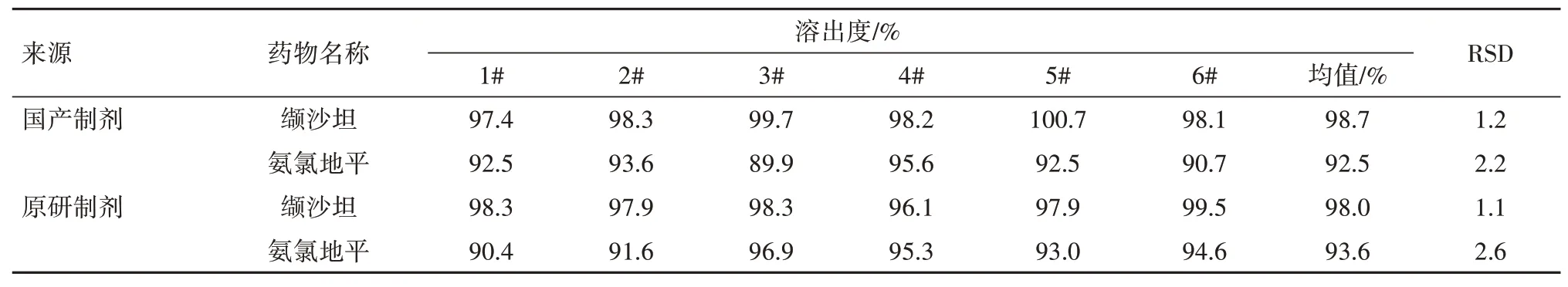
表4 国产与原研复方缬沙坦氨氯地平片的溶出度比较(n=6)
2.2.3溶出相似性比较 依据《普通口服固体制剂溶出度试验技术指导原则》要求,通过比较国产与原研复方缬沙坦氨氯地平片在三种(pH 1.2 盐酸水溶液、pH 4.5醋酸盐缓冲液和pH 6.8磷酸盐缓冲液)溶出介质中的溶出曲线相似性,以评估国产与原研制剂的质量差异性[10-12]。选择“2.2.2”项下所描述的测定复方缬沙坦氨氯地平片溶出度方法,介质体积均为1 000 mL,转速为75 r/min,温度为(37.0±0.5)℃。分别取国产与原研复方缬沙坦氨氯地平片各6 片加入到溶出杯杯中,启动搅拌桨,分别在5、10、15、20 和30 min 时间点取溶出介质5 mL,经0.22µm 微孔滤膜过滤,取续滤液稀释一定倍数,按照“1.3.1.4”项下色谱条件进行检测,分别记录缬沙坦和氨氯地平的峰面积,并计算两种药物的溶出度。将溶出度数据带入到公式2]-0.5×100}中计算相似因子(f2),比较国产与原研复方缬沙坦氨氯地平片在三种溶出介中的溶出曲线相似性[13],其f2值在50~100 之间表明两种制剂的溶出相似性较好,该值越大相似性越高;而f2值小于50 时,表明两种制剂的溶出相似性较差,该值越小相似性越差,国产与原研制剂的溶出度相似性结果比较见表5,6。
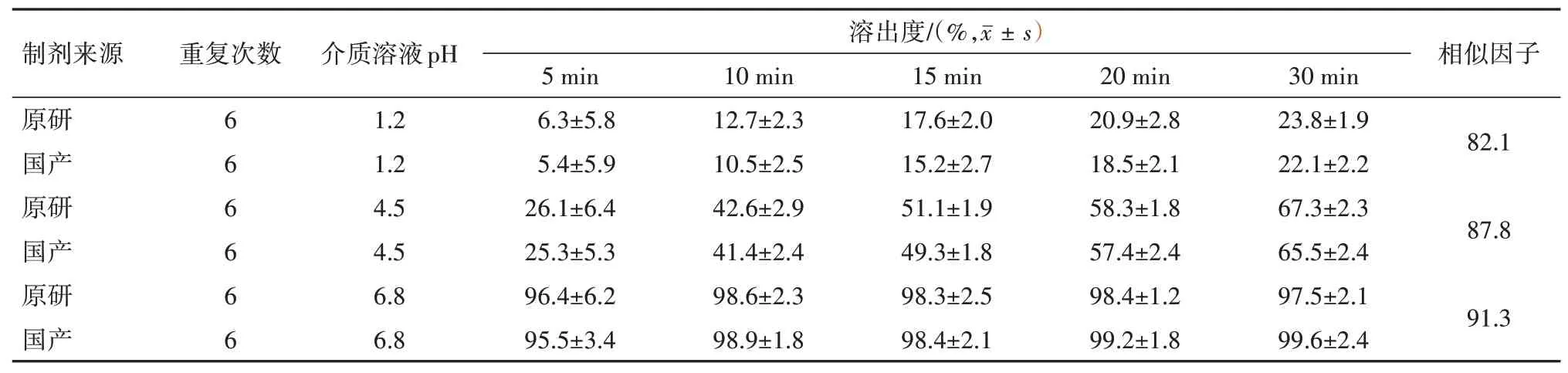
表5 国产与原研制剂在不同溶出介质中缬沙坦的溶出曲线相似性比较
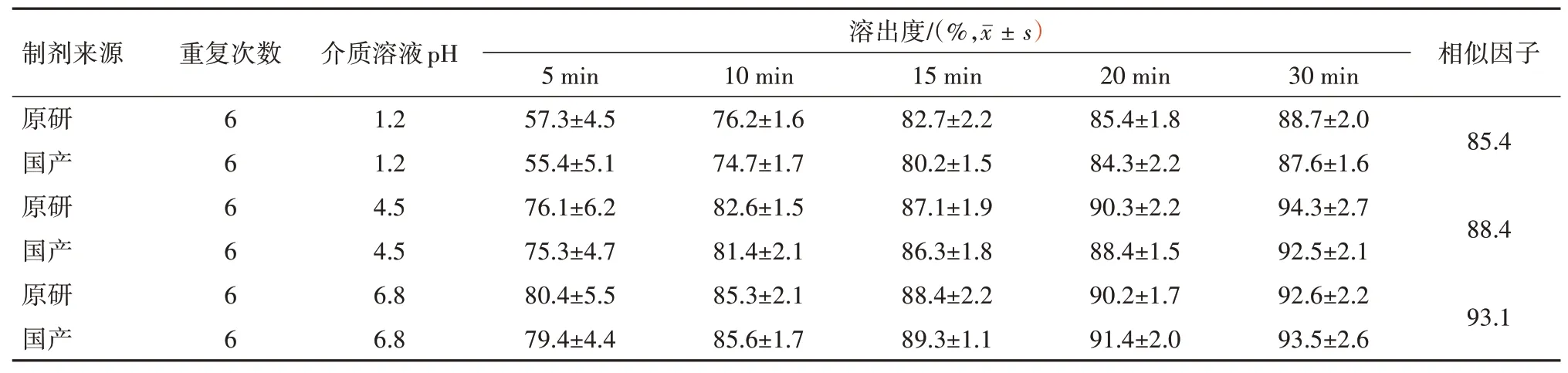
表6 国产与原研制剂在不同溶出介质中氨氯地平的溶出曲线相似性比较
由溶出曲线对比研究可知,国产与原研制剂中的缬沙坦在pH 1.2盐酸溶液和pH 4.5醋酸盐缓冲液中30 min 内不能完全溶出,而在pH 6.8 磷酸盐缓冲液中可以完全溶出,这是由于缬沙坦在较低的pH条件下溶解度较低,达不到漏槽条件[14];氨氯地平在三种溶出介质中30 min 内均可以达到90%以上。相似性比较结果显示,国产与原研复方缬沙坦氨氯地平片在不同溶出介质中的f2值均大于80,说明两种制剂的体外溶出相似性极高[15]。
3 讨论
由于氨氯地平属于生物药剂学分类系统(bio‑pharmaceutics classification system,BCS)Ⅰ类药物,具有高溶解性和高渗透性,主要吸收部位在小肠,其口服生物利用度可达到近90%,吸收较好,不同厂家生产的制剂很容易达到生物等效[16];而缬沙坦属于BCSⅡ类弱酸性药物[17],其在酸性条件下药物以分子形式存在,而在弱酸性或中性条件下以离子形式存在,由于缬沙坦的主要吸收部位在十二指肠和小肠上端[18],在该体内环境中药物部分是以离子形式存在,其口服生物利用度仅为25%左右,吸收较差[19],不同厂家生产的制剂很难达到生物等效[20]。因此需要一种有效手段来评价不同厂家生产的复方缬沙坦氨氯地平片质量一致性。
为了同时测定溶出介质中缬沙坦和氨氯地平的含量,本研究首先采用文献报道的HPLC 法进行方法学开发[21],实验过程中发现,采用该分析方法不能使氨氯地平和缬沙坦达到良好的分离,并且氨氯地平的峰型较差,影响其色谱峰的准确积分,因此本研究重新开发了能够同时测定缬沙坦和氨氯地平含量的HPLC 法,经方法学验证,该色谱条件能够有效的分离缬沙坦和氨氯地平,专属性强,且辅料不干扰测定,适用于复方缬沙坦氨氯地平片的药物溶出度含量检测。
本研究通过比较国产与原研复方缬沙坦氨氯地平片的在多介质条件中的药物溶出曲线,结果显示,国产与原研制剂在不同溶出介质中的f2值均大于80,说明两种制剂的体外溶出相似性极高,很可能会达到生物等效。本研究也可以为其他厂家生产的复方缬沙坦氨氯地平片质量一致性评价提供参考。

