金丝桃苷通过调控微RNA-125a-5p/信号传导和转录激活因子3轴减轻脑缺血/再灌注损伤
夏丽秀,尹霞,肖瑞
脑组织供血不足时,快速再灌注是治疗脑缺血的一项有效方法,但该治疗方法也被证实会进一步引起脑缺血/再灌注(I/R)损伤,导致急性坏死、细胞凋亡[1-3]。目前临床上并无预防神经功能受损的有效治疗手段,因此了解其潜在的机制并积极寻找新的治疗方法十分重要。
金丝桃苷,又名槲皮素-3-O-β-D-吡喃半乳糖苷,是一种从天然红柳木中提取的黄酮类化合物,广泛存在于蔷薇科植物中[4]。其已被证明具有抗氧化、抗炎、抗癌等保护作用[5]。此外,金丝桃苷也被证实能够保护大脑皮层神经元免受缺氧、缺糖导致的再灌注损伤[6-7]。
许多miRNAs 被证实参与了缺血性脑损伤的多个环节,并逐渐成为缺血性脑损伤治疗的新靶标[8]。有研究显示抑制肌醇依赖性激酶1α 能够通过miR-125/ NLR 家族Pyrin 域蛋白1(NLRP1)/胱天蛋白酶1(caspase-1)信号通路减轻缺氧缺血后神经元焦亡,减少梗死体积,改善神经行为结果,提高miR-125的表达可能是避免缺氧缺血脑损伤的重要靶点[9]。信号传导和转录激活因子3 (STAT3)编码的蛋白质是STAT家族的重要成员,有研究发现STAT3过表达能够加重大脑中动脉闭塞(MCAO)所致的I/R 损伤,进一步促进大鼠的神经功能障碍[10]。另外也有研究证实miR-124能够通过抑制STAT3信号通路,进而减少I/R 神经细胞焦亡、发挥神经保护作用[11]。Tian 等[12]在关于皮肤鳞癌的研究中证实了miR-125b能够通过靶向STAT3进而发挥抗肿瘤作用。此外,miR-125也被证实能够靶向STAT3进而在高糖诱导的糖尿病视网膜病变中发挥保护作用[13]。尽管miR-125/STAT3作用轴已被证实在多种其他疾病中发挥作用,但是该作用轴是否影响I/R的进展仍有待进一步探讨。
本研究于2021 年6 月至2022 年1 月开展,旨在探究金丝桃苷/miR-125a-5p/STAT3 在I/R 损伤中的作用和机制,为分子靶向技术治疗I/R 损伤提供一定的理论基础和数据支持。
1 材料与方法
1.1 药品与试剂30 只SPF 级SD 大鼠(6~7 周龄)购自广东省实验动物中心[实验动物生产许可证号SCXK(粤)2018-0002];大鼠PC12 细胞购自北京协和医学院;Hyperin 购自美国Sigma;乳酸脱氢酶(LDH)和超氧化物歧化酶(SOD)测定试剂盒购自上海碧云天生物科技有限公司;双萤光素酶分析报告系统购自翌圣生物;肿瘤坏死因子-α(TNF-α)酶联免疫吸附法(ELISA)试剂盒、白细胞介素-6(IL-6)ELISA 试剂盒、放射免疫沉淀测定(RIPA)裂解液、二喹啉甲酸(Bicinchoninic acid,BCA)试剂盒、2,3,5-氯化三苯基四氮唑(TTC)染色试剂盒均购自北京索莱宝生物科技有限公司;转染试剂Lipofectamine 3000、逆转录试剂盒及荧光定量PCR 试剂购自美国Invitrogen 公司;引物由广州锐博生物科技公司设计并合成;PowerUp™ SYBR®Green Master Mix 购自美国ThermoFisher 公司。本研究符合一般动物实验伦理学原则。
1.2 生物信息学分析基因综合表达数据库(GEO)(http://www.ncbi.nlm.nih.gov/geo/)中搜寻I/R损伤相关的基因表达谱(GSE82146)。该数据集分析了Long Evans雄性大鼠在缺血处理10 min以及再灌注8 h 后锥体神经元中差异表达的mRNAs。lim‑ma包对得到的基因表达谱文件进行差异基因筛选,校正后P值称为adj.P.Val,其中符合|log2FC|>1 和adj.P.Val<0.05 的条件的基因被确定为显著差异表达基因,pheatmap 包用于绘制差异基因表达热图。通过在线生物信息学工具DAVID6.8(https://david.ncifcrf.gov/home.jsp)对差异表达基因进行KEGG 功能富集分析。在DisGeNET 数据库(https://www.dis‑genet.org/)获取I/R 的疾病风险基因。String 数据库(https://string-db.org)用于分析蛋白互作用关系(PPI)。DIANA(http://carolina.imis.athena-innova‑tion.gr/diana_tools/web/index.php)、starBase 预测网站(http://starbase. sysu. edu. cn/browseNcRNA. php)、miRDB 预测网站(http://mirdb.org/index.html)、Tar‑getScan 预测网站(http://www.targetscan.org/vert_72/)、miRWalk(http://mirwalk.umm.uni-heidelberg.de/)检索STAT3 的上游靶miRNAs,使用DIANA 在线基因本源(GO)注释分析对进行miRNAs 进行筛选,并借助Venn 在线网站(http://bioinformatics.psb.ugent.be/webtools/Venn/)绘制交集miRNAs。
1.3 大鼠脑中动脉闭塞法建立I/R动物模型模型建立的方法依据参考文献[11]:取30只SPF级SD大鼠(6~7 周龄),体质量范围在200~250 g。造模前所有大鼠进行7 d习服,饲养环境保持22~24 ℃,相对湿度范围45%~65%,12 h 光/暗循环以模拟真实昼夜变化,在习服过程中大鼠可以自由饮食和采水。将30只大鼠随机分为四组:假手术组(n=6)、模型组(n=6)、金丝桃苷低剂量组(n=6)、金丝桃苷高剂量组(n=6)。进行灌胃给药,金丝桃苷低剂量组组予20 mg/kg 金丝桃苷,金丝桃苷高剂量组组予50 mg/kg 金丝桃苷,模型组予同等剂量的生理盐水,假手术组不作任何处理。于早晚灌药各一次,持续给药5 d。随后在第6 天于SPF 环境下构建鼠脑中动脉阻塞模型。在构建模型的当天将各组大鼠进行8 h禁食处理,腹腔注射2%戊巴比妥钠(30 mg/kg)麻醉大鼠,于颈部正中开一约2 cm的切口,分离右侧颈总动脉,颈内动脉和颈外动脉采用Nagasawa 法进行缺血2 h 后再灌注24 h 诱导。假手术组同样进行中动脉分离,但不进行结扎阻塞和刺破动脉管壁处理。缝合伤口后各组大鼠均进行缝合并单笼饲养。本研究各项流程符合国家卫生研究所的实验室动物护理和使用指南。
1.4 大鼠神经功能缺损评价待大鼠完全清醒后按照Masao Shmiizu-Sasamata 的方法进行神经行为评分。严重程度评分从0~14 分,其中0 分代表正常,得分越高表示损伤越严重。评分准则见表1。
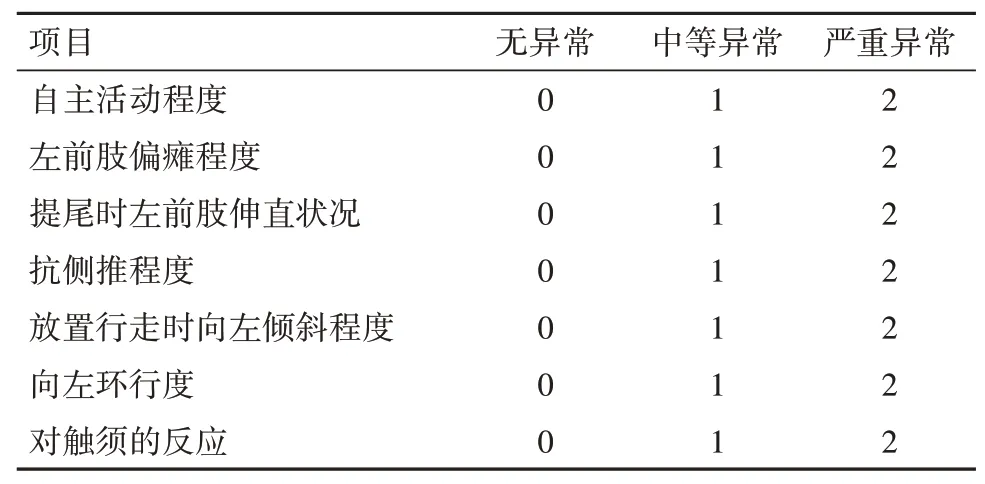
表1 大鼠神经行为评分/分
1.5 大鼠脑组织含水量测定各组实验大鼠于再灌注后24 h 在深麻醉状态下断头取脑。取右侧大脑半球用滤纸吸干表面血液,经电子天平精确称质量后,放入120 ℃恒温干燥箱烘烤48 h至恒质量后,再精确称质量,并按Elliot干湿质量法计算脑组织含水量,以百分率表示。脑组织含水量=[(湿重-干重)/湿重]×100%。
1.6 大鼠脑组织获取与脑梗死体积评价组织采集前,将大鼠深度麻醉后断头取脑组织。剥除脑膜及血管后于-20 ℃下保存备用。30 min 取出后连续切4~5 张3 mm 左右厚切片。将切片加入2%的TTC的染色液,并在避光条件下浸染30 min,随后用4%多聚甲醛灌流,固定后取出将脑片按顺序整齐排列,滤纸吸干表面水分。Image-J软件测定全脑片和梗死组织的面积,乘以脑片厚度即得全脑和梗死组织的体积。红色区域为正常脑组织,苍白色为脑梗死区域,梗死体积百分比=梗死组织的梗死体积/全脑体积的百分比。
1.7 氧-葡萄糖剥夺/复氧(OGD/R)诱导PC12 细胞建立体外I/R 细胞模型并转染大鼠PC12 细胞在含10%胎牛血清、5%胚胎干细胞、100 U/mL 青链霉素合剂的DMEM 培养基中培养,培养环境设置为37 ℃、5%二氧化碳。将细胞进行相应的转染操作。将20 mg 金丝桃苷与80 µL 二甲基亚砜混匀,并以20 µL 分装,使用时用培养基稀释至10 mL,并配置成含有50 µmol 金丝桃苷的培养基。利用Lipo‑fectamine 3000 转染试剂分别将miR-125a-5p 抑制剂(miR-125a-5p inhibitor)、miR-125a-5p 抑制剂阴性对照(inhibitor-NC)、过表达STAT3(pc-STAT3)和阴性对照(pcDNA 3.1)质粒转染至对应的PC12 细胞,转染步骤依据试剂盒说明书进行。转染6 h后更换RP‑MI1640 完全培养基。在37 ℃、5%二氧化碳的培养箱中继续进行孵育,转染48 h 后将生长状态良好的PC12细胞用胰酶消化后制成细胞悬液,继续培养,待细胞贴壁后各组加入50 µmol 的金丝桃苷完全培养基预处理。含金丝桃苷的培养基连续培养细胞24 h,之后换上完全培养基将各组细胞转移至缺氧的环境中,设置1%氧气、94%氮气和5%二氧化碳,12 h 后转移至常氧条件即5%二氧化碳、95%空气中培养5 h,用神经元培养液替换无糖DMEM 培养基恢复24 h。并设未经OGD/R处理的神经细胞为对照组。
1.8 双萤光素酶报告实验利用在线生物靶点预测网站的预测结果合成包含miR-125a-5p 结合位点的STAT3 3’UTR 序列,构建STAT3 3’UTR 野生型(WT)质粒(STAT3-WT),并在此基础上利用突变结合位点构建STAT3 3’UTR 突变型(MUT)质粒(STAT3-MUT)。将上述质粒与miR-125a-5p mimic或mimic-NC 两两共转染至PC12 细胞。转染48 h后,裂解细胞,以12 000 r/min的速度离心1 min后收集上清液。使用双萤光素酶报告分析系统检测萤光素酶活性。相对萤光素酶活性用萤光素酶和海肾萤光素酶的比值表示。
1.9 ELISA 检测将细胞培养基移至无菌离心管,在4 ℃条件下以2 500 r/min 的转速离心10 min,然后将上清等量分装于小EP 管并于-20 ℃下保存,避免反复冻融。根据试剂盒说明书对细胞上清液中IL-6及TNF-α的浓度进行测定。
1.10 LDH 与SOD 活力测定收集细胞到离心管内,离心后弃上清,按照细胞数量以(500~1 000)∶1的比例加入提取液,超声波破碎细胞,4 ℃条件下以4 000 r/min 的转速离心10 min,弃上清,置冰上待测,根据试剂盒说明进行SOD 活力测定。根据细胞的大小和生长速度将适量细胞接种到96 孔细胞培养板中,待细胞生长到合适密度后吸去培养液,用PBS 液洗涤一次。换新鲜无血清培养液,将各培养孔分组并做好标记,常规培养,根据试剂盒说明进行LDH活力测定。
1.11 蛋白质印迹法检测提取各组大鼠脑组织和细胞总蛋白,并用BCA 试剂盒进行蛋白浓度测定,以12 000 r/min 离心15 min 后收集上清液进行十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳,电泳分离后,将蛋白质转移到硝酸纤维素膜上,随后在室温下用5%脱脂牛奶-PBS溶液封闭1.5 h。取出后用TBST 溶液洗膜,加入一抗后在4 ℃条件下孵育过夜,次日用TBST 洗膜3 次,加入二抗后在温孵育1.5 h,TBST 再次洗膜3 次,配置ECL 化学发光液,加至膜上显色显影。并用Image J 软件测量并计算目的条带与内参条带的灰度值之比,每个蛋白样品均以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参对照。
1.12 qRT-PCR按照Trizol 试剂盒说明书从脑组织和细胞中提取总RNA,以RNA 为样本,用Super‑Scrip™Ⅲ逆转录酶合成第一链基因,用SYBR Green PCR Kit 进行实时定量PCR。以上所有实验步骤均按照试剂盒说明书进行操作。分别以GAPDH 和U6对STAT3 和miR-125a-5p 进行归一化处理,2-ΔΔCt法对mRNA表达进行分析。详细序列见表2。

表2 qRT-PCR引物序列
1.13 统计学方法SPSS 23.0软件被用于对本文数据进行分析。对计量资料进行正态分布和方差齐性检验,若符合以±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析,进一步组内两两比较采用SNK-q。P<0.05为差异有统计学意义。
2 结果
2.1 金丝桃苷能够改善I/R大鼠脑损伤与假手术组组相比,模型组神经功能缺损评分及脑含水量显著增加(均P<0.05),金丝桃苷能提高I/R 大鼠神经功能缺损评分,减少脑含水量,且效果呈剂量依赖性增强(均P<0.05)。TTC 染色评估脑梗死体积发现,与假手术组相比,模型组脑梗死面积明显增加,但金丝桃苷低剂量组脑梗死面积较模型组明显缩小,金丝桃苷高剂量组脑梗死面积进一步缩小(均P<0.05)。见表3。
表3 金丝桃苷对I/R大鼠脑损伤的改善作用/± s
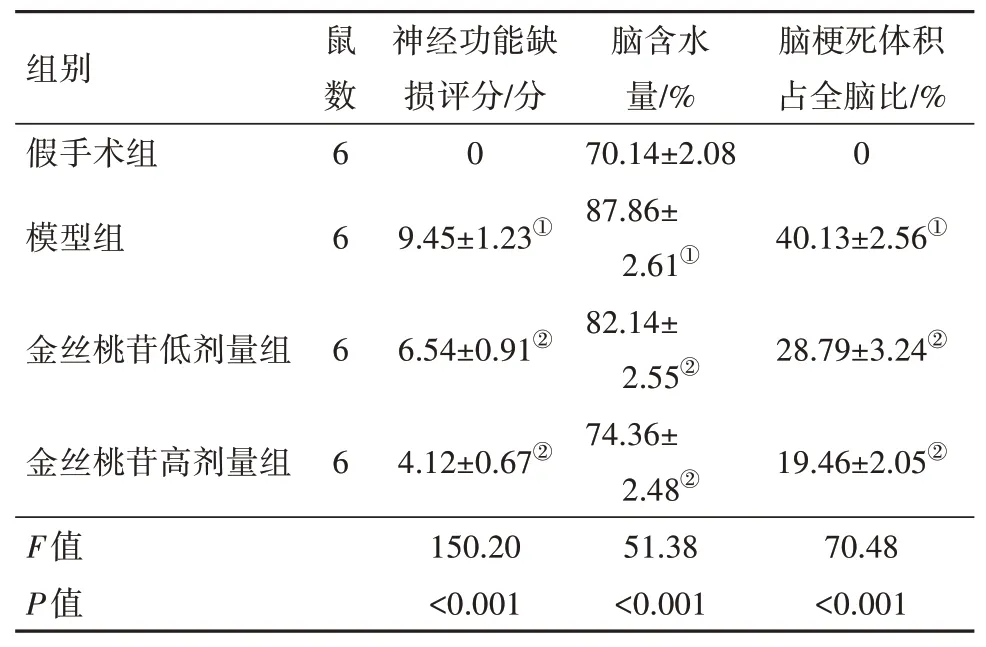
表3 金丝桃苷对I/R大鼠脑损伤的改善作用/± s
注:①与假手术组比较,P<0.05。②与模型组比较,P<0.05。
?
2.2 金丝桃苷保护机制的生物信息学分析借助GSE82146 数据集分析I/R 中差异表达的基因,图1A显示了该数据集中I/R 大鼠与对照组的差异表达基因,将热图中显示的上调基因进行KEGG分析,选择与I/R 损伤相关的rno04066:HIF-1 信号通路(图1B),该通路中富集的基因包括:CDKN1A,STAT3,HMOX1,TIMP1。将该通路中富集的基因和Dis‑GeNET 数据库查找到的I/R 风险基因进行PPI 蛋白互作用分析,PPI分析结果显示STAT3在PPI网络的中心位置,且与I/R 相关风险基因存在紧密联系(图1C)。qRT-PCR及蛋白质印迹检测结果显示,STAT3在模型组中较假手术组表达升高,且与模型组比较,金丝桃苷低剂量组STAT3 水平下调,而金丝桃苷高剂量组较金丝桃苷低剂量组水平更低(均P<0.05)。见图2,表4。
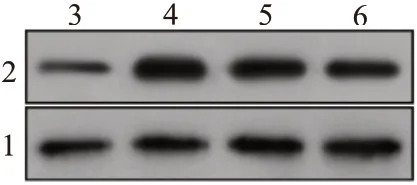
图2 金丝桃苷蛋白质印迹法检测结果
表4 各组大鼠脑组织中STAT3的mRNA和蛋白表达检测结果/± s
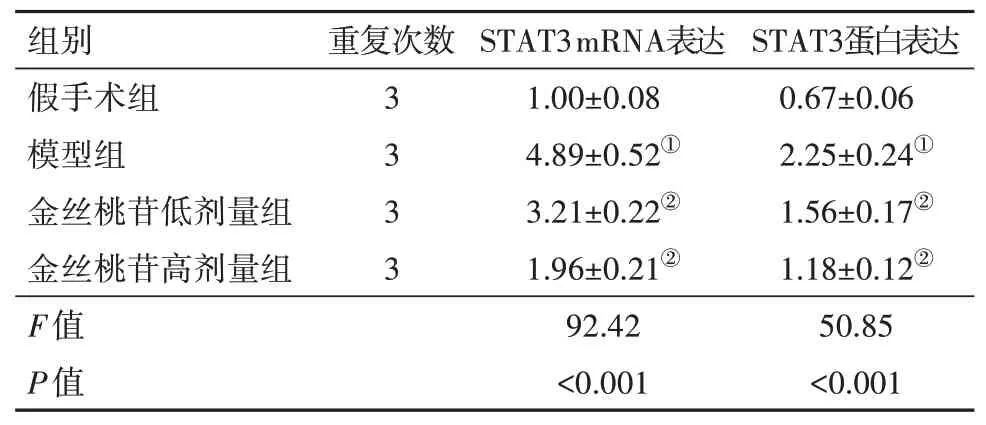
表4 各组大鼠脑组织中STAT3的mRNA和蛋白表达检测结果/± s
注:STAT3为信号传导和转录激活因子3。①与假手术组比较,P<0.05。②与模型组比较,P<0.05。
?
2.3 miR-125a-5p 被证实为STAT3 的上游靶miR⁃NA利用DIANA、starBase、miRDB、TargetScan、miRWalk 对STAT3 的上游miRNA 进行预测并取交集,发现21个交集miRNAs(图3),GO富集结果显示hsa-miR-6835-3p、hsa-miR-125a-5p 均与血小板激活相关(P=0.035)。以往有研究证明,血小板活化异常与脑I/R 的发生和发展存在重要关联[14-15]。qRTPCR结果显示(表5),与假手术组相比,miR-125a-5p在模型组显著下调,使用金丝桃苷后其表达水平显著上调(均P<0.05),miR-6835-3p 表达在各组内差异无统计学意义(P>0.05)。STAT3 和miR-125a-5p的特异性结合位点见图4,双萤光素酶报告实验显示,相对于mimic-NC 和STAT3-WT 共转染组(1.00±0.12),miR-125a-5p mimic 和STAT3-WT 共转染组(0.38±0.04)的萤光素酶活性显著降低(P<0.05)。

图4 靶向关系预测网站显示的STAT3和miR-125a-5p的结合位点
表5 各组大鼠脑组织中miR-125a-5p和miR-6835-3p检测结果/± s
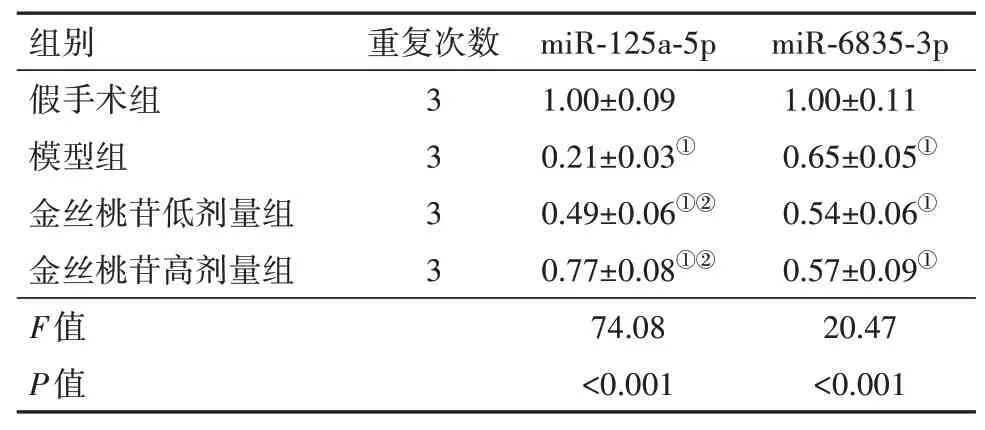
表5 各组大鼠脑组织中miR-125a-5p和miR-6835-3p检测结果/± s
注:miR-125a-5p 为微RNA-125a-5p,miR-6835-3p 为微RNA-6835-3p。①与假手术组比较,P<0.05。②与模型组比较,P<0.05。
?
2.4 金丝桃苷对OGD/R 诱导的PC12 细胞的保护作用能被miR-125a-5p抑制剂部分消解与对照组相比,OGD/R 组细胞中miR-125a-5p 的表达显著降低,金丝桃苷组较OGD/R 组miR-125a-5p 的水平上调(均P<0.05)。另外,与对照组比较,OGD/R 组细胞中IL-6、TNF-α 水平增加,LDH 水平上升,SOD 水平下降,使用金丝桃苷处理细胞后IL-6、TNF-α、LDH 水平下降,SOD 水平上升(均P<0.05)。而金丝桃苷+miR-125a-5p inhibitor 较金丝桃苷+inhibitor NC 组,IL-6、TNF-α 的浓度、LDH 活力均显著提高,SOD活力下降(均P<0.05)。见表6。
表6 金丝桃苷对OGD/R诱导的PC12细胞的保护作用被miR-125a-5p inhibitor部分逆转/± s
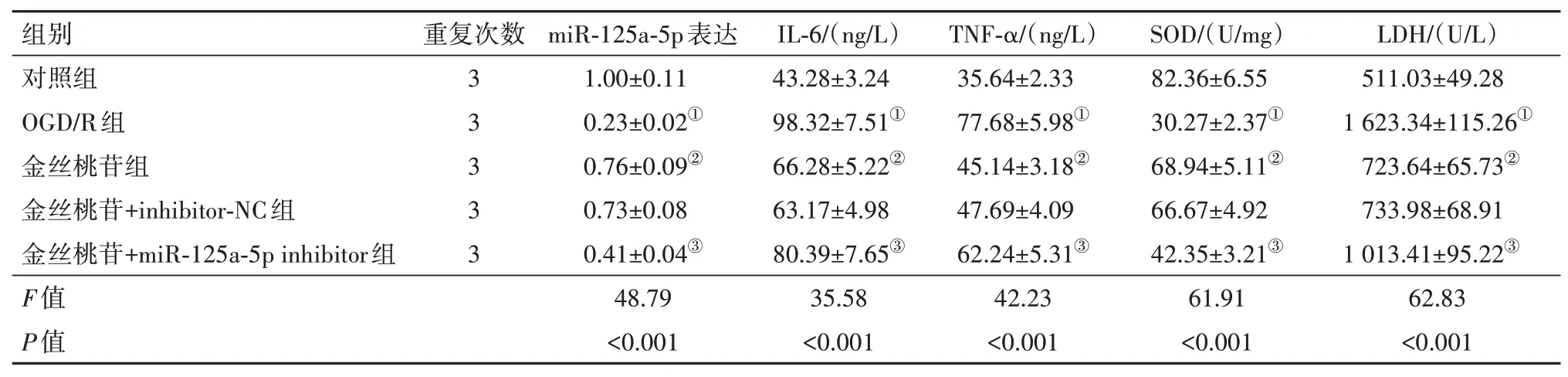
表6 金丝桃苷对OGD/R诱导的PC12细胞的保护作用被miR-125a-5p inhibitor部分逆转/± s
注:miR-125a-5p 为微RNA-125a-5p,IL-6 为白细胞介素-6,TNF-α 为肿瘤坏死因子-α,SOD 为超氧化物歧化酶,LDH 为乳酸脱氢酶,OGD/R为氧-葡萄糖剥夺/复氧。①与对照组比较,P<0.05。②与OGD/R组比较,P<0.05。③与金丝桃苷+inhibitor-NC组组比较,P<0.05。
?
2.5 金丝桃苷对OGD/R 诱导的PC12 细胞的保护作用是通过miR-125a-5p/STAT3 实现的相对于OGD/R 组,使用金丝桃苷处理细胞后IL-6、TNF-α、LDH 水平下降,SOD 水平上升(P<0.05)。而相较于金丝桃苷+pcDNA3.1组,转染pc-STAT3后IL-6、TNFα、LDH 水平提高,SOD 水平下降(P<0.05)。综上结果说明金丝桃苷对OGD/R 诱导的PC12 细胞具有一定保护其不受炎性反应和氧化应激损伤的效果,而该效果能被过表达STAT3部分消解,结合实验“2.3”部分,本研究认为金丝桃苷是通过上调miR-125a-5p抑制STAT3的表达发挥相应作用的。见表7。
表7 各组细胞炎性因子、SOD和LDH水平比较/± s
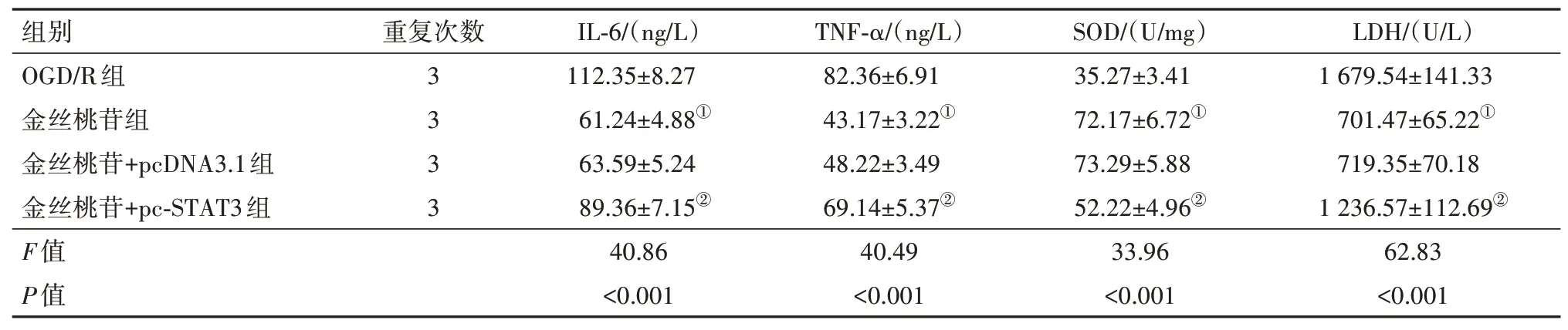
表7 各组细胞炎性因子、SOD和LDH水平比较/± s
注:IL-6为白细胞介素-6,TNF-α为肿瘤坏死因子-α,SOD为超氧化物歧化酶,LDH为乳酸脱氢酶。①与OGD/R组比较,P<0.05。②与金丝桃苷+pcDNA3.1组比较,P<0.05。
?
3 讨论
先前研究表明,Hyperin能够通过调节一氧化氮信号通路进而保护大脑皮层免受缺氧缺糖导致的再灌注损伤[6]。此外,刘佳佳等[16]在研究中使用50 mg/kg 的金丝桃苷处理脑I/R 小鼠,证实了其对神经保护的作用。本实验采用前人方法通过阻塞中动脉制备局灶性I/R,具有损伤小且时间可控的特点[17-18]。发现Hyperin 作用于大鼠脑I/R 损伤后,大鼠的神经功能障碍有所改善,脑梗死体积显著下降,脑水肿减轻。随后进行生物信息学分析后发现异常上调的基因在HIF-1 通路中显著富集。有证据表明,HIF-1 通路在I/R 损伤的病理进展密切相关:其介导的炎症反应可预防I/R 损伤后神经元的死亡[19]。该通路中富集的STAT3 基因与I/R 损伤风险基因紧密相关。STAT3可对多种细胞因子等进行调控从而发挥作用[20]。先前研究证明S1P 能够激活STAT3,而抑制S1P 信号是一种治疗脑缺血后血脑屏障损伤的策略[21]。下调STAT3 也被证实能够改善I/R 损伤小鼠的神经症状,缩小脑梗死范围[22]。而miRNAs能通过与靶基因的3´-UTR端序列互补配对来促进靶基因的降解或抑制其翻译,参与细胞分化凋亡及增殖等进程[23]。本研究进一步寻找可能调控STAT3 的上游miRNA,结合多种生物信息学工具最终将miR-125a-5p 纳入研究。miR-125a-5p 经GO 富集分析显示与血小板激活通路相关。在脑缺血后期,血脑屏障遭到破坏,缺氧激活血小板通路释放相关因子[24]。且miR-125已被证明其异常高表达能够促进I/R 模型梗死体积减少,改善神经行为等[9]。PC12 细胞来自大鼠肾上腺嗜铬细胞瘤细胞系,与神经细胞均来源于神经脊,且与神经细胞的结构、功能均有相似之处,且相较于神经元更易获得、培养[25]。因此本实验借助前人方法[26]构建PC12细胞的OGD/R 体外细胞模型,考察miR-125a-5p 与STAT3 在该疾病模型中的表达,并进行体外细胞学功能实验。结果显示Hyperin 能够通过上调miR-125a-5p抑制STAT3的水平缓解炎症因子的释放。
此外本实验考察了SOD 和LDH 的活力:SOD 在机体内作为重要的抗氧化酶,可以参与清除氧自由基从而保护细胞不受氧化应激损伤,可作为考察体内维持氧化还原平衡的重要因子[27]。而LDH 外渗常伴随着较高的氧自由基,预示着胞内钙超载与膜脂质的氧化损伤,从而导致细胞膜结构改变,严重损害细胞功能,并造成神经元死亡[28]。我们发现Hyperin 处理OGD/R 模型细胞能够通过促进miR-125a-5p 的表达水平、抑制STAT3 表达,上调SOD 水平并降低LDH 的含量,从而显著提高PC12 细胞的抗氧化应激能力。
综上所述,本研究从动物及细胞模型两个层面深入研究了Hyperin 在I/R 损伤中的生物学特性和功能,揭示了Hyperin 通过调控miR-125a-5p/STAT3轴在I/R 中发挥保护作用的可能机制。而扩大样本数量、寻求金丝桃苷药物的最佳治疗剂量等,是本研究进一步完善的方向。综上,本研究为I/R 治疗提供了新的见解,显示了中药成分结合分子靶向技术潜在的应用价值。
(本文图1,3见插图7-1)

