支气管扩张并发肺部感染患者血清HIF-1α、IL-11的表达及临床意义
李 瑾,李玉霞,瞿明奎
黄冈市第三人民医院:1.呼吸与危重症医学科;2.儿科,湖北黄冈 438000
支气管扩张属于肺部疾病,其特征是支气管异常、永久性、不可逆的扩张,并伴随着持续的气道炎症、慢性咳嗽和分泌过多的黏稠分泌物[1]。由于黏稠分泌物及痰栓在气道内堵塞,导致气道狭窄,影响痰液排除,易发生肺部感染,而肺部感染又会使气道内炎症反应加重,从而加重患者病情,重者可引起呼吸衰竭[2]。此外,支气管扩张的临床疗效又受到肺部感染所致免疫炎症反应影响,导致患者生存质量降低。因此,探究能够用于预测支气管扩张并发肺部感染严重程度的早期诊断分子标志物,对临床尽早干预有重要意义。缺氧诱导因子-1α(HIF-1α)属于缺氧信号的转导中心,可对肺泡上皮细胞产生损伤[3]。HIF-1α通常在炎症反应中上调,通过调节相关靶基因表达,进而促进炎症发展[4]。在机体正常生理状态下白细胞介素(IL)-11几乎不表达,而在机体炎症部位其表达升高,IL-11在调节肺部感染期间的组织损伤和炎症反应中至关重要[5]。既往研究显示,IL-11在小鼠气道中的水平升高导致气道重塑、炎症发生,在结核分枝杆菌感染的小鼠模型中IL-11也被证实能够引起肺部炎症[6]。鉴于HIF-1α、IL-11在炎症中的重要作用,而HIF-1α、IL-11在支气管扩张并发肺部感染中的水平变化尚不清楚。本研究旨在探讨支气管扩张并发肺部感染患者血清中HIF-1α、IL-11水平并分析其与病情严重程度的关系,以期为该病早期诊断及分子机制研究提供参考。
1 资料与方法
1.1一般资料 选取2019年5月至2021年2月本院诊治的94例支气管扩张并发肺部感染患者为感染组,年龄19~70岁,支气管扩张诊断符合《成人支气管扩张症诊治专家共识(2012版)》中的相关标准[7],并结合CT、胸片诊断结果确诊。支气管扩张并发肺部感染临床症状符合《内科学》中有关规定[8],临床主要表现为发热、咳嗽及咳痰等,肺部闻及湿性啰音,白细胞计数或中性粒细胞计数升高,提示肺部存在浸润性炎症反应。另以同期86例单纯支气管扩张患者作为疾病对照组,86例体检健康者为健康对照组,3组一般资料比较,差异无统计学意义(P<0.05),具有可比性,见表1。排除标准:(1)呼吸衰竭;(2)伴有胶质瘤、肺癌等肿瘤;(3)合并其他部位感染;(4)伴有凝血功能障碍;(5)妊娠。本研究经医院伦理委员会批准,患者及其家属了解本研究内容且签署知情同意书。

表1 3组一般资料比较
1.2疾病严重程度评估 感染组患者肺部感染程度评估采用肺部感染评分(CPIS)[9]并分为轻感染组(6~<8分)18例,中感染组(8~<10分)64例,重感染组(10~12分)12例。
感染组患者支气管扩张程度的评估使用支气管扩张程度指数(BSI)[10],30例轻度扩张患者作为轻扩张组(0~<5分),47例中度扩张患者作为中扩张组(5~<9分),17例重度扩张患者作为重扩张组(≥9分)。
1.3血清HIF-1α、IL-11水平检测 感染组、疾病对照组在入院后次日,健康对照组在体检当天采集空腹外周静脉血10 mL,离心后取上层血清,采用酶联免疫吸附试验(ELISA)试剂盒检测血清HIF-1α、IL-11水平,ELISA试剂盒货号分别为H307-2、H009-2,由南京建成生物工程研究所提供,严格按配套说明书操作。
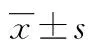
2 结 果
2.13组患者血清HIF-1α、IL-11水平比较 感染组血清HIF-1α、IL-11水平高于疾病对照组、健康对照组,而疾病对照组HIF-1α、IL-11水平高于健康对照组(P<0.05),见表2。
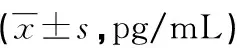
表2 3组患者血清HIF-1α、IL-11水平比较
2.2不同支气管扩张程度患者血清HIF-1α、IL-11水平比较 轻扩张组HIF-1α、IL-11水平低于中、重扩张组,中扩张组HIF-1α、IL-11水平低于重扩张组,差异有统计学意义(P<0.05),见表3。
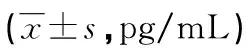
表3 不同支气管扩张程度患者血清HIF-1α、IL-11水平比较
2.3不同肺部感染程度患者血清HIF-1α、IL-11水平比较 轻感染组HIF-1α、IL-11水平低于中、重感染组,中感染组HIF-1α、IL-11水平低于重感染组,差异有统计学意义(P<0.05),见表4。
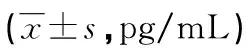
表4 不同肺部感染程度患者血清HIF-1α、IL-11水平比较
2.4感染组患者血清HIF-1α与IL-11水平的相关性分析 感染组患者血清HIF-1α与IL-11水平呈正相关(r=0.799,P<0.001)。
2.5HIF-1α、IL-11诊断支气管扩张患者并发肺部感染的ROC曲线 HIF-1α、IL-1及二者联合诊断支气管扩张并发肺部感染的曲线下面积(AUC)分别为0.856(95%CI0.797~0.914)、0.917(95%CI0.875~0.958)、0.947(95%CI0.915~0.978)。HIF-1α、IL-11及二者联合诊断支气管扩张并发肺部重度感染的AUC分别为0.857(95%CI0.746~0.967)、0.831(95%CI0.719~0.944)、0.931(95%CI0.873~0.989),见表5。
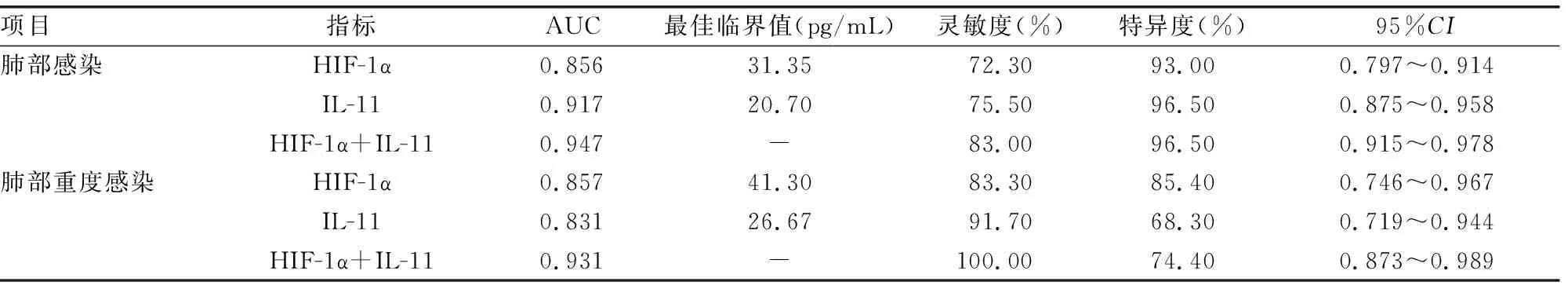
表5 HIF-1α、IL-11诊断支气管扩张并发肺部感染的效能
3 讨 论
支气管扩张通常表现为痰多、呼吸困难、咳嗽、疲劳、体重减轻、喘息和呼吸短促[11]。支气管感染是支气管扩张的最常见原因,病原体感染肺部组织后,感染部位会释放酶和炎症细胞因子,使感染部位损伤加重,并造成气道的不间断性损伤[12]。肺部感染是支气管扩张常见的一种感染类型,该病治疗效果有限,常反复发作,难以控制,同时存在耐药性问题,严重降低患者生活质量,甚至增加患者病死率[2]。因此,积极筛选能够预测支气管扩张并发肺部感染病情严重程度的生物标志物,早期进行抗感染治疗,对病情发展控制,促进患者恢复有重要意义。
HIF-1是一种异二聚体蛋白,由HIF-1α亚基、HIF-1β亚基组成,对调节氧稳态至关重要,HIF-1的活性主要受HIF-1α的调节,而HIF-1α稳定性受氧浓度调节[4]。缺氧时,HIF-1α与HIF-1β形成完整的HIF-1复合物,然后识别缺氧反应元件以控制靶基因表达,而其所调控靶基因涉及炎症反应、血管生成、细胞增殖等重要过程[13]。值得注意的是,HIF-1α是炎症反应的核心调控因子,可以通过调控炎症靶基因表达及与致炎因子(血管内皮生长因子、前列腺素2)共同介导炎症,而免疫细胞又通过HIF-1α通路参与炎症过程[14]。HIF-1α可在免疫炎症、细菌感染、巨噬细胞代谢、病毒感染等炎症性疾病中检测到[3]。有关慢性阻塞性肺疾病的研究显示,患者血清中HIF-1α水平升高,且病情加重患者的HIF-1α水平高于稳定患者,HIF-1α与该病严重程度、炎症反应激活、气道重塑加剧密切相关[15]。然而,HIF-1α在支气管扩张并发肺部感染中的作用报道较少。本研究结果显示,感染组HIF-1α水平升高,提示HIF-1α参与肺部感染过程。近年来研究证实,HIF-1α可以促进炎症因子如IL-6、肿瘤坏死因子-α(TNF-α)等表达,参与炎症性疾病过程。韩朋等[16]的研究显示,在H1N1病毒感染的小鼠中检测到HIF-1α水平升高,而小鼠经HIF-1α抑制剂干预后,HIF-1α及炎症因子水平IL-6、TNF-α水平降低。本研究中轻扩张组、中扩张组及重扩张组HIF-1α水平依次升高,且轻感染组、中感染组及重感染组中HIF-1α水平也呈不断升高趋势,提示随着病情加重,肺功能受损,患者缺氧情况逐渐加重,在缺氧环境诱导下HIF-1α水平升高,HIF-1α可能通过诱导炎症因子表达,促进炎症加重,推动肺部感染进程,加剧肺功能障碍,加重病情进展,有作为诊断支气管扩张并发肺部重度感染分子标志物的潜能。
IL细胞因子家族是一组多效性因子,包括IL-11等成员,该家族的信号传导涉及众多受体,但都需要结合gp130。研究发现IL-11具有极强的免疫调节功能,还是炎症、肺纤维化和上皮功能障碍的重要因子。有关骨肉瘤的研究显示,缺氧显著诱导U2OS细胞中IL-11水平增加,同时有时间依赖性,能够促进骨肉瘤发生发展[17]。TRABER等[18]的研究显示,未感染的小鼠肺中IL-11保持在较高水平,细菌感染只会使其水平略微升高,表明IL-11可能在感染期间发挥作用。早期研究表明,人肺中IL-11水平升高与病毒感染和一系列纤维炎症性疾病有关;在小鼠模型中,用抗体靶向IL-11可以阻止和逆转肺纤维化和炎症反应[5]。此外,IL-11还在关节炎、急性胰腺炎、胰腺癌、慢性心力衰竭、乳腺癌等炎症性疾病或癌症中异常表达[19]。本研究结果显示,感染组IL-11水平高于疾病对照组、健康对照组,提示IL-11水平与肺部感染发生有关,早期IL-11水平可以用于诊断感染性疾病的发生。在慢性炎症性气道疾病中,严重哮喘患者的上皮细胞中IL-11水平升高,且与哮喘严重程度相关;哮喘患者气道中Th17细胞因子增加,可诱导哮喘患者的支气管纤维细胞、支气管上皮细胞、嗜酸性粒细胞分泌IL-11[5]。本研究通过对感染组患者支气管扩张程度进行分析发现,轻扩张组中IL-11水平低于中、重扩张组,中扩张组IL-11水平又低于重扩张组;对肺部感染程度分析结果显示,轻感染组IL-11水平低于中感染组,而中感染组IL-11水平低于重感染组,提示IL-11与肺部感染严重程度及支气管扩张程度有关,且IL-11水平有助于鉴别支气管扩张并发肺部感染的严重程度。
既往研究显示,HIF-1α在早期能够维持机体适应缺氧环境,而长期持续缺氧将导致HIF-1α水平升高,进而引起气道组织重塑;同时HIF-1α介导相关信号通路增加炎症因子的分泌,从而共同参与气道组织结构[20]。另外,本研究通过Pearson相关分析发现,感染组患者血清HIF-1α与IL-11水平呈正相关(r=0.799,P<0.001),提示HIF-1α、IL-11可能在支气管扩张并发肺部感染中存在相互调控机制,加重炎症反应,推动肺部感染进展。ROC曲线结果显示,HIF-1α、IL-11诊断支气管扩张并发肺部感染的AUC为0.856、0.917,说明支气管扩张患者血清HIF-1α水平对肺部感染的诊断有一定价值,但二者单独诊断的灵敏度较低,分别为72.30%、75.50%。HIF-1α与IL-11联合诊断的AUC为0.947,特异度为96.50%,灵敏度为83.00%,优于HIF-1α、IL-11单独检测结果,提示HIF-1α联合IL-11有作为临床诊断支气管扩张并发肺部感染的分子标志物。本研究进一步分析了HIF-1α、IL-11及二者联合诊断支气管扩张并发肺部重度感染的效能,结果显示二者联合诊断的AUC为0.931,优于单一指标检测结果。
综上所述,支气管扩张并发肺部感染患者血清中HIF-1α、IL-11水平升高,HIF-1α、IL-11均与支气管扩张程度及肺部感染严重程度有关,二者联合对患者支气管扩张并发肺部感染、肺部重度感染诊断价值较高。本研究结果将有助于临床上诊断支气管扩张患者是否发生肺部感染或感染严重程度,并有助于支气管扩张发病机制的探究。

