CXCL11和CXCR3在宫颈癌患者中的表达及其与高危型人乳头状瘤病毒感染的关系*
邓艳琴,高金菊
荆门市人民医院:1.妇科;2.产科,湖北荆门 448000
高危型人乳头状瘤病毒(HR-HPV)持续性感染是引发宫颈上皮内瘤变(CIN)、宫颈癌等宫颈病变的重要致病因素[1]。宫颈癌是最为严重的宫颈病变,其不仅与HR-HPV感染有关,还与癌基因激活、炎症反应、抑癌基因失活、免疫逃逸等有关[2-3]。研究发现,人乳头状瘤病毒(HPV)阳性感染可导致CXC趋化因子配体(CXCL)10分泌增多,而CXCL10可与CXC趋化因子受体-3(CXCR3)结合,激活相关通路,影响HPV免疫逃逸,促进癌变进程,CXCR3可能是治疗宫颈癌的潜在靶点[4]; CXCL11在头颈部鳞状细胞癌中呈高表达,CXCL11-CXCR3轴通过调节淋巴细胞浸润,影响炎症反应进而影响头颈部鳞状细胞癌发展[5]。但CXCL11在CIN、宫颈癌中的表达及其与CXCR3、HR-HPV感染的关系尚未明确,因此,本研究通过测定CXCL11、CXCR3在CIN、宫颈癌和宫颈炎中的表达情况,分析各自相关性,以期为临床防治宫颈病变提供依据。
1 资料与方法
1.1一般资料 收集2019年5月至2022年5月本院收治的205例宫颈病变患者的组织标本进行研究,其中75例宫颈癌患者为宫颈癌组,78例CIN患者为CIN组,52例宫颈炎患者为宫颈炎组。宫颈癌组:年龄35~69岁,平均(53.26±13.78)岁;体重44.97~68.53 kg,平均(56.12±8.94)kg。CIN组:年龄33~70岁,平均(52.95±13.63)岁;体重45.05~68.70 kg,平均(56.30±8.81)kg。宫颈炎组:年龄34~70岁,平均(53.38±13.87)岁;体重45.16~68.61 kg,平均(56.25±8.87)kg。宫颈癌组、CIN组、宫颈炎组女性年龄、体重比较,差异无统计学意义(P>0.05),具有可比性。
纳入标准:(1)CIN、宫颈癌患者符合《宫颈癌及癌前病变规范化诊疗指南(试行)》[6]中宫颈癌及CIN判定标准,经病理活检证实;(2)宫颈炎患者无恶性病变,为单纯宫颈炎;(3)患者未进行抗HPV治疗。排除标准:(1)合并其他恶性肿瘤者;(2)近半年接受放疗、免疫治疗、化疗者;(3)既往接受宫颈手术治疗者。研究对象对本研究知情同意,且本研究获得本院伦理委员会批准(批号:201904003)。
1.2仪器与试剂 兔抗人CXCL11单克隆抗体(货号:ab216157)、兔抗人CXCR3单克隆抗体(货号:ab288437)购自美国Abcam公司,山羊抗兔IgG(货号:PAB9405)购自上海群己生物科技有限公司,二氨基联苯胺显色试剂盒(货号:E-IR-R101)购自武汉伊莱瑞特生物科技股份有限公司,HPV-DNA分型检测试剂盒(批号:20181205)购自凯杰生物工程(深圳)有限公司,显微镜(型号:LV100)购自日本尼康公司,基因杂交信号扩大仪(型号:Digene DML 2000TM)购自广东信健医疗器械有限公司。
1.3方法
1.3.1组织标本收集 收集宫颈癌组和CIN组患者行全子宫切除术或宫颈锥切术的宫颈病变组织标本,收集宫颈炎组患者宫颈病变活检组织标本,均放置于无菌标本袋,由病理科统一检测。
1.3.2免疫组化法检测宫颈病变组织CXCL11、CXCR3表达 采用免疫组化法检测CXCL11、CXCR3表达:将收集的3组患者的宫颈病变组织进行石蜡包埋,取3 μm厚的组织切片,用二甲苯和梯度乙醇进行脱蜡、脱水处理,在3%过氧化氢溶液中进行孵育,孵育10 min后用磷酸盐缓冲液(PBS)冲洗3次,每次3 min,用枸橼酸盐缓冲液进行抗原修复,再用PBS冲洗3次,每次3 min,然后加入按1∶200稀释的一抗(兔抗人CXCL11、CXCR3单克隆抗体)各1滴,4 ℃孵育过夜,用PBS冲洗5次,每次3 min,再加入按1∶1 000稀释的二抗(山羊抗兔IgG)1滴,37 ℃孵育60 min,孵育后用PBS冲洗5次,每次3 min,最后使用二氨基联苯胺显色试剂盒进行显色,苏木素复染,梯度乙醇脱水,中性树胶封片,并在显微镜下拍照。随机选取5个有代表意义的视野(×200)评估染色情况,每个视野计数200个细胞,取平均值。根据阳性细胞比例(A)和染色程度(B)评分乘积[7]判断CXCL11、CXCR3表达情况。A:以阳性细胞比例>75%、50%~75%、25%~<50%、<25%分别记为3、2、1、0分;B:以染色程度黄褐色、棕黄色、淡黄色、无色分别记为3、2、1、0分。CXCL11、CXCR3表达评估结果:以A×B<3分为阴性,A×B≥3分为阳性。
1.3.3HR-HPV检测 使用取样器在宫颈外口黏膜处旋转4圈取样,置于取样管内,利用HPV-DNA分型检测试剂盒按第二代基因杂交捕获法测定HPV16、52、18、56、31、58、33、59、35、66、39、45、68、51型这14种HR-HPV-DNA表达。具体方法:(1)DNA双链在碱性条件下加热,分解为DNA单链;(2)由试剂盒提供RNA组合探针,通过碱基配对的原则与DNA单链重新组成RNA-DNA杂交复合物;(3)捕获特异性抗体与DNA-RNA杂交复合物;(4)第二抗体与RNA杂合体结合反应;(5)用基因杂交信号扩大仪进行定量检测。HR-HPV判定标准:以标本表达值相对光单位(RLU)/阳性标准品阈值(CO)定义为HR-HPV病毒负荷量,以RLU/CO<1.0为阴性,RLU/CO≥1.0为阳性。并统计宫颈炎组、CIN组及宫颈癌组患者HR-HPV单一感染及多重感染情况。
1.4统计学处理 采用SPSS25.0软件进行数据处理和分析。计数资料以例数和百分率表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1各组组织中CXCL11、CXCR3表达及HR-HPV感染情况比较 与宫颈炎组、CIN组比较,宫颈癌组宫颈病变组织CXCL11、CXCR3阳性表达率及HR-HPV阳性感染率升高(P<0.05);与宫颈炎组比较,CIN组CXCL11、CXCR3阳性表达率及HR-HPV阳性感染率升高(P<0.05)。见表1、图1。

注:A~C为CXCL11表达阴性的免疫组化图;D~F为CXCL11表达阳性的免疫组化图;G~I为CXCR3表达阴性的免疫组化图;J~L为CXCR3表达阳性的免疫组化图。图1 免疫组化图(×200)
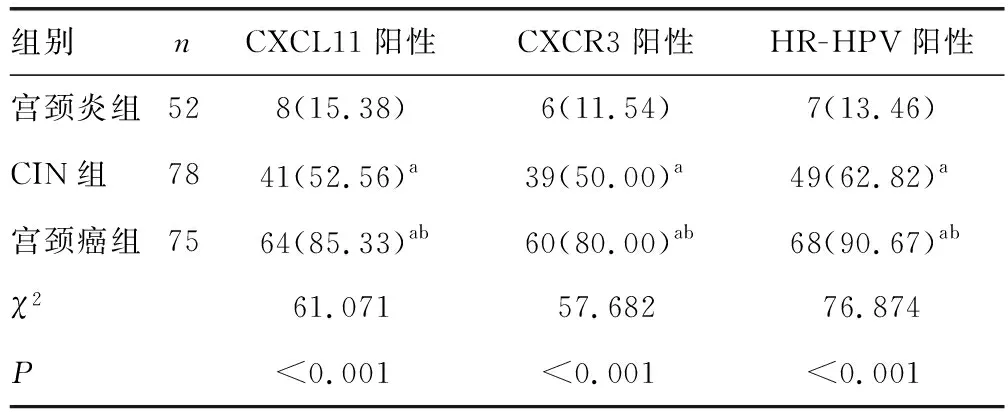
表1 各组组织中CXCL11、CXCR3表达及HR-HPV感染情况比较[n(%)]
2.2宫颈癌患者CXCL11、CXCR3表达及HR-HPV感染与临床病理参数的关系 宫颈癌患者宫颈病变组织CXCL11、CXCR3表达及HR-HPV感染与淋巴结转移、分化程度有关(P<0.05),与年龄、肿瘤最大径、肌层浸润及FIGO分期无关(P>0.05)。见表2。

表2 宫颈癌患者CXCL11、CXCR3表达及HR-HPV感染与临床病理参数的关系 [n(%)]
2.3宫颈癌患者HR-HPV感染结果及分型 宫颈癌患者中HR-HPV感染共68例,其中单一感染率为38.24%(26/68),单一感染类型分别为HPV16型(11例)、HPV18型(7例)、HPV33型(4例)、HPV52型(2例)、HPV58型(2例);多重感染率为61.76%(42/68),多重感染类型分别为HPV16+HPV18型(19例)、HPV16+HPV33型(8例)、HPV16+HPV31+HPV51型(6例)、HPV16+HPV18+HPV58型(6例)、HPV18+HPV51+HPV52型(3例)。
2.4宫颈癌患者不同HR-HPV感染类型CXCL11、CXCR3表达情况比较 与单一感染HR-HPV类型患者比较,多重感染HR-HPV类型患者宫颈病变组织CXCL11、CXCR3阳性表达率升高(P<0.05)。见表3。
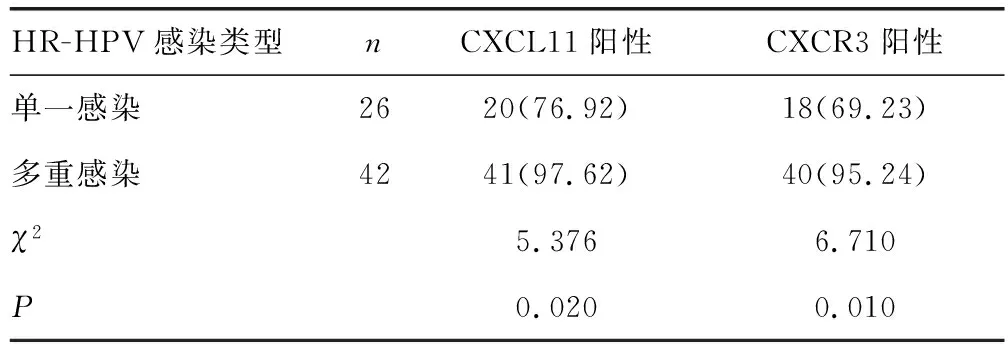
表3 宫颈癌患者不同HR-HPV感染类型CXCL11、CXCR3表达情况比较 [n(%)]
2.5宫颈癌患者CXCL11、CXCR3表达与HR-HPV感染的关系 宫颈癌患者宫颈病变组织CXCL11、CXCR3表达与HR-HPV感染有关(P<0.05)。见表4。
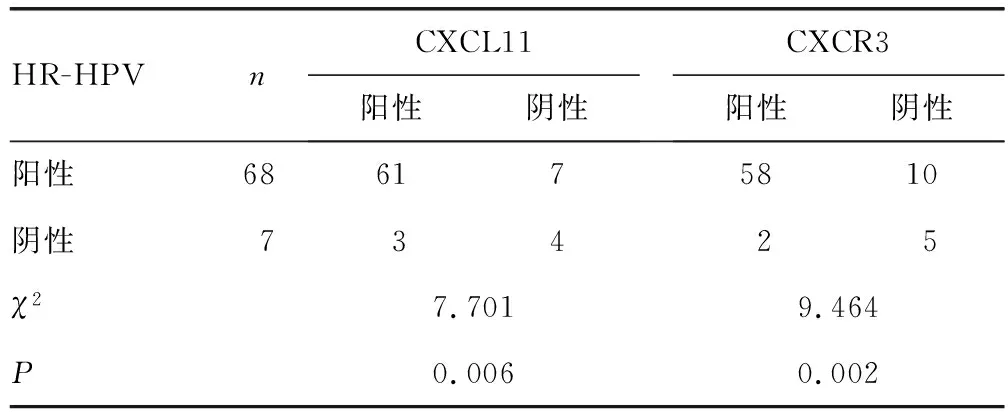
表4 宫颈癌患者CXCL11、CXCR3与HR-HPV感染的关系(n)
2.6宫颈癌患者CXCL11表达与CXCR3表达的关系 宫颈癌患者宫颈病变组织中CXCL11表达与CXCR3有关(χ2=12.311,P<0.05)。见表5。
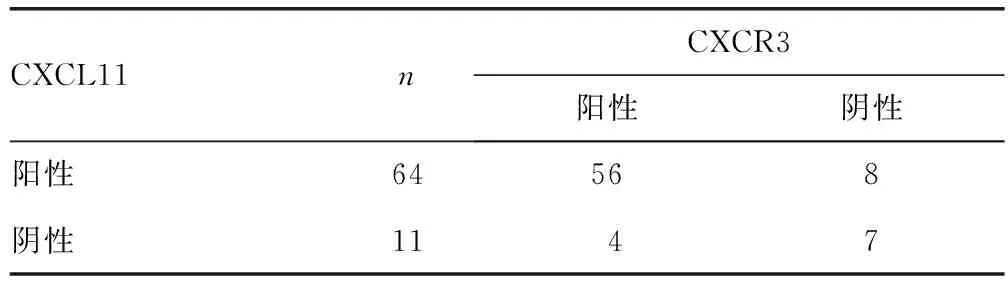
表5 宫颈癌患者CXCL11表达与CXCR3的关系(n)
3 讨 论
HPV是一种DNA病毒,其可通过感染宿主细胞,将自身DNA整合到宿主DNA上,且HR-HPV大多可整合到宿主细胞的基因中,进而影响癌基因、抑癌基因表达,其更易引起宫颈癌及CIN[8-9]。另外,宫颈癌的发生发展是一个渐变过程,其由慢性宫颈炎发展为CIN,CIN再进一步发展形成,病程较长[10]。因此,寻找与HR-HPV感染、宫颈病变有关的指标,及时干预,对早期防治宫颈癌有积极意义。
CXCL11是一种分泌蛋白,可与其受体CXCR3结合,进而趋化淋巴细胞,影响机体免疫应答,参与炎症反应,与感染、肿瘤关系密切[11-12]。研究发现,CXCL11在结肠癌中呈高表达,与分化程度、淋巴结转移相关,CXCL11可能是评估结肠癌患者预后的辅助指标[13];另外,CXCL11在口腔鳞状细胞癌中表达上调,可能通过调节有关基因表达,进而影响口腔鳞状细胞癌发生发展,CXCL11可能是诊治口腔鳞状细胞癌的潜在靶点[14]。但CXCL11在宫颈癌中的作用及与HR-HPV感染的关系尚不明确,因此本研究将CXCL11作为观察指标有一定的临床意义。本研究结果显示,宫颈病变程度越高,CXCL11阳性表达率越高,提示CXCL11可能与宫颈病变有关,推测高表达CXCL11可能与其受体CXCR3结合,进而影响机体免疫反应,促进炎症反应,加速宫颈病变,但其机制仍需深入探究证实。进一步研究显示,宫颈癌患者宫颈病变组织CXCL11表达与淋巴结转移、分化程度有关,提示CXCL11表达越高,宫颈癌患者肿瘤恶化程度越高,越易发生淋巴结转移,CXCL11可能与宫颈癌病理发展密切相关。HR-HPV持续感染可引发宫颈癌及CIN[15]。本研究中HR-HPV阳性感染率随宫颈病变程度加重而呈上升趋势,与张燕等[16]研究趋势相似,提示HR-HPV可能影响宫颈恶性转化进程。此外,本研究结果显示,宫颈癌患者HR-HPV感染与淋巴结转移、分化程度有关,与霍会蚕等[17]研究结果类似,表明宫颈癌的生物学行为可能与HR-HPV感染有关。本研究进一步分析了宫颈癌患者宫颈病变组织CXCL11表达与HR-HPV感染的关系,结果显示,CXCL11表达与HR-HPV感染有关,提示CXCL11可能与HR-HPV感染协同影响宫颈癌病变过程。
CXCR3主要表达在肥大细胞、自然杀伤细胞、T淋巴细胞表面上,可与其配体结合,进而趋化免疫细胞,调节免疫反应,影响肿瘤细胞迁移、增殖[18]。研究发现,CXCR3在肾细胞癌中表达升高,与肾细胞癌患者预后有关,CXCR3具有评估肾细胞癌预后的潜在价值[19];另外,CXCR3在套细胞淋巴瘤中呈过表达,与不良预后相关,CXCR3可能是套细胞淋巴瘤的治疗靶标[20]。但宫颈病变程度和HR-HPV感染中CXCR3的表达情况尚不明确,因此本研究测定CXCR3的表达有积极意义。本研究中宫颈病变组织CXCR3阳性表达率随宫颈病变程度加重呈升高趋势,提示CXCR3可能在宫颈癌及CIN中起重要作用,推测CXCR3可能与其配体结合,进而影响机体免疫功能,影响宫颈细胞异常增殖、迁移,从而促进宫颈癌及CIN进展过程,其机制有待进一步探讨。另外,本研究中宫颈癌患者宫颈病变组织CXCR3表达与淋巴结转移、分化程度有关,提示CXCR3可能与宫颈癌病理进展相关。进一步分析结果显示,宫颈癌患者宫颈病变组织CXCR3表达与HR-HPV感染有关,提示HR-HPV感染可能与CXCR3共同影响宫颈癌发生发展。另外,本研究发现,多重感染HR-HPV类型患者宫颈病变组织CXCL11、CXCR3阳性表达率高于单一感染HR-HPV类型患者,提示HR-HPV感染类型与宫颈癌患者CXCL11、CXCR3表达有关,多重感染HR-HPV患者可能通过增加CXCL11、CXCR3表达来促进宫颈癌进展。KUMARAVEL等[5]研究认为CXCL11-CXCR3轴影响头颈部鳞状细胞癌发生发展,因此,本研究分析了宫颈癌患者宫颈病变组织中CXCL11与CXCR3表达的关系,结果显示,CXCL11表达与CXCR3有关,提示CXCL11可能通过与CXCR3相互结合进而影响宫颈癌病变过程,但具体机制仍需深入探讨。
综上所述,CIN及宫颈癌患者宫颈病变组织CXCL11、CXCR3表达较高,CXCL11、CXCR3在宫颈癌患者中表达最高,其与HR-HPV感染有关,CXCL11、CXCR3可能是诊治宫颈癌的分子靶标。但本研究尚未深入探究CXCL11、CXCR3在宫颈癌中的作用机制,未分析CXCL11、CXCR3诊断宫颈癌的价值,且样本量较少,后期将扩大样本量,结合作用机制展开研究。

