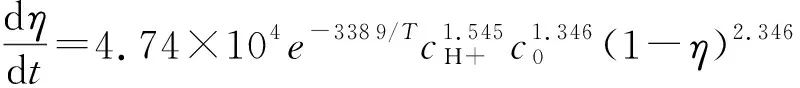考虑转化率的亚硝酸钠与氯化铵体系反应动力学
战永平, 罗明良, 付春丽, 刘纪康
(1.非常规油气开发教育部重点实验室(中国石油大学(华东)),山东青岛 266580; 2.中国石油大学(华东)石油工程学院,山东青岛 266580; 3.中国石油集团海洋工程有限公司,山东青岛 266520)
亚硝酸钠与氯化铵的反应是一个既放热又生气且不可逆的化学反应,具有生热/气量大、反应可控、安全隐患低、反应生成物友好等优点[1-3]。围绕价格低廉的NaNO2/NH4Cl体系,形成了针对蜡、沥青、油基泥饼等有机堵塞物[4-6]的自生热解堵和流动保障技术以及稠油油藏自生热开采技术[7-10];开发了针对边底水水侵,注入水低效或无效循环等问题的自生热泡沫调堵体系[11-14]以及针对压裂液低温破胶困难、返排率低、储层冷伤害等问题的自生热增能压裂液体系[15-19]。由于NaNO2/NH4Cl体系会生成氮氧化物NOX等副反应气体,上述技术或体系在实际应用时需要通过试验手段进行优化,制约了其应用效率。反应动力学方程是定量描述反应温度、反应物系各组分浓度、催化剂等因素与反应速率之间的函数关系式,可用于化学反应状况的预测。吴安明[20]等运用半衰期法得到H+浓度低于0.3326 mol/L(pH高于0.5)条件下NaNO2/NH4Cl生氮气反应动力学方程。Nguyen[21]等运用作图法和电离常数计算法得到H+浓度小于10-3mol/L(pH高于3)条件下NaNO2/NH4Cl生氮气反应动力学经验方程。王业飞等[22]利用作图法得到H+浓度低于0.0178 mol/L(pH高于1.75)条件下NaNO2/NH4Cl生氮气反应动力学方程。Bispo[23]等以反应生热速率数据为基础,运用非线性最小二乘法计算出H+浓度为10-2.96mol/L(pH为2.96)时NaNO2/NH4Cl反应生成氮气的反应动力学方程。这些动力学方程是均在NaNO2/NH4Cl完全反应的前提条件下而获得的。为有效开展NaNO2/NH4Cl体系化学反应情况的预测,笔者研究酸性条件下NaNO2/NH4Cl反应生氮气的临界H+浓度(或pH)和转化率,建立考虑反应转化率的反应动力学方程。
1 试 验
1.1 试剂及仪器
试剂:亚硝酸钠、氯化铵(分析纯,麦克林公司);盐酸(分析纯,四川西陇化工有限公司);蒸馏水(自制)。
仪器:DF-101S磁力搅拌器(巩义市科华仪器有限公司);CP512电子天平(精度0.000 1g,奥豪斯仪器(上海)有限公司);双层真空绝热三颈烧瓶(建湖县芦北玻璃厂);S-212恒速搅拌器(上海申顺生物科技有限公司);PHS-2F型pH计(上海精密科学仪器有限公司)。
1.2 试验方法
酸性条件下,H+浓度较高时,NaNO2/NH4Cl水溶液中的NO2-和H+会发生NO2-+H+→HNO2→NO2(红棕色)↑+NO↑+H2O副反应。在合适的H+浓度下,NH4Cl + NaNO2→N2↑+NaCl+2H2O,根据化学反应方程式可计算出理论上反应生成氮气的物质的量。根据理想气体状态方程可计算出实际生成氮气的物质的量。定义氮气生成反应的转化率为实际生成氮气的物质的量占理论反应生成氮气物质的量的比率,则
(1)
式中,η为生氮气反应的转化率;Vg为实际生成氮气体积,mL;Ta为环境温度,K;Vl为反应物体积,mL;p为室内大气压力,取值为105Pa;R为摩尔气体常数,8.314 J/(mol·K);c0为亚硝酸钠或氯化铵的初始物质的量浓度,mol/L。
利用绝热模式反应测试装置(图1),采用颜色观察法和排水采气法测定常压、绝热环境下不同反应物浓度、H+浓度(或pH)条件下颜色变化情况以及氮气生成量和体系温度变化情况。以是否有红棕色气体(黄烟)产生来确定临界H+浓度(pH)。基于氮气的生成量,利用式(1)确定氮气生成反应的转化率。在试验中,反应物物质的量浓度比为1∶1,反应物总体积为100 mL,NaNO2溶液和NH4Cl溶液各50 mL。常温下,将反应物溶液静置至室温,并测定初始温度;其他温度条件下,将配制好的反应物溶液、双层真空绝热三颈烧瓶放入烘箱预热至设定温度。插入pH计、温度传感器,将预热好的NaNO2溶液、NH4Cl溶液依次倒入双层真空绝热三颈烧瓶中,向反应物溶液中滴加盐酸溶液调节反应体系H+浓度(或pH)至设定值。反应测试到体系不再产气为止,反应时进行搅拌。
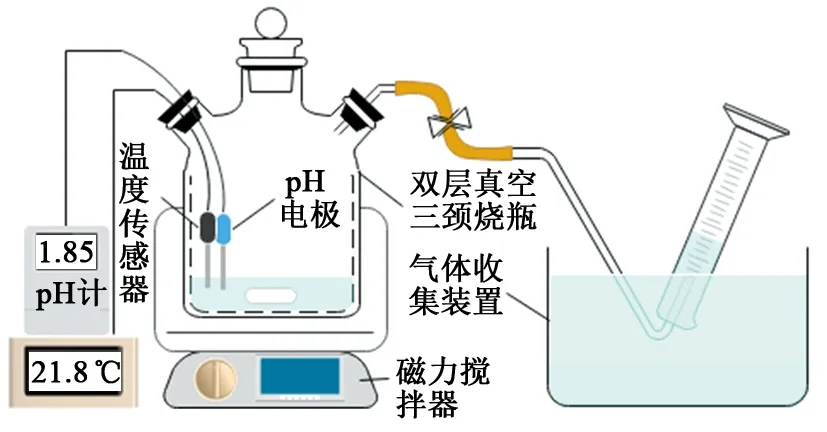
图1 绝热模式反应测试装置Fig.1 Adiabatic mode reaction test device
2 结果分析
2.1 临界H+浓度(或pH)
在常温下,NaNO2和NH4Cl浓度均为1.5 mol/L时,调整H+浓度(或pH)分别为0.0140(pH=1.85)、0.0178(pH=1.75)、0.0200(pH=1.70)、0.0225(pH=1.65)、0.0285(pH=1.55)、0.0356 mol/L(pH=1.45),观察系统颜色变化(表1)。由表1可知,当H+浓度为0.0140~0.0225 mol/L时,系统清澈无色。当H+浓度为0.0285 mol/L时,体系中NO2-和H+结合发生副反应生成氮氧化合物NOx使系统中出现淡淡的棕色,当H+浓度继续增大到0.0356 mol/L时,副反应程度增加,棕色雾状气体变得浓厚、明显。NO2、NO健康危害程度高,一旦生成,表明反应已经朝着不可控方向发展。因此酸性条件下H+浓度小于0.0225 mol/L(或pH≥1.65),NaNO2/NH4Cl的反应生氮气,且反应是可控的。
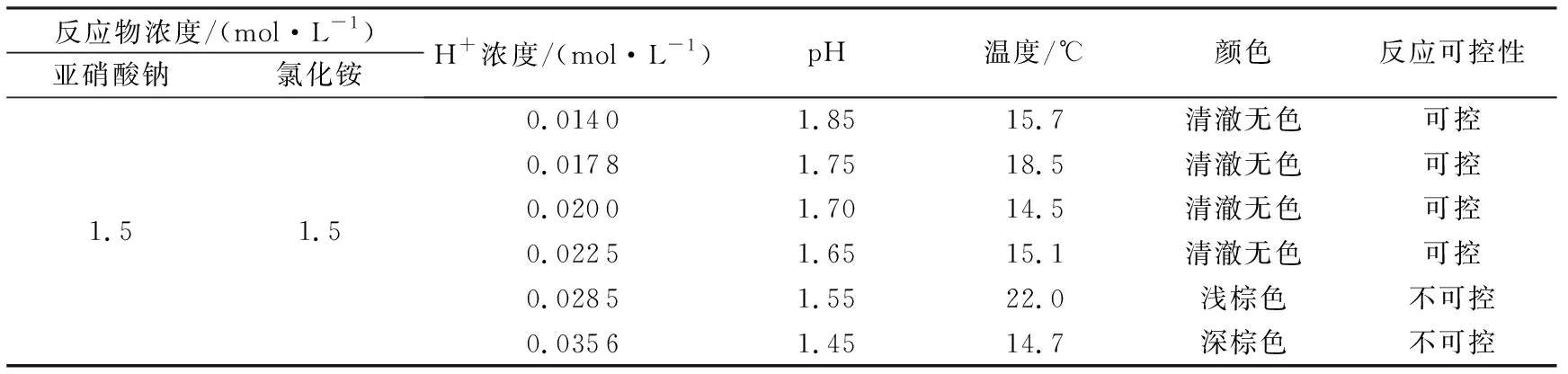
表1 不同H+浓度(或pH)下反应体系颜色Table 1 Reaction system color under different H+ concentrations (or pH)
2.2 生氮气反应转化率影响因素
2.2.1 反应物浓度影响
在常温下,H+浓度(或pH)为0.0178 mol/L(pH=1.75)时,调整NaNO2和NH4Cl浓度分别0.5、1.0、1.5、2.0、2.5、3.0 mol/L,测量氮气生成量(图2)。由图2可知,当反应物浓度c≤1.0 mol/L时,氮气生成量较低(低于130 mL),当c≥1.5 mol/L时,氮气生成量较高(高于1150 mL)。氮气生成量和生气速率随着反应物浓度的增加而增大。
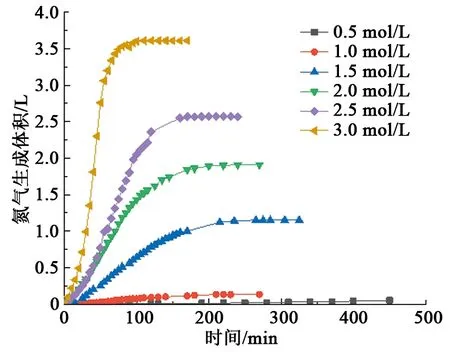
图2 常温下反应物浓度对氮气生成量的影响Fig.2 Effect of reaction concentrations on gas production
利用式(1)计算出反应物不同浓度时生氮气反应的转化率(表2)。由表2可知,生氮气反应的转化率整体上不高,反应物浓度增加到3.0 mol/L,其转化率也仅为50.42%,但转化率随着反应物浓度的增加而增大。反应物浓度高,转化率大,生气量高,其利用率也就越高。因此工程实际应用中应尽可能使用较高浓度,以达到物尽其用。
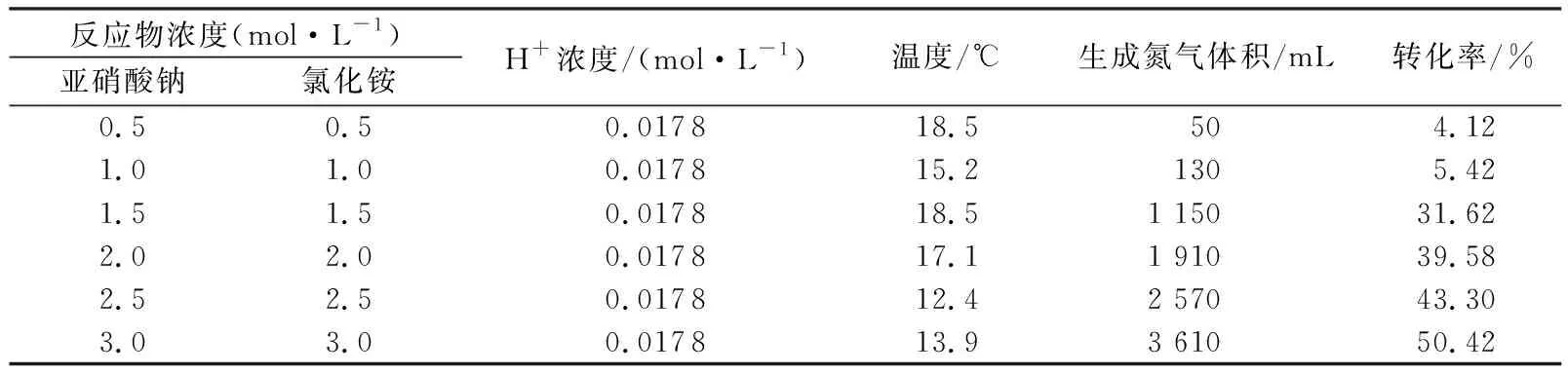
表2 常温下不同反应物浓度对反应转化率的影响Table 2 Effect of reaction concentrations on reactant conversion
2.2.2 H+浓度(或pH)影响
在常温下,NaNO2和NH4Cl物质的量浓度分别为1.5、2.0、3.0 mol/L时,调整H+浓度(或pH)分别为0.0140(pH=1.85)、0.0178(pH=1.75)、0.0200(pH=1.70)、0.0225 mol/L(pH=1.65),测量氮气的生成量(图3)。由图3可知,反应物浓度一定时,生气速率随H+浓度的增加而增加,氮气生成量随H+浓度增加而略微增大。Nguyen、王业飞[20-21]等认为亚硝酸钠与氯化铵体系的反应机制是,酸性条件下,2个亚硝酸根离子(NO2-)与2个氢离子(H+)动态平衡反应生成的1分子反应活性强于亚硝酸(HNO2)的三氧化二氮(N2O3)与1个铵根离子(NH4+)水解平衡反应生成的1分子氨(NH3)发生SN2亲核取代反应生成1分子亚硝胺(H2N-NO)和1分子亚硝酸(HNO2),由于亚硝胺活化能低,寿命只有10 ps,能快速转化为1分子N2和1分子H2O。因此酸性H+在生成氮气的反应过程中,每生成1分子的氮气,会消耗1个H+。当反应物的浓度和体积一定时,初始H+浓度越高,可参与反应的H+就越多,生成的氮气量就会越多。另外由于H+本身浓度较小,H+浓度增加也只是略微增大氮气的生成量。
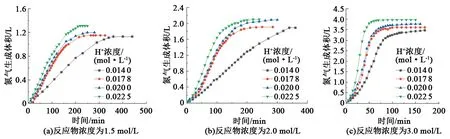
图3 常温下H+浓度对氮气生成量的影响Fig.3 Effect of H+ concentrations on gas production at room temperature
利用式(1)计算出H+浓度(pH)不同时NaNO2/NH4Cl体系生氮气反应的转化率(表3)。由表3可知,反应物浓度为1.5 mol/L时,氮气生成反应的转化率为31.37%~36.42%,相差5.05%;反应物浓度为2.0 mol/L时,氮气生成反应的转化率为39.36%~43.62%,相差4.26%;反应物浓度为3.0 mol/L时,氮气生成反应的转化率为47.57%~54.95%,相差7.38%。反应物浓度一定,在临界H+浓度以下,NaNO2/NH4Cl体系氮气生成反应的转化率随H+浓度的增加而增大,但增大幅度有限,试验范围内最大增幅为7.38%。
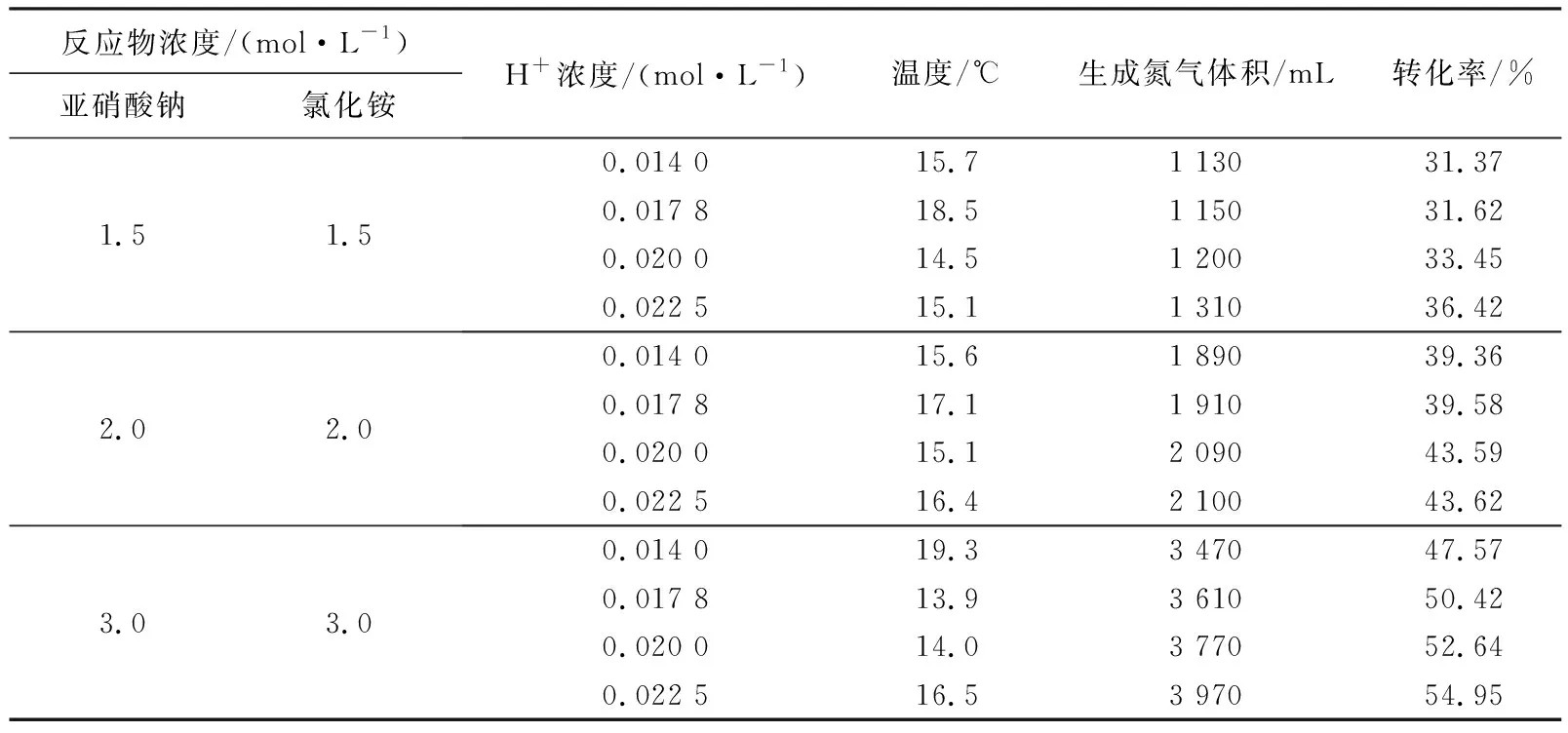
表3 常温下H+浓度对反应转化率的影响Table 3 Effect of H+ concentrations on reactant conversion at room temperature
2.2.3 反应初始温度影响
在NaNO2和NH4Cl物质的量浓度均为1.5 mol/L、H+浓度(或pH)为0.017 8 mol/L(pH=1.75),反应初始温度为18.5、30、40 ℃时,测量氮气的生成量,结果见图4。
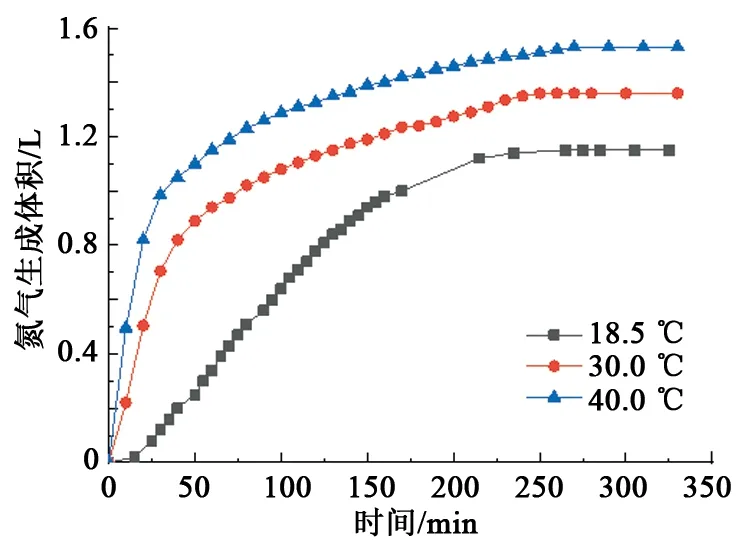
图4 初始温度对氮气生成量的影响Fig.4 Effect of initial temperatures on gas production
由图4可知,反应物浓度、H+浓度一定时,生气速率随反应初始温度的升高而变快,氮气生成量随着反应初始温度的升高而略微增大。反应初始温度高,NaNO2/NH4Cl体系的能量大,反应活性高,一方面加快了反应生气速率;另一方面促进了NH4+离子的水解反应,增加了体系中H+的浓度,增大了氮气生成量,但由于水解反应所产生H+浓度增加只体现在pH变化上,量级比较小。因此温度的增加也只是略微增大氮气的生成量。
利用式(1)计算出温度不同时NaNO2/NH4Cl体系生氮气反应的转化率(表4)。由表4可知,反应物浓度为1.5 mol/L、H+浓度为0.0178 mol/L时,随着反应初始温度的增加,生氮气反应的转化率逐渐增大,但总体相差不大,在试验温度范围内仅相差7.56%。

表4 初始温度对反应转化率的影响Table 4 Effect of initial temperatures on reactant conversion
2.3 影响因素相关性分析
由NaNO2/NH4Cl体系的试验结果可知,酸性条件下NaNO2与NH4Cl反应生成氮气的物质的量小于按照化学方程式完全转化氮气的物质的量,即体系生氮气的反应并不是100%转化,而是存在一个反应转化率。反应物的浓度、H+浓度、反应初始温度对体系生氮气反应的转化率均有影响。以表3、4的数据为样本,采用灰色关联分析方法,以转化率数据为参考数列,以反应物浓度、H+浓度、初始温度等数据为比对数列,计算各影响因素与转化率的关联度:
k=1,2,3,…,n.
(2)
式中,Xi(k)为第i个参数归一化的无量纲值;i和k为参数序号;Xi(k)为各因素参数值;Xmin为各因素参数中最小值;Xmax为各因素参数中最大值。
(3)
式中,X0(k)和Xi(k)分别为参考数列和比较数列;ρ为分辨系数,取值为0.5。
(4)
式中,γi为关联度。
结果表明,生氮气反应的转化率与反应物浓度、H+浓度和温度的关联度分别为0.80、0.64和0.57,表明转化率与反应物浓度的关联度相关性最强。
3 考虑转化率的反应动力学方程
3.1 参数的确定
NaNO2和NH4Cl物质的量浓度相同时,反应动力学方程可表示为
(5)
式中,cH+为H+浓度,mol/L;t为反应时间,min;T为体系温度,K;A为指前因子;ΔE为活化能,J/mol;m为氢离子的反应级数;n为反应物的反应级数。
引入转化率η,反应动力学方程为
(6)
对式(6)分离变量积分有
(7)
根据NaNO2/NH4Cl体系的试验结果,式(7)中的H+浓度、反应物初始浓度已知。反应时间、体系温度、氮气生成转化率可以试验测得,也是已知。未知量只有A、ΔE、m、n等4个。由于NaNO2/NH4Cl体系反应生成氮气同时会释放热量,导致体系温度升高。为了计算上述4个未知量,需要建立体系温度、氮气生成反应的转化率与时间的对应关系。为此测试常温绝热条件下反应物浓度为1.5 mol/L、H+浓度为0.0140、0.0178 mol/L,反应物浓度为2.0 mol/L、H+浓度为0.0225 mol/L,反应物浓度为3.0 mol/L、H+浓度为0.0178 mol/L时体系不同时刻对应的温度及氮气生成量,并根据式(1)计算出生氮气的转化率(表5)。取峰值温度对应的时间和转化率,结合反应物初始浓度、H+浓度等试验参数,建立以A、ΔE、m、n等为未知量的方程组如下:

表5 NaNO2/NH4Cl体系不同时间的温度及转化率Table 5 Temperatures and reactant conversion for NaNO2/NH4Cl at different moment
(8)
利用POLYMATH 6.10软件,设初始值n(0)=2,m(0)=1,ΔE(0)=1.57×104,A(0)=7×107,采用牛顿-拉斐逊迭代方法对非线性方程组(8)进行计算,得到A=4.74×104min-1·(L/mol)2.891,ΔE=2.818×104J/mol,m=1.545,n=2.346。则有
(9)
(10)
3.2 NaNO2/NH4Cl体系反应预测方法
H+浓度小于等于0.0225 mol/L的酸性条件下,NaNO2和NH4Cl浓度相同时发生如下反应:
NaNO2+NH4Cl→N2↑+NaCl+2H2O,ΔH=
-332.58 kJ/mol.
(11)
释放出的热量使体系温度升高,根据吸/放热公式,则
c0VlηΔH=clml(Tt-T0).
(12)
式中,ΔH为反应的热焓,kJ/mol;cl为体系的比热容,J/(kg·K);ml为体系的质量,kg;Tt为t时刻体系温度,K;T0为体系初始温度,K。
根据公式(10)~(12),可对NaNO2/NH4Cl体系反应情况进行预测。
(1) 选择反应物初始浓度c0,H+浓度cH+,反应初始温度T0,反应时间t,估计氮气生成反应转化率η0;
(2) 利用式(10)计算出对应的体系温度Tt,再根据化学反应方程式(11)和公式(12)计算出体系温度Tt对应的ηT;
(3) 将ηT与η0进行比较,若|ηT-η0|>ε(ε是指允许的误差),则以新的η0为估计值重复第(2)步计算,使|ηT-η0|<ε,即得到反应时间t时刻时的ηT、Tt;
(4)改变反应时间t1,估计氮气生成反应转化率η1,重复(2)~(3),然后依次改变反应时间,可计算出c0,cH+,T0条件下NaNO2/NH4Cl体系反应情况。
4 结 论
(1) 对于NaNO2/NH4Cl体系,酸性条件下氮气生成反应的H+浓度界限为cH+≤0.0225 mol/L(或pH≥1.65)。
(2) NaNO2与NH4Cl生成氮气的反应并不是100%转化为氮气,而是存在一个反应转化率。氮气生成反应的转化率与反应物浓度相关性最高,其关联度达到0.8,随着反应物和H+浓度增大,温度升高而增大。