超声刀辅助下腮腺良性肿瘤包膜外切除的临床疗效分析
倪海林
江苏大学附属句容医院(句容市人民医院)口腔科,江苏句容 212400
腮腺肿瘤是唾液腺肿瘤中的主要类型,在后者中的占比约为80%,以良性为主,多存在于腮腺前叶,腮腺区有可活动性的包块,边界比较清晰[1]。外科手术是治疗此病的主要方式,传统术式切除肿瘤时会切除较多正常腺体组织,过度解剖面部神经,保护不到位,可导致多种并发症[2]。现阶段,临床对该疾病的认知不断提高,提出腮腺良性肿瘤包膜外切除术,该术式以肿瘤大小和所在位置为依据,选择性解剖与保护神经组织,于病灶边缘正常腺体组织内分离并切除病灶,最大限度保留正常组织[3]。超声刀治疗是在机械高频振动压力下切割和封闭组织,可体现功能性外科特点,能够同时完成切割与止血操作[4]。目前,超声刀技术在外科领域中被广泛应用,但在腮腺手术中的应用价值尚未明确,未形成统一标准。基于此背景,本研究选取2017年1月—2021年12月江苏大学附属句容医院(句容市人民医院)口腔科收治的50例腮腺良性肿瘤患者,分析电刀下包膜外切除术和超声刀辅助下腮腺良性肿瘤包膜外切除中的作用。现报道如下。
1 资料与方法
1.1 一般资料
选取本院口腔科收治的50例腮腺良性肿瘤患者,经随机数字表法平均分为对照组和观察组,各25例。对照组男14例,女11例;年龄22~66岁,平均(44.12±2.32)岁;病程4~20个月,平均(12.18±2.44)个月;肿瘤直径18~40 mm,平均(27.78±4.12)mm;病理类型:多形性腺瘤17例,沃辛瘤7例,乳腺状囊腺瘤1例。观察组男12例,女13例;年龄20~65岁,平均(43.72±2.56)岁;病程5~18个月,平均(12.32±2.16)个月;肿瘤直径18~40 mm,平均(27.12±4.18)mm;病理类型:多形性腺瘤15例,沃辛瘤8例,乳腺状囊腺瘤2例。两组研究对象一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究所选病例经过医学伦理委员会批准,患者与家属知情同意。
1.2 纳入与排除标准
纳入标准:①满足腮腺良性肿瘤诊断标准[5],单侧病变患者;②患者年龄20~65岁;③患者手术耐受度高;④对本次研究高度配合者;⑤患者资料完整,数据真实可靠。排除标准:①伴随严重器质性疾病者;②凝血或造血功能受损者;③确诊其他同类型疾病者;④进行其他治疗者;⑤受主客观因素退出研究者。
1.3 方法
两组患者均行腮腺良性肿瘤包膜外切除术,取仰卧位,协助并指导患者头向健侧偏去,所用麻醉方式为全身麻醉,依据标准流程消毒铺巾,于耳垂前绕至耳垂后经颌后窝至下颌角行一“S”形切口,根据肿瘤大小确定切口长度,术中确保肿瘤外露充分,便于切除;同时根据皮肤纹路调整伤口。使用手术刀按照由外至内的顺序将表层皮肤、皮下组织和颈阔肌逐层切开,对照组用电刀于颈阔肌深处和腮腺咬肌浅筋膜处对瓣膜行分离处理,自胸锁乳突肌前继续分离,操作过程中做好耳大神经主干保护工作,切断腮腺支时,保护患者耳垂支和耳后支,松解腮腺下极;于下颌后静脉浅层处确定面部神经下颌缘支位置,顺行解剖,必要时,面神经、面颈干至总干均须暴露,操作时注意病灶与面部神经和下颌后静脉的位置,将肿瘤表面的腺体组织掀起,自下而上于肿瘤包膜外行分离处理,脱出肿物,完整切除;生理盐水冲洗创面并止血,复位腺体组织,逐层缝合,修复并缝合受损腮腺咬肌筋膜,予以负压引流。观察组用超声刀解剖与分离腺体组织,于肿瘤表面自下而上对肿瘤行游离处理,妥善保护面神经和肿瘤包膜,工作时间为3~5 s/次;肿瘤切除后,复位缝合筋膜与腺体,恢复其原有位置,使用美容缝线,关闭创口。
两组术后均加压包扎,2~4 d后拔管,1周后拆线,遵照医嘱使用抗生素预防感染,禁食酸性和刺激性食物。
1.4 观察指标
1.4.1 手术指标 包括手术时间、术中出血量、术后引流时间、术后引流量和住院时间。
1.4.2 面部神经功能 判定依据为H-B面神经功能分级量表[6],完全恢复正常,功能值达到100%,为Ⅰ级;存在轻度功能障碍,功能值76%~99%为Ⅱ级;中度功能障碍,功能值51%~75%为Ⅲ级;重度功能障碍,功能值26%~50%为Ⅳ级;严重功能障碍,功能值≤25%为Ⅴ级;面部神经完全麻木,功能值为0%为Ⅵ级;等级越高提示面部神经功能越差。
1.4.3 并发症发生率 包括暂时性面瘫、腮腺瘘、Frey综合征和口干。
1.5 统计方法
采用SPSS 22.0统计学软件处理数据,符合正态分布的计量资料以()表示,进行t检验;计数资料以[n(%)]表示,进行χ2检验;等级资料采用秩和检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者手术指标对比
与对照组相比,观察组手术时间、术后引流时间和住院时间更短,术中出血量和术后引流量更少,差异有统计学意义(P<0.05)。见表1。
表1 两组患者手术指标对比()

表1 两组患者手术指标对比()
组别对照组(n=25)观察组(n=25)t值P值手术时间(min)112.34±12.18 80.78±10.32 9.885<0.001术中出血量(mL)54.72±8.16 40.18±6.72 6.877<0.001术后引流量(mL)85.32±7.18 64.24±5.44 11.701<0.001术后引流时间(h)60.72±12.24 44.16±7.18 5.835<0.001住院时间(d)7.56±1.21 6.12±1.14 4.331<0.001
2.2 两组患者面部神经功能对比
观察组面部神经功能优于对照组,差异有统计学意义(P<0.05)。见表2。
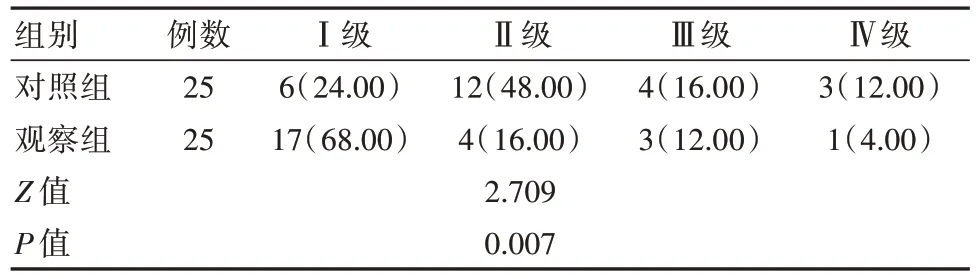
表2 两组患者面部神经功能对比[n(%)]
2.3 两组患者并发症对比
观察组并发症发生率低于对照组,差异有统计学意义(P<0.05)。见表3。
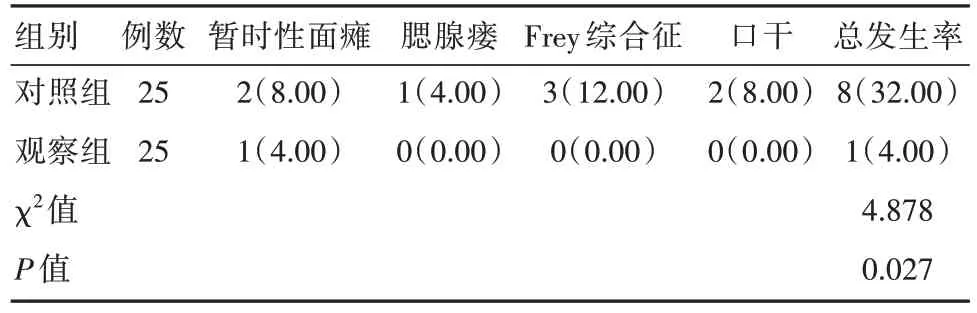
表3 两组患者并发症对比[n(%)]
3 讨论
从解剖结构看,腮腺咬肌筋膜致密坚韧,内有大量纤维小隔将腮腺组织分成多个分支,组织内结构繁琐复杂,分离难度大。腮腺肿瘤多为良性,临床多用外科手术治疗。多数腮腺肿瘤位于腮腺浅叶,与正常组织界限模糊,浸润包膜时,有恶变倾向,仅剜除肿瘤,术后复发率高。腮腺肿瘤性质及肿瘤与面部神经的关系决定其是否对面神经造成侵犯和侵犯程度,同时部分肿瘤组织与面神经有不同程度粘连,部分神经组织分支紧贴或被包膜包裹[6-7]。因此在切除腮腺肿瘤时,应注意解剖结构,保留面神经,以降低面瘫风险。
腮腺功能性外科以肿瘤根治为基础,旨在最大限度保留腮腺及相关组织功能。腮腺良性肿瘤包膜外切除术被广泛应用,具体操作时,需在距离包膜2~3 mm的腺体组织上对肿瘤行分离处理,必要时可解剖与保护面神经,以完整切除肿瘤,保持面部外形和功能的完整性[8]。腮腺手术关键在于解剖面部神经,避免神经损伤是手术成功与否的重要标志。腮腺内神经组织呈放射状态,与血管相伴而行,血运丰富;腮腺内外面神经分支愈多,越容易导致术中损伤,术野清晰可避免面神经损伤,需控制出血。
传统手术中多用电刀,经高温碳化肿瘤组织,使其结痂,热效高,对周围组织损伤明显,可有出血风险。超声刀可在切割病变组织的同时发挥止血作用,止血效果好,可减少结扎、止血等操作步骤,缩短手术时间,减少出血量和引流量,利于患者术后维持良好生理状态。与电刀比较,超声刀通过超声频率接触组织产生机械震荡作用,将机械振动时产生的能量传递至手持器械,能量温度控制在50~100℃之间,崩解细胞,改变蛋白多糖和胶原纤维性质与状态,切除组织的同时,可封闭血管;热传播距离小,可有效保护周围邻近组织,较少出现术后局部反应[9]。
本文数据显示,观察组手术时间、术中出血量少于对照组(P<0.05),原因在于超声集合切割、止血于一体,温度和热传导低于电刀,无焦痂形成,烟雾少,术野清晰,具有分离钳功能,可从不同角度分离组织,操作灵活,无须更换器械;加上智能组织感应技术的应用,可控制刀头温度,减少热量扩散,刀头与组织粘连概率低,切割速度明显提高;切割的同时可促进组织凝固,形成牢固创面,降低出血风险[10]。
本研究中,观察组住院时间为(6.12±1.14)d,短于对照组,术后引流量为(64.24±5.44)mL,少于对照组;面部神经功能明显优于对照组;并发症发生率为4.00%,低于对照组的32.00%(P<0.05),分析其原因是,与电刀比较,超声刀热度低,热传导距离短,对邻近组织热损伤小。热损伤可对面部神经纤维造成直接性损伤,破坏细胞膜,促进细胞溶解,也对面部神经血供有破坏,导致缺血性损伤,影响局部微循环状态,抑制神经再生。超声刀在分离与切割肿瘤组织的同时,应注意保护面神经,可降低暂时性面瘫风险,利于面部神经功能恢复。此外,超声刀的物理特性使其可同时掀起腮腺咬肌筋膜和部分腺体组织,暴露肿瘤,对腮腺咬肌筋膜和腺体组织的损伤减小,切除病灶后行复位处理并逐层缝合,可有效修复受损面部组织,抑制交感神经和副交感神经弥散纤维再生,有效预防Frey综合征[11]。学者钟树圣[12]对比超声刀和电刀的作用,结果显示:试验组手术时间为(6.23±0.75)d,短于对照组,术后引流量为(50.29±9.86)mL,与对照组比较更少(P<0.05),再次验证了文中观点。学者李常东等[13]的研究结果显示,对照组出现并发症的概率为27.27%,高于观察组的6.25%,与文中观点一致。本研究中,观察组总体疗效优于对照组,但有1例暂时性面瘫患者,需注意以下几点[14-15]:①术者需熟知面部神经解剖走向,术前经CT定位,明确肿瘤与面部神经对应位置关系,术中仔细剖析辨认,以免损伤;②与蚊式钳比较,超声刀不适合精细操作,解剖多形性腺瘤时难度高,易分离过度,损伤神经;③连续使用超声刀金属侧,可产生较高温度,接触血管、神经后,可引起组织蛋白不可逆性坏死,应注意冷却刀头;④超声刀无电流刺激,不引起肌肉抽动,缺少预警作用,不可盲目沿肿瘤包膜外钳夹切割,以免盲目操作,损伤面部神经。
综上所述,超声刀辅助下包膜外切除术治疗腮腺良性肿瘤对手术指标和面部神经功能有改善作用,术后并发症少,可推广。

