大白菜BrFLC及BrFRI-LIKE基因对低温的响应及其与抽薹性状的关系研究
周麟笔, 马关鹏, 赵夏云, 刘 峰, 刘 炼, 赵大芹
(1.贵州省农业科学院园艺研究所, 贵阳 550006; 2.贵州省园艺工程技术研究中心, 贵阳 550006;3.宁波城市职业技术学院景观生态学院, 浙江 宁波 315100)
大白菜(BrassicarapaL. ssp.pekinensis)属十字花科芸薹属作物,是我国最重要的叶用蔬菜之一。2月正季多数大白菜抽薹开花,3—5月是蔬菜淡季,特别是大白菜淡季,因此种植春大白菜能取得很好的经济效益。然而,越冬或早春栽培大白菜时,品种耐抽薹性不够强就极易未熟抽薹,导致减产。因此,培育强耐抽薹性的春大白菜品种是一个非常重要的育种方向。 同时,揭示大白菜抽薹开花的调控机制,对鉴选耐抽薹性强的育种材料,创制特耐抽薹大白菜新品种具有十分重要的意义。植物成花过程受内部遗传因子和外界环境因素共同调控[1],目前大量研究总结出了6条主要的开花调控途径,即春化途径、自主途径、光周期途径、赤霉素途径、温度途径和年龄途径[2-6]。近年来,又有学者发现了2条新的开花调控途径,即脱落酸途径[7]和油菜素甾醇途径[8]。这些调控途径构成了复杂又精密的成花调控网络。大白菜属于低温长日照植物,需经历一定时间的低温春化才能抽薹开花。FLOWERINGLOCUSC(FLC)和FRIGIDA(FRI)是决定拟南芥开花时间的两个主要基因[9-10]。FLC作为春化途径的关键基因,编码了一个可以抑制开花的MADS-box 转录因子,这类转录因子通过结合启动子抑制一组包括FT(FLOWERINGLOCUST)和SOC1(SUPPRESSOROFOVEREXPRESSIONOFCO1)在内的开花激活因子基因的转录抑制开花,拟南芥春化过程主要是通过改变开花抑制基因FLC染色质结构,抑制FLC的表达[11-12],以解除FLC对下游FT和SOC1等开花激活因子基因表达的抑制,从而促进开花[13-15]。FRI是FLC的转录激活因子,在FLC上游与FRIGIDA-LIKE 1 (FRL 1),FRIGIDA-ESSENTIAL 1 (FES 1), SUPPRESSOR OF FRIGIDA 4 (SUF 4)和FLC EXPRESSOR (FLX) 等相互作用形成FRI复合体,结合到FLC启动子特殊区域,诱导FLC的表达进而抑制开花[16-18]。Michaels等[19]研究表明,FRL 1在FRI促进FLC表达方面起特异性作用,且FRL 1、FRL 2和FRI都是冬季生态型拟南芥的习性所必需的。迄今为止,在白菜类植物中已克隆到BrFLC1、BrFLC2、BrFLC3和BrFLC5这4个拟南芥FLC的同源基因及2个拟南芥FRI的同源基因BrFRIa和BrFRIb[20-21],大白菜BrFLC与拟南芥FLC基因的功能相似,且不同抽薹性的大白菜对春化的敏感程度也不相同[22-23]。目前对大白菜BrFLC基因的研究主要集中在BrFLC碱基突变或缺失与抽薹性状相关性方面,但多个BrFLC基因对低温的响应及与抽薹性状的关系尚不完全清楚。关于大白菜中拟南芥FRI、FRL等FRI-LIKE(FRIGIDA-LIKE)基因家族成员同源基因的研究也鲜有报道。
本研究通过自然低温春化对5份大白菜材料进行耐抽薹性鉴定及研究人工低温春化对现蕾期的影响,初步探究4个大白菜BrFLC基因及4个BrFRI-LIKE基因对低温的响应机制,为进一步解析BrFLC及BrFRI-LIKE基因的功能,筛选耐抽薹性鉴定的候选基因提供参考。
1 材料与方法
1.1 试验材料
供试材料为贵州省农业科学院园艺研究所大白菜课题组自育的5个大白菜品系:ZQY-75,ZQB-5,ZCB-3,ZRY-2,ZLQ-1。
1.2 大白菜低温春化试验
1.2.1大白菜自然低温春化试验
2021年10月29日,对参试材料进行穴盘育苗,2021年12月8日地膜覆盖定植于田间,每个材料种植20株,在试验过程中记录试验地的气温情况,分别统计各材料的成熟期、生育期[24]及现蕾期。在十字花科蔬菜耐抽薹性快速、高效鉴定的方法中,现蕾期是最可靠的指标之一[25],因此本试验选用现蕾期作为耐抽薹性评价的指标。
耐抽薹性评价标准:现蕾期<120 d为不耐抽薹,120 d<现蕾期<140 d为一般耐抽薹,140 d<现蕾期<150 d为耐抽薹,现蕾期>150 d为强耐抽薹。
1.2.2大白菜人工低温春化试验
2022年3月24日,挑选籽粒饱满的种子播种于花盆中,每个材料种20株,于25 ℃长日照条件(16 h光照,光照为2 000 lx)下进行培养。培养14 d后,将植株转移到光照培养箱中,于4 ℃的低温条件下培养50 d后,转移至22 ℃的长日照条件(14 h光照,光照为2 000 lx)下生长(模拟贵阳5—6月气候及光照条件设定)。统计各材料低温处理结束至现蕾天数和现蕾期。
1.3 RT-qPCR试验材料处理
将参试材料的种子消毒后,分别播种于含1%(W/V)蔗糖的MS固体培养基上,于25 ℃长日照条件(16 h光照)下培养。将培养14 d的幼苗转移至光照培养箱中进行4 ℃低温处理,分别于处理后0 h,48 h,72 h,96 h,144 h对幼苗进行取样,每次取样后迅速将材料置于液氮中速冻,并于-80 ℃保存备用。
1.4 目的基因的获得
在BRAD数据库(http://brassicadb.cn)中,下载拟南芥FLC、FRI、FRL1、FRL 2蛋白序列及大白菜全基因组蛋白序列文件(Brara Chiifu V 3.5 版本)和gff 3文件,构建本地BLASTP数据库。将上述拟南芥蛋白序列进行本地BLASTP,剔除冗余序列后,使用SMART(https://smart.embl.de/)和Pfam数据库(http://pfam.xfam.org/)进行蛋白保守结构域鉴定,最终确定大白菜BrFLC、BrFRI及BrFRL1、BrFRL2基因信息。
1.5 基因表达分析
试验采用天根公司的RNAprep Pure植物总RNA提取试剂盒提取植株的总RNA,使用TAKARA公司反转录试剂盒PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time),按照说明书操作合成cDNA。以大白菜BrTub-α为内参基因,引物设计参照Xiao等[26]的方法,根据目的基因序列信息设计RT-qPCR引物(表1),并通过PCR验证引物的特异性。采用南京诺唯赞生物公司AceQ qPCR SYBR Green Master Mix试剂盒,使用BIO-RAD CFX 96荧光定量PCR仪,进行RT-qPCR。反应体系及程序参照RT-qPCR试剂盒说明书。每个样品设3次重复。采用2-△△CT的方法计算基因的相对表达量[27],采用Microsoft Excel 2019软件进行数据处理,SPSS 20.0软件进行多重比较。

表1 RT-qPCR引物信息
2 结果与分析
2.1 自然低温春化条件下大白菜的耐抽薹性比较
根据试验期间试验地的气温统计情况(表2),在整个试验期内,月平均最低气温4.20 ℃,出现在2022年2月,日均气温10 ℃以下累计有100 d,4 ℃以下累计有34 d,完全能满足大白菜对春化温度和时间要求,利于大白菜耐抽薹性的鉴定评价。观察记录参试大白菜的成熟期,分别计算各材料的生育期和现蕾期(表3),统计结果显示,ZCB-3的生育期最长,为139 d,在参试材料中属于较晚熟品种, ZRY-2、ZLQ-1在2月下旬出现未熟抽薹,未能比较其品种熟性(表3);ZCB-3现蕾期最晚,为156.75 d,ZRY-2现蕾期最早,为113.85 d。参试材料的耐抽薹性由强到弱依次为ZCB-3、ZQB-5、ZQY-75、ZLQ-1、ZRY-2。耐抽薹性鉴定结果显示,ZCB-3属强耐抽薹材料,ZQB-5属耐抽薹材料,ZQY-75属一般耐抽薹材料,ZRY-2、ZLQ-1均为不耐抽薹材料。
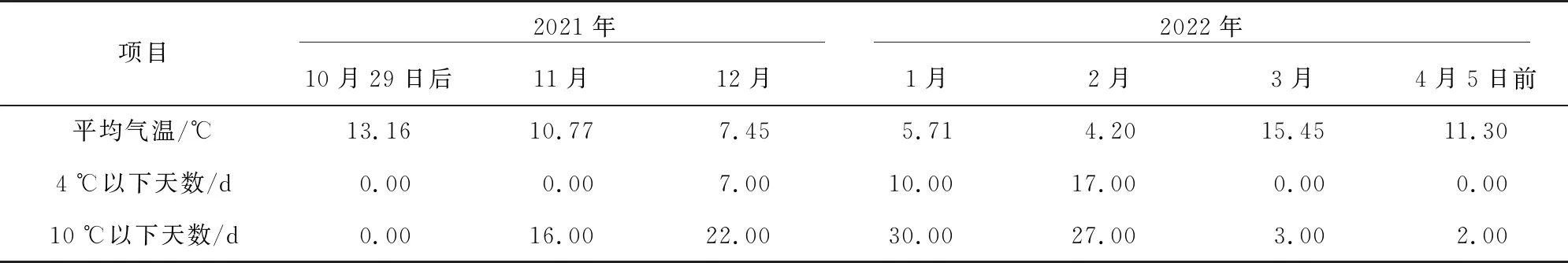
表2 试验期间气温统计
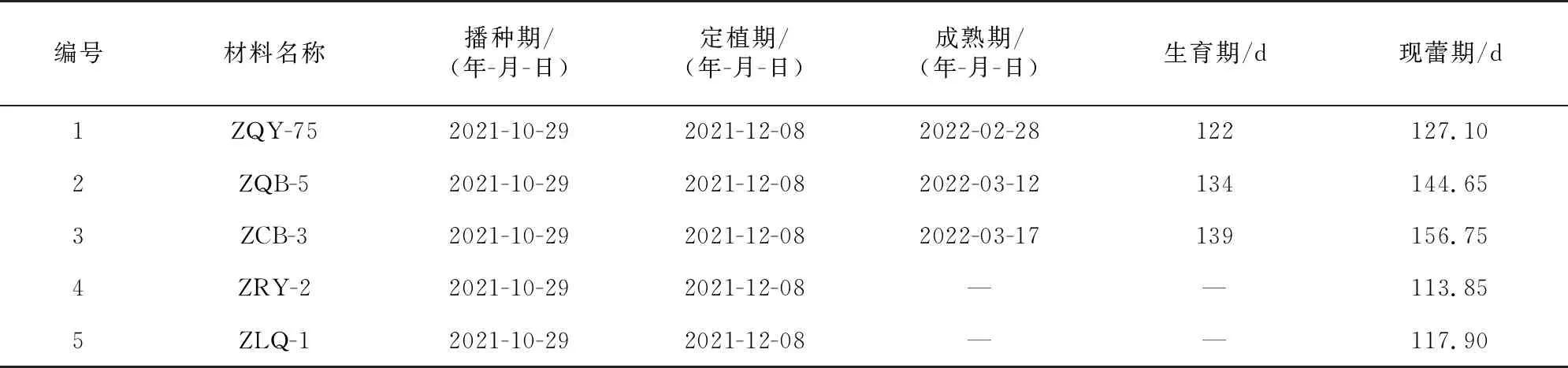
表3 大白菜物候期及现蕾期调查统计
2.2 人工低温春化对大白菜现蕾时间的影响
幼苗经过4 ℃的低温处理50 d后,ZCB-3需46.1 d才能全部现蕾,其次是ZQB-5,需要38.9 d,ZRY-2所需时间最短,在低温处理后9.6 d完全现蕾(表4)。ZQY-75、ZQB-5、ZCB-3、ZRY-2、ZLQ-1现蕾期较自然低温春化下分别提早43.1 d,41.75 d,46.65 d,40.25 d,41.8 d(表3,表4)。
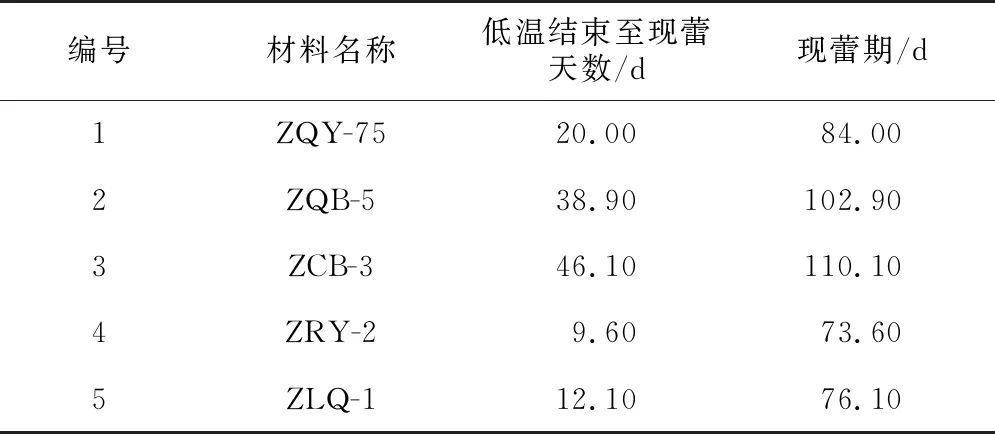
表4 人工低温条件下大白菜现蕾天数调查统计
2.3 大白菜BrFLC和BrFRI-LIKE基因的获得
通过本地BLASTP和蛋白保守结构域鉴定,最终在大白菜中获得4个拟南芥FLC同源基因,按照文献[20]的研究结果,分别命名为BrFLC1、BrFLC2、BrFLC3、BrFLC5(表5);获得2个拟南芥FRI同源基因,根据与拟南芥FRI的同源性命名为BrFRIa和BrFRIb(表5);获得拟南芥FRL1同源基因1个,命名为BrFRL1,获得FRL2同源基因1个,命名为BrFRL2(表5)。4个BrFLC基因编码蛋白长度在196~220 aa之间,BrFLC1和BrFLC2分别分布在10号和2号染色体上,BrFLC3和BrFLC5分布在3染色体上;BrFRIa编码蛋白长度为367 aa,位于10号染色体上,BrFRIb编码蛋白长度为597 aa,位于3号染色体上;BrFRL1、BrFRL2编码蛋白长度分别为452 aa和352 aa,分别位于10号和9号染色体上(表5)。
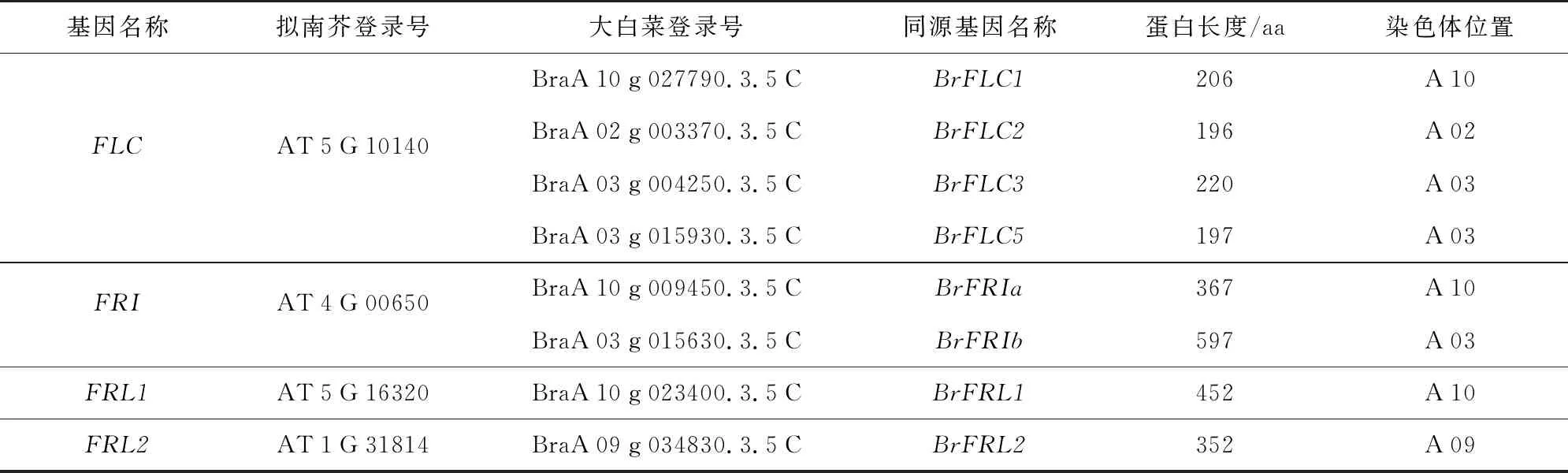
表5 大白菜BrFLC和BrFRI-LIKE基因的基本信息
2.4 大白菜BrFLC基因在低温处理下的表达分析
在4 ℃低温处理下,4个BrFLC基因在参试材料中的相对表达量均随着处理时间的延长呈降低趋势,且在低温处理48 h时降幅最大,随后在48~144 h之间,降幅逐渐变小。参试材料中,同一BrFLC基因在ZRY-2与ZLQ-1中的相对表达量之间差异不显著,但在任何处理时期均低于在其他3份材料中的表达量且差异显著(图1)。
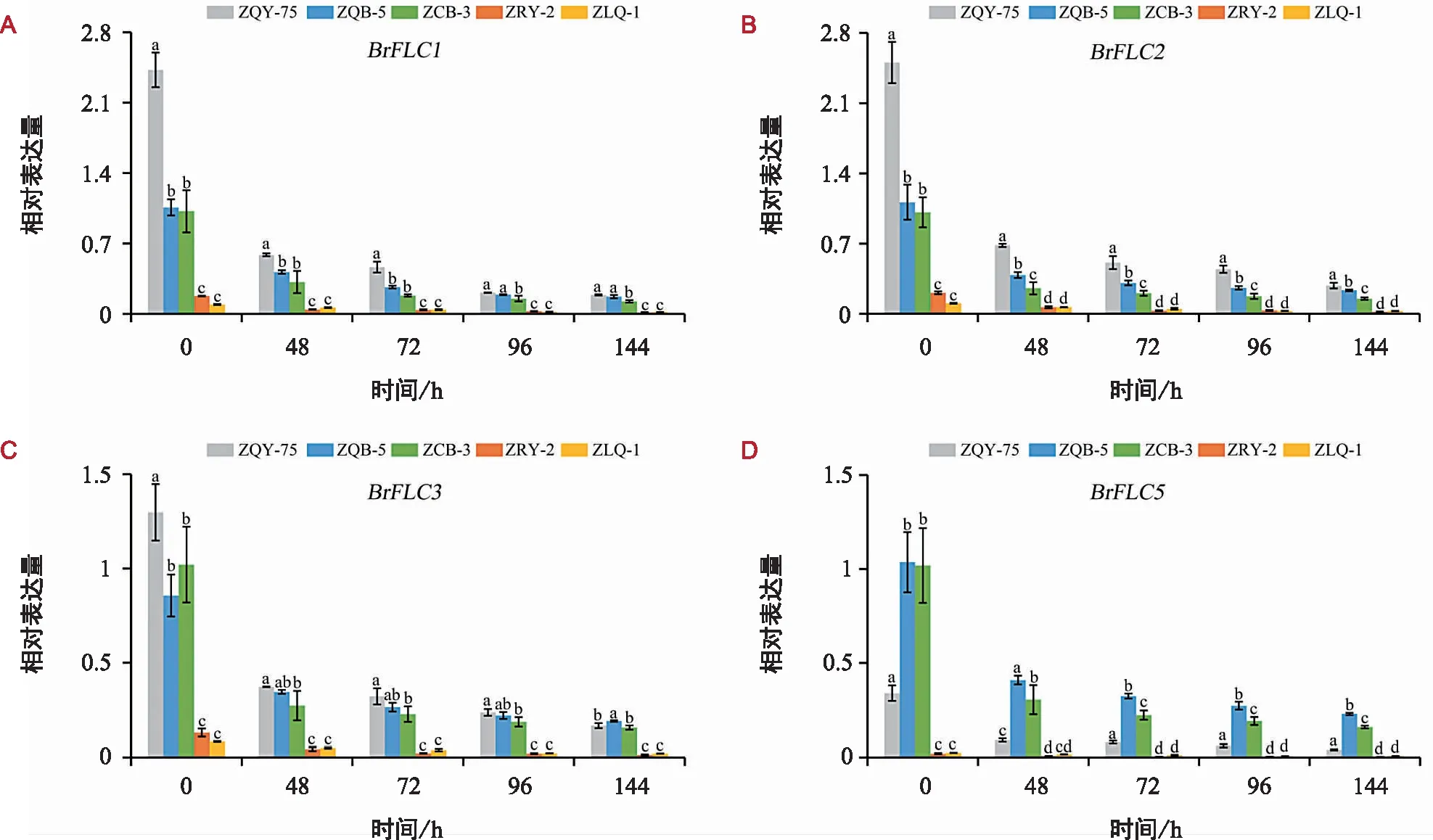
注:不同小写字母表示在同一处理时期不同材料的基因相对表达量差异显著(p<0.05)。下同。
BrFLC1、BrFLC2、BrFLC3基因在5份材料中呈现较一致的表达趋势,即在各个处理时期基因相对表达量总体趋势为ZQY-75>ZQB-5>ZCB-3>ZRY-2>ZLQ-1(图1 A、B、C);BrFLC5基因在5份材料中的相对表达量在各处理时期均表现为ZQB-5>ZCB-3>ZQY-75>ZLQ-1>ZRY-2(图1 D)。在ZQY-75中,BrFLC1、BrFLC2、BrFLC3基因在低温处理48 h时,相对表达量下降幅度均大于其他4个材料(图1 A、B、C);除BrFLC3之外,其余3个BrFLC基因在ZQB-5中的相对表达量在低温处理各时期均高于ZCB-3,但在低温处理开始时,4个BrFLC基因在这2份材料中的相对表达量之间差异不显著(图1)。
2.5 大白菜BrFRI-LIKE基因在低温处理下的表达分析
在4 ℃低温条件下,随着处理时间的增加,4个BrFRI-LIKE基因在5份参试材料中的相对表达量整体呈上升趋势(图2);在任何处理时期,ZRY-2和ZLQ-1同一BrFRI-LIKE基因的相对表达量之间均无显著差异,且表达量均显著低于其他3个材料。在低温处理144 h时,不同材料的BrFRIa、BrFRL1、BrFRL2基因的相对表达量均呈现ZQY-75>ZCB-3>ZQB-5>ZRY-2>ZLQ-1(图2 A、C、D)。在ZCB-3中,低温处理0 h,48 h,72 h,96 h时,BrFRIa、BrFRIb、BrFRL1基因的相对表达量分别低于ZQY-75、ZQB-5;在低温处理144 h时,ZCB-3中4个BrFRI-LIKE基因的相对表达量均高于ZQB-5,而BrFRIb基因的相对表达量高于ZQY-75(图2)。
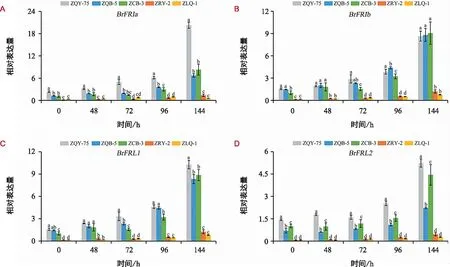
图2 大白菜BrFRI-LIKE基因在低温处理下的表达分析
3 结论与讨论
本研究对5份大白菜的耐抽薹性进行了比较鉴定,结果显示,ZCB-3属强耐抽薹材料,ZQB-5属耐抽薹材料,ZQY-75属一般耐抽薹材料,ZRY-2、ZLQ-1均为不耐抽薹材料。参试材料幼苗在经过4 ℃低温处理50 d后,播种至抽薹时间较自然低温春化缩短40 d以上,而自然低温春化期间,平均气温4 ℃以下有34 d,说明低温处理时间的延长能缩短大白菜现蕾时间,这与张鲁刚等[28]的研究结果一致。
本研究对参试大白菜幼苗进行4 ℃低温处理0~144 h,研究春化相关基因BrFLC(4个基因)及BrFRI-LIKE基因(4个基因)对低温的响应。结果显示,5份材料中,BrFLC基因均随着处理时间的延长,相对表达量呈下降趋势,且在处理48 h时,表达量降幅最大,之后降幅逐渐平缓,而BrFRI-LIKE基因则随着处理时间的延长,表达量呈上升趋势,表明BrFRI-LIKE基因与BrFLC基因未存在明显的共表达趋势,这与段文优[29]对甘蓝型油菜的研究结果相似。对于温度如何影响FRI对FLC基因的调控机理,最新研究揭示,在拟南芥中,春化早期低温诱导大分子凝聚体(FRIGIDA凝聚体)的形成,但并不与活跃的FLC位点共定位,从而阻抑FRI激活FLC,以实现FLC转录下调的分子机制[30]。
此外,本研究发现,在低温处理不同时间下,不耐抽薹的2个材料(ZRY-2和ZLQ-1)中BrFLC及BrFRI-LIKE基因在任何处理时期的相对表达量均处于较低水平,且显著低于其他3份材料,说明BrFLC或BrFRI-LIKE基因的表达水平与大白菜的耐抽薹性有一定的相关性。ZQY-75和ZCB-3幼苗在人工低温处理50 d后,现蕾期分别较自然低温春化提前43.1 d,46.65 d,提前天数大于其他3份材料,且在低温处理48 h时,这2份材料中4个BrFLC基因的相对表达量降幅最大,推测在短期低温下,BrFLC基因相对表达量的降幅可能与现蕾期天数缩短有一定相关性。在参试材料中,BrFLC5基因在低温下的表达水平高低与材料耐抽薹性强弱有一定的对应关系,说明BrFLC5与抽薹开花时间有较明显的相关性,这与张学铭等[31]的研究结果相似。BrFLC5可作为一个用于初步筛选强耐抽薹性育种材料的候选基因。
本试验中,低温处理144 h时,4个BrFRI-LIKE基因在参试材料中相对表达量最高,但由于没有更长的低温时间处理作比较,这4个基因是否在低温处理144 h时达到表达最高峰值,何时是表达量降低的拐点还需要进一步研究。同样,在低温处理144 h时,4个BrFLC-LIKE基因在参试材料中的相对表达量最低,但是否表达量的最低峰以及何时出现表达丰度回升的拐点还需进一步研究验证。

