室管膜下巨细胞星形细胞瘤致梗阻性脑积水1例
赵建杰,李朝阳
(1山西医科大学儿科医学系,太原 030001;2山西省儿童医院神经内科;*通讯作者,E-mail:chaoyangli_bill@126.com)
结节性硬化症(tuberous sclerosis complex, TSC)是一种由TSC1基因和TSC2基因突变引起的常染色体显性遗传性神经皮肤综合征[1],发病率1/6 000~1/10 000,常累及中枢神经系统和皮肤,还可累及眼睛、心脏、肾脏、骨骼和肺部[2]。室管膜下巨细胞星形细胞瘤(subependymal giant cell astrocytoma,SEGA)是结节性硬化症的一种神经病理学特征。SEGA主要在Monro孔附近,为良性肿瘤,生长缓慢,但可导致严重的神经系统损害,包括梗阻性脑积水[3]。TSC患者发病率低,为罕见病,在其基础上出现SEGA的情形更少见,几率占TSC患者5%左右[4]。SEGA可致梗阻性脑积水或肿瘤出血,导致颅内压进展性增高,进而引起颅中线偏移,出现脑疝甚至危及生命,急性恶化的SEGA患者应接受紧急手术治疗。本文报告1例结节性硬化症合并室管膜下巨细胞星形细胞瘤患儿,瘤体压迫侧脑室,致梗阻性脑积水,术后出现化脓性脑膜炎,具体报告如下,旨在提高对该疾病的临床表现及术后出现的情况的认识。
1 病例报告
患儿,女,10岁,患儿于6年前门诊诊断为结节性硬化症,未予特殊处理,2月前患儿无明显诱因出现呕吐,伴抽搐反复发作,约10次/月,持续时间1~2 min/次,可自行缓解,不伴发热。患儿系第2胎第2产,足月,顺产,生后无窒息史及抢救史,母乳喂养。父母非近亲结婚,父亲患有白癜风,母亲身体健康。体格检查:体温36.8 ℃,脉搏100次/min,呼吸20次/min,血压111/59 mmHg,体质量51.0 kg,身高146.5 cm。嗜睡,呼唤可睁眼,简单能对答,刺痛能定位,体型肥胖,头部、面部、鼻部、躯干部多出可见皮脂腺瘤,凸出于皮肤表面,直径最大3 cm,皮肤粗糙,智力认知水平低,双侧瞳孔直径约3.5 mm,对光反射迟钝,鼻唇沟对称,口角无歪斜,四肢肌张力正常,肌力Ⅴ级,步态不稳,刺痛肢体有定位反应。双侧腱反射正常引出,病理征未引出。感觉、共济运动查体无法配合。辅助检查:血常规、肝肾功能无明显异常。头颅MRI平扫显示右侧室间孔旁可见团块状T1WI高/等/稍低混杂信号,T2WI稍高/稍低/低混杂信号影,病灶后部可见囊状T1WI低并少许高、T2WI高并少许低信号影,囊内可见液平,病灶整体范围约4.9 cm(左右径)×4.8 cm(上下径)×3.5 cm(上下径);增强后病灶实性部分明显不均匀强化,囊性部分未见强化。双侧侧脑室明显扩张积水,侧脑室前角及体前部旁可见片状T1WI稍低、T2WI高信号影(见图1);增强后未见强化(见图2)。
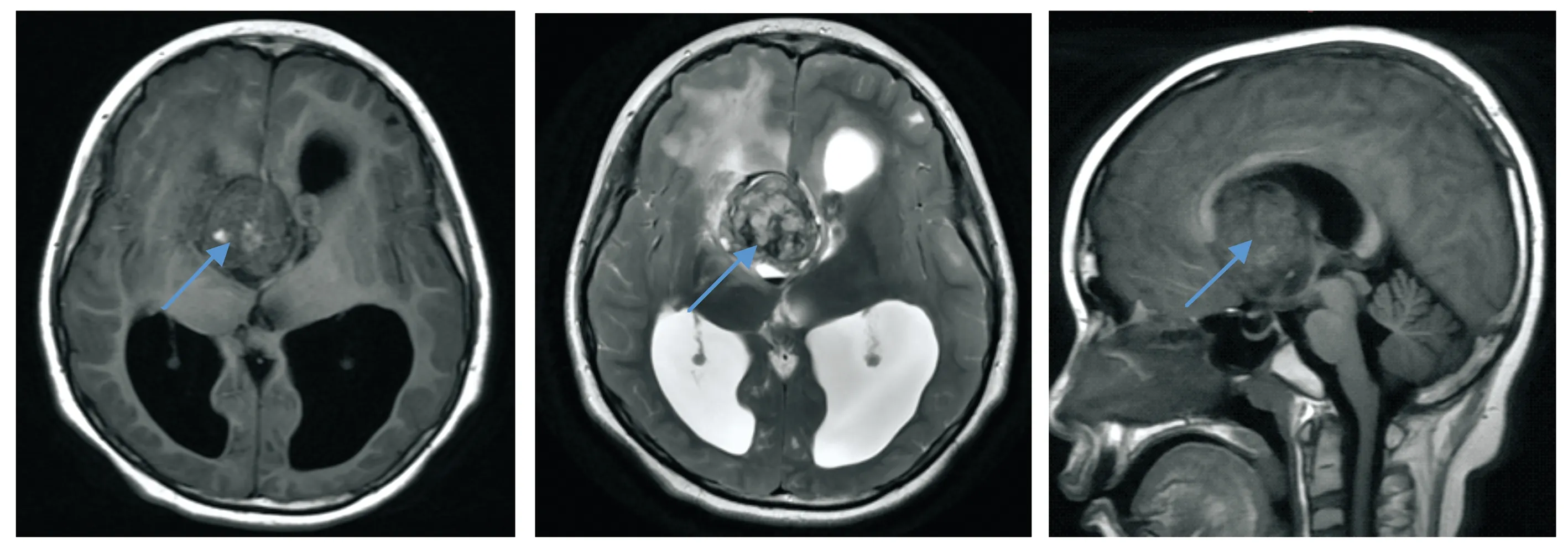
从左到右依次为术前头颅MRI轴位T1WI、轴位T2WI、矢状位T1WI平扫,于右侧室间孔旁可见团块状T1WI高/等/稍低混杂信号,T2WI稍高/稍低/低混杂信号影,病灶部位在蓝色箭头所指处
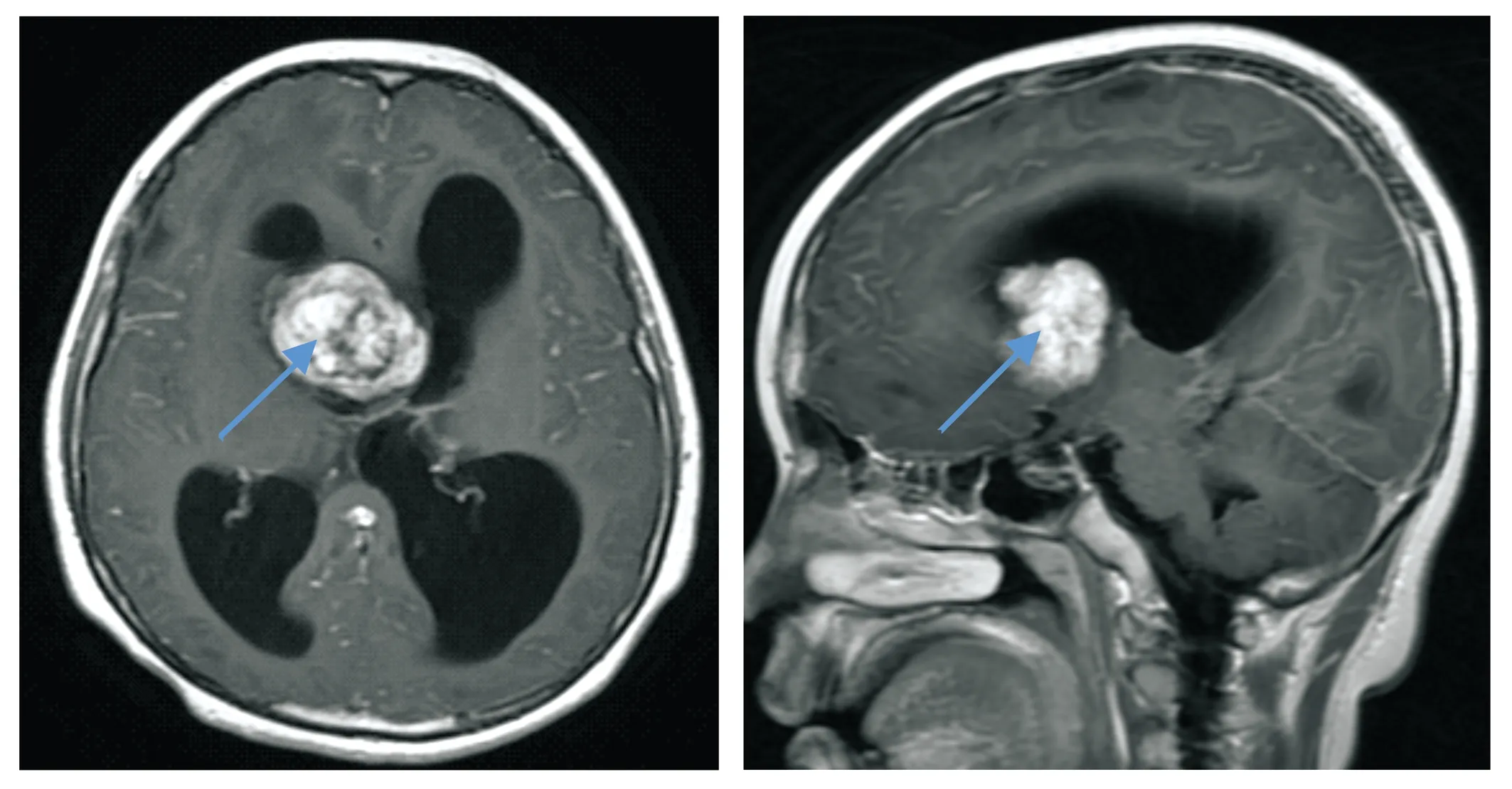
从左到右依次为术前头颅MRI轴位T1WI、矢状位T1WI增强扫描,增强后病灶实性部分明显不均匀强化,病灶部位在蓝色箭头所指处
随后对患儿进行外科手术,于右侧额中回处切除部分脑组织行额叶造瘘进入侧脑室,探查见肿瘤体积约4 cm×5 cm×6 cm,彻底切除肿瘤组织并送检。光镜下可见瘤细胞排列呈片状,瘤细胞多角形或圆形,小灶可见梭形细胞,胞浆均质嗜酸性,核大,核仁明显,核具有多形性,可见多核细胞;部分瘤细胞围绕血管呈假栅栏状排列,部分区域可见出血及钙化(见图3)。术后病理检查诊断为室管膜下巨细胞星形细胞瘤。
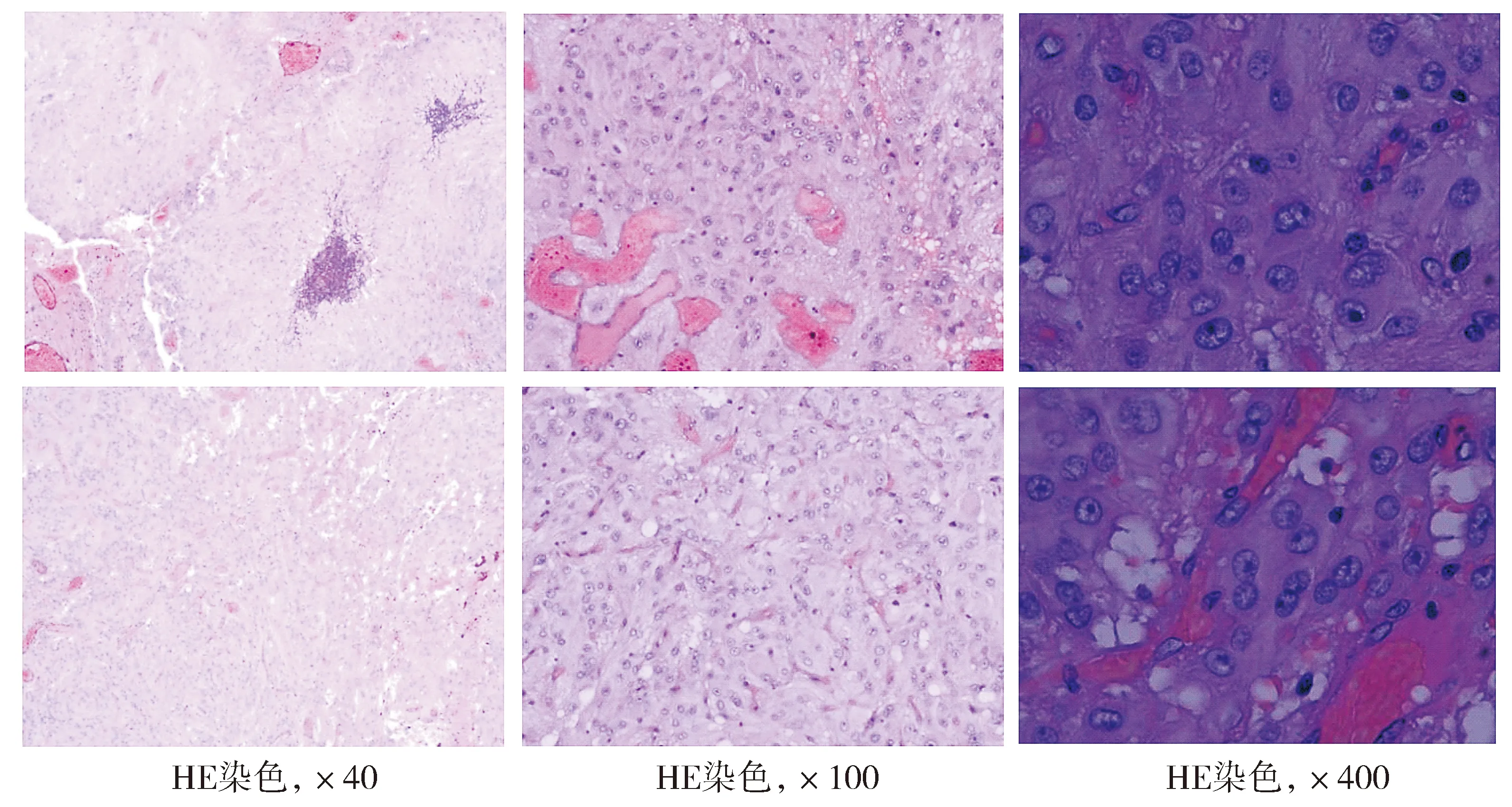
图3 肿瘤组织的HE染色
患儿术后未再呕吐,未见抽搐发作。术后头颅MRI示颅内占位术后改变;右侧额顶部头皮软组织肿胀伴皮下积液;右侧额顶叶脑穿通畸形;双侧额颞顶部硬膜下积液;左侧侧脑室前角内积气;双侧侧脑室枕角积血;左侧室间孔区异常信号较前未见显著变化;脑积水及间质性脑水肿较前明显好转(见图4)。经甘露醇降颅压、脑室引流等,术后恢复良好。术后第9日患儿出现发热,体温最高38.9 ℃,无呕吐、抽搐等症状,体格检查:精神反应差,颈稍硬,病理征未引出。辅助检查:①血常规:白细胞计数17.14×109/L,中性粒细胞绝对值15.05×109/L,中性粒细胞百分比87.7%,C反应蛋白82.63 mg/L,降钙素原0.087 ng/ml;②脑脊液常规:外观黄色/微浊,球蛋白阳性,白细胞计数679×106/L,中性粒细胞百分比77.8%,单核细胞百分比7.4%;③脑脊液生化:葡萄糖3.34 mmol/L,氯119.6 mmol/L,总蛋白0.74 g/L;④脑脊液培养未培养出致病菌。结合其临床表现及辅助检查,诊断化脓性脑膜炎,予积极抗感染治疗16 d后,患儿体温恢复正常,精神恢复正常。现仍需进一步随访。
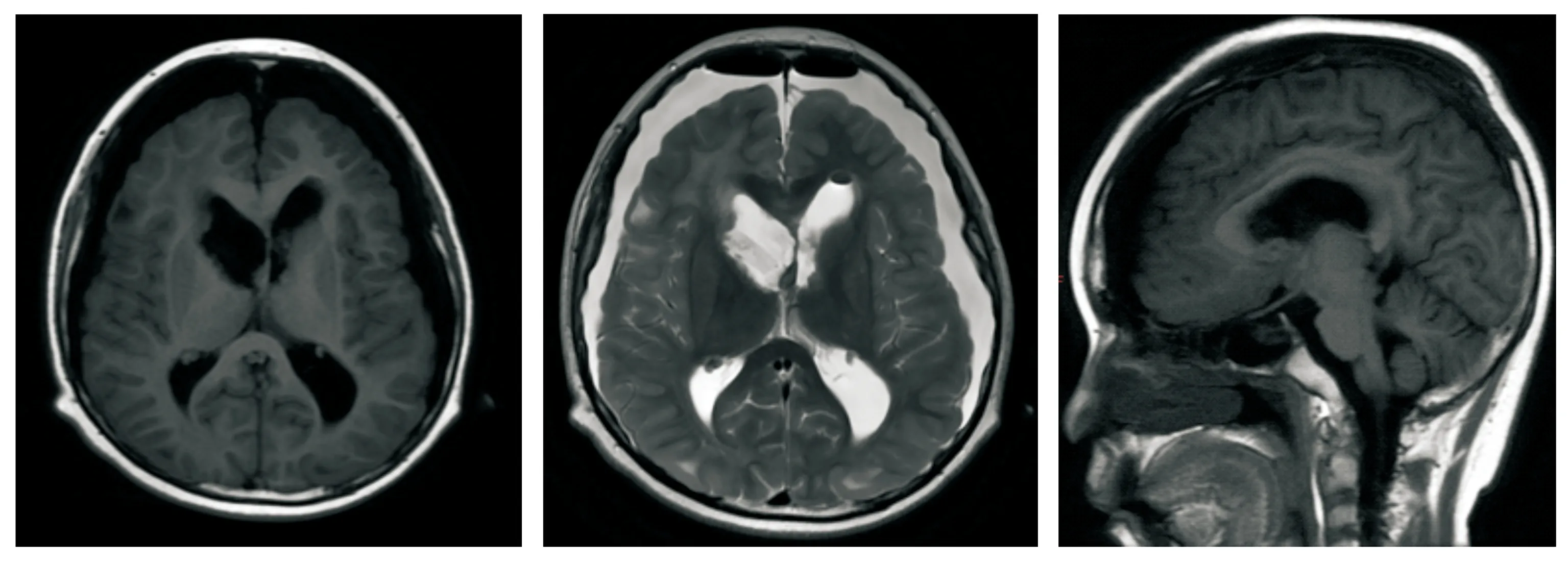
从左到右依次为术后轴位T1WI、轴位T2WI、矢状位T1WI平扫,示颅内占位术后改变;右侧额顶部头皮软组织肿胀伴皮下积液,右侧额顶叶脑穿通畸形,双侧额颞顶部硬膜下积液,左侧侧脑室前角内积气,双侧侧脑室枕角积血,左侧室间孔区异常信号较前未见显著变化,脑积水及间质性脑水肿较前明显好转
2 讨论
2012年国际结节性硬化症共识会议建议:将TSC1或TSC2的致病性突变鉴定作为独立的诊断标准[2]。TSC1或TSC2的致病性突变可导致其各自编码的蛋白质(错构瘤蛋白和马铃薯球蛋白)的功能受损[5]。错构瘤蛋白或马铃薯球蛋白可以形成一种分子复合物,作为哺乳动物雷帕霉素靶蛋白(mTOR)的调节剂,并负责抑制细胞生长和分化[6]。当错构瘤蛋白/马铃薯球蛋白复合体失去调节能力时,多发性错构瘤开始形成[5]。此外,错构瘤蛋白/马铃薯球蛋白对于调节大脑中神经元的轴突和突触发育和迁移至关重要,因此它们出现功能障碍时不仅会导致肿瘤,还会导致神经元结构和功能的弥漫性异常[5,7,8]。
TSC的神经病理学特征包括脑皮质结节、室管膜下结节(subependymal nodules,SEN)和室管膜下巨细胞星形细胞瘤[8]等。室管膜下结节是沿侧脑室和第三脑室室管膜壁生长的良性肿瘤,它们可在80%的TSC患者中观察到。普遍认为SEGA是由SEN产生的[3]。SEGA在结节性硬化症患儿中的发病率为5%~15%,可能在产前或出生时被发现,更容易在儿童或青少年时期出现,20岁以后很少被发现,SEN和SEGA都可能随着时间的推移而逐渐钙化[9]。
室管膜下巨细胞星形细胞瘤是一种罕见的中枢神经系统肿瘤,其诊断基于临床、放射学、组织学和免疫组织化学论证。在组织学上,室管膜下巨细胞星形细胞瘤的特征是在原纤维背景上的三重细胞成分分布;大的星形胶质细胞样细胞,伴有血管周围假栅栏,常有钙化。肿瘤细胞内的细胞种类繁多,从粒细胞星形胶质细胞到长纤维化细胞和梭形细胞,以及大型巨细胞,其中一些具有神经节外观,具有大的嗜酸性粒细胞和细颗粒状细胞质,细胞核是圆形或椭圆形的,大而偏心。免疫组织化学研究表明,室管膜下巨细胞星形细胞瘤存在神经胶质和神经元混合分化[10]。
2021更新的国际结节性硬化症的监测和管理建议,因梗阻性脑积水或肿瘤出血而出现急性恶化的SEGA患者应接受紧急手术治疗[11]。好的预后在于早发现、早诊断。因此,建议所有TSC患者应每1~3年进行一次MRI扫描监测,直到SEGA最普遍的25岁,在推荐的1~3年间隔内,对于那些SEGA较大或不断增长的无症状SEGA患者,或发育或认知障碍且不能可靠报告细微神经症状的患者,应更频繁地进行扫描。
本例患儿颅内肿物经手术切除送检后,病理检查诊断为室管膜下巨细胞星形细胞瘤,该患儿肿瘤体积增大,阻塞Monro孔,造成梗阻性脑积水,症状表现为呕吐,体格检查为嗜睡,双侧瞳孔直径约3.5 mm,对光反射迟钝,严重影响患儿生活质量。经手术治疗后,患儿症状明显得到改善,癫痫发作也得到控制。在以往的病例报道中患儿术后出现硬膜下积液比较常见,本例中患儿也有硬膜下积液存在。与其他报道不同,本例中患儿于术后出现化脓性脑膜炎,予积极抗感染后病情稳定。
综上所述,结节性硬化症合并室管膜下巨细胞星形细胞瘤可引起脑积水,导致颅内压进展性增高,进而引起颅中线偏移,出现脑疝甚至危及生命,因而定期复查,及早干预显得尤为重要。对于有严重颅高压的患者,在其术后也应密切关注其病情变化,在出现术后并发症时及早干预。

