骨质疏松患者Th17/Treg细胞平衡状况及其与骨代谢指标的相关性
付海宁,丁晓明,李新宇,高博,陆雪颖,梁冠文
1.宝鸡市妇幼保健院检验科,陕西 宝鸡 721000;
2.宝鸡市妇幼保健院内科,陕西 宝鸡 721000;
3.宝鸡市人民医院骨二科,陕西 宝鸡 721000
骨质疏松累及全身骨骼,其基本病理特征表现为骨量丢失、骨微结构变化、骨小梁坍塌,不仅会增加骨骼脆性,还会加大骨折发生风险[1]。相关文献显示,辅助性T 细胞17(T helper cell 17,Th17)会产生阻碍骨吸收细胞生长及激活的相关因子,从而在骨质疏松过程中发挥作用[2]。调节性T细胞(regulatory cell,Treg)能发挥免疫抑制作用,对骨质破坏进行抑制[3]。正常骨代谢指的是骨形成(成骨细胞介导)同骨吸收(破骨细胞介导)间的平衡过程,且在生理下破骨细胞与成骨细胞一起对正常骨转化进行控制,进而保持骨稳态,骨代谢的不平衡就会引发骨疾病,于骨质疏松发展期间,骨代谢也发挥重要作用[4-5]。相关文献显示,在分化发育期间,Th17、Treg被诸多细胞因子调控,对机体免疫应答进行参与,经分化、激活成骨与破骨细胞对骨代谢进行干扰[6]。目前,Th17、Treg 细胞平衡于骨质疏松中的具体机制还不明确。基于此,本研究旨在探讨Th17、Treg 细胞平衡在骨质疏松患者中的表达意义及其与骨代谢指标的关系,现报道如下:
1 资料与方法
1.1 一般资料 回顾性分析2019年3月至2022年2 月在宝鸡市妇幼保健院诊治的120 例骨质疏松患者(骨质疏松组)的临床资料。纳入标准:(1)同骨质疏松相关诊断标准[7]相符;(2)骨密度T 值不足2.5 SD;(3)年龄超过18岁;(4)临床资料完整。排除标准:(1)伴有肾、肝功能不全;(2)伴有类风湿、原发性甲亢、糖尿病等干扰骨代谢的疾病;(3)6 个月内使用过干扰骨代谢的药物。另选择同期在本院进行体检的健康者100例作为对照组。骨质疏松组中男性51 例,女性69 例;年龄52~76 岁,平均(63.83±6.15)岁。对照组中男性42例,女性58 例;年龄54~78 岁,平均(64.14±6.33)岁。两组受检者性别和年龄比较差异均无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会批准。
1.2 观察指标与检测方法 (1)Th17、Treg:Th17检测:收集所有受检者空腹状态下4 mL 全血,选择乙二胺四乙酸进行抗凝,并在60 min 内提取外周血单个核细胞(peripheral blood mononuclear cells,PBMCs),置入佛波醇乙酯、离子霉素、莫能霉素进行刺激,在二氧化碳(carbon dioxide,CO2)细胞培养箱培养4 h,之后置入藻红蛋白-抗人CD8 mAb 及经异硫氰酸荧光素染色后的抗人CD3 mAb,固定液置入后破膜,再置入PERCP-CY5.5 抗人白介素-17A (interleukin-17A,IL-17A)及200 μL 固定液,上机检测。Treg 检测:收集所有受检者空腹状态下3 mL全血,选择乙二胺四乙酸进行抗凝,并在60 min内提取PBMCs,避光后,置入藻红蛋白-抗人CD8 mAb及经异硫氰酸荧光素染色后的抗人CD3 mAb,在CO2细胞培养箱培养1 h,将同定液置入,等待1 h,置入穿膜液,再等待1 h,置入PERCPCY5.5 抗人牛叉头型基因P3 (Forkhead Box P3,FOXP3) FOXP3 后孵育2 h,将200 μL 固定液置入,上机检测。(2)骨代谢炎性细胞因子指标:收集所有受检者空腹状态下5 mL肘静脉血,以3 000 r/min的速度离心10 min,使用酶联免疫吸附法检测骨代谢炎性细胞因子指标[包括肿瘤坏死因子-α(tumor necrosis factorα,TNF-α)、白介素-6(interleukin-6,IL-6)、白介素-10(interleukin-10,IL-10)、转 化 生 长 因 子-β (transforming growth factor-β,TGF-β)]。(3)骨代谢蛋白酶活性指标:使用酶联免疫吸附法检测所有受检者的骨代谢蛋白酶活性指标[包括基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)、Ⅰ型胶原吡啶交联终肽(collagenⅠcross-linked carboxy terminal telopeptide,ICTP)、Ⅰ型前胶原氨基端原肽(procollagen I of aminoterminal propeptide,PINP)]。
1.3 统计学方法 应用SPSS20.0 统计软件进行数据统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验,计数资料比较采用χ2检验,采用Spearman 相关性分析Th17、Treg 与骨代谢指标的关系。以P<0.05为差异有统计学意义。
2 结果
2.1 两组受检者的Th17、Treg水平比较 骨质疏松组患者的Th17水平明显高于对照组,Treg水平明显低于对照组,差异均有统计学意义(P<0.05),见表1。
表1 两组受检者的Th17、Treg水平比较(±s,%)Table 1 Comparison of Th17 and Treg levels between the two groups(±s,%)
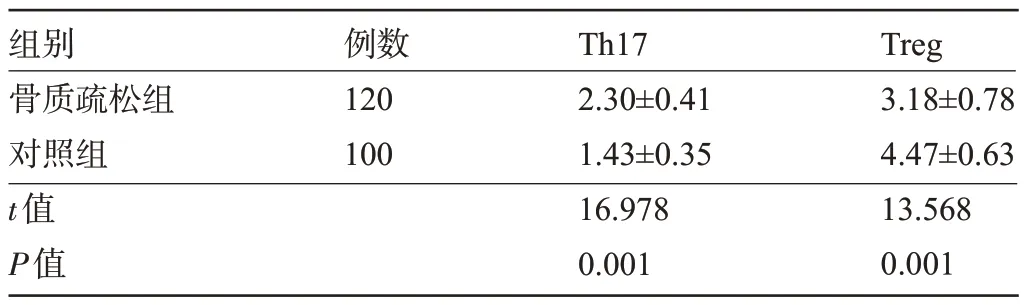
表1 两组受检者的Th17、Treg水平比较(±s,%)Table 1 Comparison of Th17 and Treg levels between the two groups(±s,%)
组别骨质疏松组对照组t值P值例数120 100 Th17 2.30±0.41 1.43±0.35 16.978 0.001 Treg 3.18±0.78 4.47±0.63 13.568 0.001
2.2 两组受检者的骨代谢炎性细胞因子水平比较 骨质疏松组患者的TNF-α、IL-6 水平明显高于对照组,IL-10、TGF-β水平明显低于对照组,差异均有统计学意义(P<0.05),见表2。
表2 两组受检者的骨代谢炎性细胞因子水平比较(±s)Table 2 Comparison of the levels of inflammatory cytokines in bone metabolism between the two groups(±s)
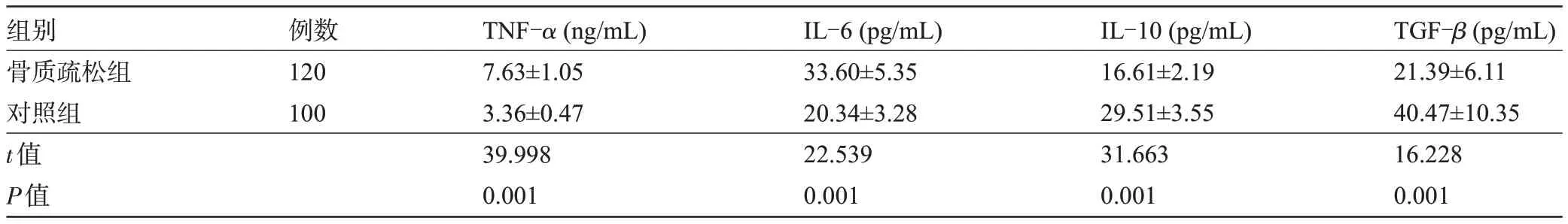
表2 两组受检者的骨代谢炎性细胞因子水平比较(±s)Table 2 Comparison of the levels of inflammatory cytokines in bone metabolism between the two groups(±s)
组别骨质疏松组对照组t值P值例数120 100 TNF-α(ng/mL)7.63±1.05 3.36±0.47 39.998 0.001ⅠL-6(pg/mL)33.60±5.35 20.34±3.28 22.539 0.001ⅠL-10(pg/mL)16.61±2.19 29.51±3.55 31.663 0.001 TGF-β(pg/mL)21.39±6.11 40.47±10.35 16.228 0.001
2.3 两组受检者的骨代谢蛋白酶活性指标比较 骨质疏松组患者的MMP-2、ICTP水平明显高于对照组,PINP 水平明显低于对照组,差异均有统计学意义(P<0.05),见表3。
表3 两组受检者的骨代谢蛋白酶活性指标比较(±s,ng/mL)Table 3 Comparison onthelevels ofbonemetabolicprotease activity indexesbetweenthetwo groups(±s,ng/mL)
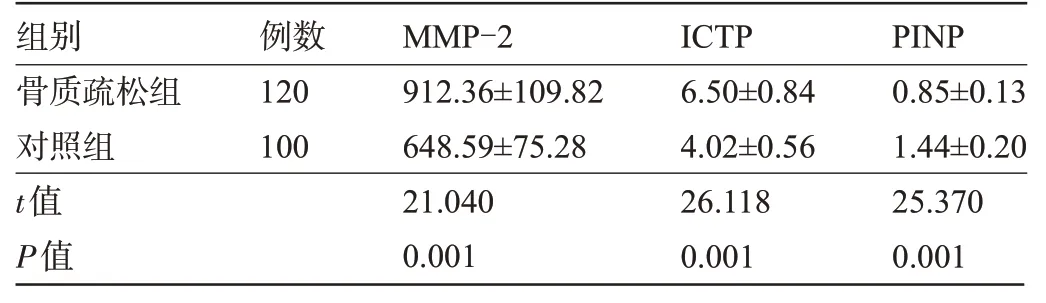
表3 两组受检者的骨代谢蛋白酶活性指标比较(±s,ng/mL)Table 3 Comparison onthelevels ofbonemetabolicprotease activity indexesbetweenthetwo groups(±s,ng/mL)
组别骨质疏松组对照组t值P值120 100 912.36±109.82 648.59±75.28 21.040 0.001 6.50±0.84 4.02±0.56 26.118 0.001 0.85±0.13 1.44±0.20 25.370 0.001例数MMP-2ⅠCTP PⅠNP
2.4 Th17、Treg与骨代谢指标的相关性 经Spearman分析结果显示,Th17 与TNF-α、MMP-2、ICTP 呈正相关(P<0.05),Treg 与TNF-α、MMP-2、ICTP 呈负相关(P<0.05),与TGF-β呈正相关(P<0.05),见表4。会促进人核因子KB受体活化因子配体(human nuclear factor KB receptor activator Ligand,RANKL)分泌及破骨细胞活化,从而使破骨细胞中的蛋白酶水平增加,介导骨降解过程[11]。相关文献显示,骨质疏松患者的Th17呈现出过度活化的状态,然而其对蛋白酶活性及炎性反应的干扰机制还不明确[12]。有文献显示,Treg细胞经负反馈对破骨细胞的分化、形成进行抑制,在骨代谢平衡中发挥关键作用[13]。Treg细胞通过其重要转录因子Foxp3 经分泌IL-10、TGF-β 等细胞因子发挥调节免疫机制的作用,进而参与破骨抑制,降低骨吸收量[14]。本研究显示,骨质疏松患者的Th17水平明显高于健康体检者,Treg水平明显低于健康体检者,差异均有统计学意义(P<0.05),提示骨质疏松患者可能出现Th17/Treg 平衡失衡。骨质疏松患者Th17 水平提升、Treg水平降低,可能是因为Th17能够加快炎性细胞大量分泌RANKL,而RANKL又能够在破骨细胞前发挥作用,进而对破骨分化进行诱导。
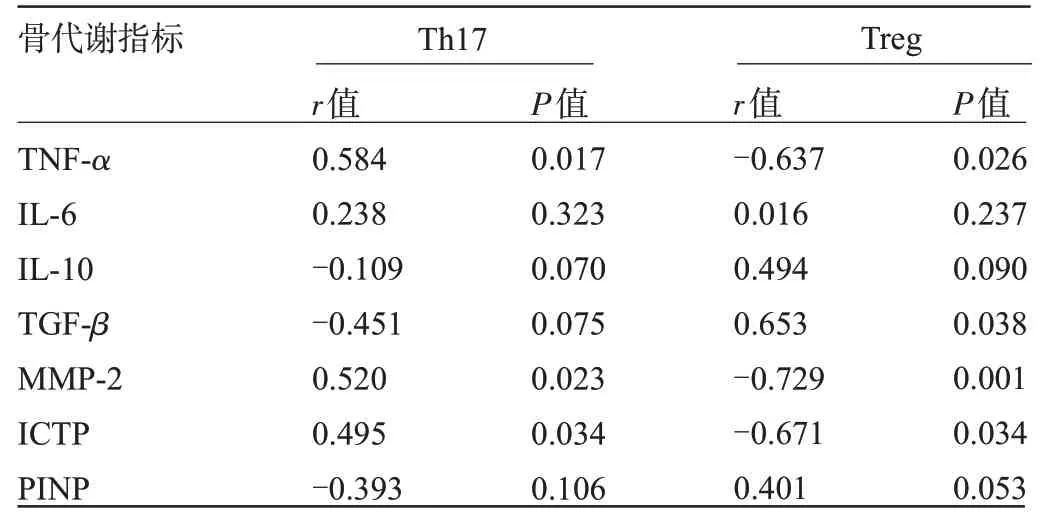
表4 Th17、Treg与骨代谢指标的相关性Table 4 Correlation analysis of Th17, Treg and bone metabolism indexes
本研究还显示,参与骨代谢的相关炎性细胞因子,像TNF-α、IL-6水平明显升高,IL-10、TGF-β水平明显降低,TNF-α、IL-6能够诱导初始T细胞分化为Th17细胞,进而分泌大量IL-17,最终形成链式效应,进一步加重骨质疏松,IL-10、TGF-β降低主要是由于Treg水平的降低导致其分泌的IL-10、TGF-β对应减少。且本研究经Spearman分析显示,Th17同TNF-α呈正相关,Treg同TNF-α呈负相关,同TGF-β呈正相关。
MMP-2 属于基质金属蛋白酶中Ⅰ型胶原介导水解的一种重要催化酶,在骨骼Ⅰ型胶原的降解及合成过程中会出现诸多不良产物,PINP为Ⅰ型胶原前体发生裂解、产生成熟Ⅰ型胶原期间的产物,可反映胶原合成活力,ICTP属于型胶原水解期间脱落羧基末端的产物之一,可反映胶原降解活力[15-16]。本研究显示,骨质疏松患者的MMP-2、ICTP 水平明显高于健康体检者,PINP 水平明显低于健康体检者,差异均有统计学
3 讨论
骨质疏松属于骨病综合征之一,它以骨微结构破坏、骨量降低为病理学典型表现,临床中呈现为骨强度衰退、骨脆性提升等,会增加人体低能量性骨折的发生率[8]。在宏观层面上,临床特征表现为个子变矮、驼背、浑身疼痛等腰椎变形,严重者还会引发骨折、残疾,甚至是死亡[9]。骨质疏松发病期间,会过度激活炎性反应及增加蛋白酶活性,这会直接影响骨代谢期间的骨吸收与形成,目前,调控蛋白酶活性及炎性反应的机制还尚未明确[10]。
Th17属于人体中比较重要的一种CD4+T 细胞亚群,于维甲酸相关孤核受体γt(retinoid-relatedorphanreceptorgammat,RORγt)转录因子的介导作用下分化、成熟,同时会分泌大量IL-17。IL-17促炎活性极强,可以使炎性反应激活,同时干扰骨代谢,除此之外,IL-17还意义(P<0.05)。提示于骨质疏松发病期间,蛋白酶活性明显增加,胶原合成产物减少、裂解产物增多。基于此,经Spearman 分析显示,Th17 同MMP-2、ICTP 为正相关关系,Treg同MMP-2、ICTP为负相关关系,提示骨质疏松发病期间,Th17的活化过度可使蛋白酶活性增强,进而加快骨基质中的胶原降解,Treg的降低会提升胶原降解活力。
综上所述,骨质疏松患者的Th17 水平提升,Treg表达水平降低,它们共同干扰骨代谢期间的炎性反应与蛋白酶活性。

