心肌梗死介入治疗后sTRAIL-R2表达与颈动脉斑块细胞凋亡及炎症反应的相关性
陈 芬,李艳萍
陕西省商洛市中心医院心血管内科,陕西商洛 726000
心血管疾病是世界范围内导致死亡的主要原因,通常由动脉粥样硬化所致,是发生心肌梗死等心脏事件的基础[1-2]。颈动脉易损斑块的破裂和血栓形成是引起心肌梗死、脑梗死等重大心脑血管疾病的主要原因之一[3]。影响斑块易损性的因素主要包括免疫炎症反应、细胞外基质降解、脂质代谢异常、氧化应激、细胞凋亡及血管新生等。细胞凋亡可以通过内在的线粒体途径和外在的死亡受体相关途径两种不同的途径启动。死亡受体配体——肿瘤坏死因子相关凋亡诱导配体(TRAIL)可通过可溶形式的可溶性TRAIL(sTRAIL)释放,与sTRAIL受体2(sTRAIL-R2)融合,诱导细胞凋亡,并且已有研究表明,sTRAIL-R2是主要的细胞凋亡诱导受体之一[4-5]。有研究表明,TRAIL-R2的激活在体外可诱导巨噬细胞、人主动脉血管平滑肌细胞和内皮细胞凋亡,从而可能有助于易损斑块表型形成,且sTRAIL-R2水平可预测普通人群的心血管事件发生风险[6]。但关于此类研究,国内相关文献报道较少见。因此,本研究采用颈动脉内膜切除术标本探究斑块微血管中sTRAIL-R2的表达水平,并分析其与患者机体炎症反应和斑块细胞相关性,旨在为此类患者预后评估提供参考依据。
1 资料与方法
1.1样本来源 选择2021年1月至2022年5月本院收治的介入治疗后行颈动脉内膜切除术心肌梗死患者102例作为研究对象,其中男53例、女49例,年龄41~72岁,平均(53.27±5.35)岁。所有患者均了解本研究并签订知情同意书。本研究经本院医学伦理委员会审批通过。
1.2仪器与试剂
1.2.1主要试剂 苏木精-伊红染色试剂盒购自上海酶联生物科技有限公司,DAPI染色试剂盒购自南京凯根生物科技有限公司,免疫组织化学试剂盒购自默克生物公司,酶联免疫吸附试验试剂盒购自上海酶联生物科技有限公司,半胱天冬氨酸蛋白酶(Caspase)-3 比色测定试剂盒购自上海博尔森生物科技有限公司,山羊抗小鼠β-actin、Bax、B淋巴细胞瘤-2基因(Bcl-2)、Caspase-3一抗均购自北京百奥莱博科技有限公司。
1.2.2主要仪器 包括细胞计数器(上海上碧实验仪器有限公司)、Couvter型高速冷冻离心机(美国Beckman公司)、DM 750型光学显微镜(日本Olympus公司)、Spectra Max M5型多功能酶标仪(美国Molecular Devices公司)、XDS-3型倒置显微镜(青岛爱普科生物工程有限公司)、流式细胞仪(德国Partec公司)、滑动式切片机(北京盛科信德科技有限公司)等。
1.3方法
1.3.1标本获取及sTRAIL-R2检测 行颈动脉内膜切除术后颈动脉斑块立即在实验室进行处理。将获取样本切分为长5 mm的片段,对斑块负荷最大的片段进行标准化组织学检查。使用酶联免疫吸附试验检测每个片段sTRAIL-R2表达水平,分为sTRAIL-R2高表达(>15 pg/mL)组和sTRAIL-R2低表达(≤15 pg/mL)组。
1.3.2免疫组织化学 获取的斑块组织用10%福尔马林固定,二甲苯脱蜡2次,梯度乙醇脱水,蒸馏水和磷酸盐缓冲液(PBS)冲洗。然后将组织与1滴过氧化氢孵育10 min,并用PBS洗涤9 min。加入0.01 mol/L 柠檬酸盐 (pH 6.0) 后进行微波抗原修复20 min。用PBS洗涤9 min后切片与正常山羊血清孵育5 min。去除血清后 4 ℃ 用兔抗CD45、CD68单克隆抗体孵育过夜,然后用PBS洗涤,接着加入山羊抗兔免疫球蛋白G(IgG)二抗,37 ℃孵育30 min,PBS洗涤3次,每次3 min。然后将组织用新制备的二氨基联苯胺显色1~2 min,浸入PBS 3次,每次2 min。随后将切片用苏木精复染1 min。显微镜下观察,计算阳性细胞数及阳性细胞所占比例。
1.3.3酶联免疫吸附试验 将获取的斑块组织用1 mL组织裂解缓冲液裂解,冰浴且在玻璃研磨机中研磨成匀浆,4 ℃裂解 30 min,然后4 ℃、300×g 离心20 min取上清液,使用酶联免疫吸附试验检测白细胞介素(IL)-6、IL-10、肿瘤坏死因子(TNF)-α、IL-1β、C反应蛋白(CRP)表达水平。
1.3.4Caspase-3、Caspase-8活性检测 将获取的斑块组织用1 mL组织裂解缓冲液裂解,冰浴且在玻璃研磨机中研磨成匀浆,4 ℃裂解30 min。将细胞裂解液300×g离心15 min,上清液保存在冰上进行即时测定。然后将5 mL裂解物加入96孔板中,将Caspase-3、Caspase-8显色底物5 μL加入每个孔中,并在37 ℃下孵育1 h。通过Caspase比色测定试剂盒进行检测,在微量滴定板读数器上405 nm 处记录吸光度值。通过比较处理过的细胞与对照组的结果确定Caspase-3、Caspase-8活性增加的百分比。
1.3.5蛋白质印迹检测 从斑块组织中提取总蛋白质样品。斑块组织用预冷的组织裂解液匀浆,4 ℃、12 000 r/min 离心15 min取上清液。使用BCA蛋白质测定试剂盒测定蛋白质水平。将等水平的蛋白质裂解物加载到10%十二烷基硫酸钠/聚丙烯酰胺凝胶电泳上,电泳80 V、30 min和 120 V、60 min,然后电转移到聚偏二氟乙烯膜。用5%脱脂奶粉室温封闭膜1 h。将膜与Bax、Caspase-3、Bcl-2、β-actin 抗体4 ℃过夜,然后清洗膜并与适当的辣根过氧化物酶偶联的二抗在室温下孵育1 h。最后使用增强型化学发光检测系统(Clinx Science Instruments,U.S.A.)观察蛋白质条带。测量 β-actin表达水平作为内源参考并用于标准化。根据2-ΔΔCt方法计算相对表达水平。
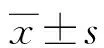
2 结 果
2.1两组患者斑块组织sTRAIL-R2表达水平比较 共获取297个颈动脉内膜片段。sTRAIL-R2高表达组150个片段,sTRAIL-R2低表达组147个片段。sTRAIL-R2高表达组患者斑块组织sTRAIL-R2水平[(19.01±3.24)pg/mL]高于sTRAIL-R2低表达组[(10.81±4.12)pg/mL],差异有统计学意义(P<0.05)。
2.2两组患者斑块组织Caspase-8、Caspase-3活性比较 sTRAIL-R2高表达组患者斑块组织Caspase-8、Caspase-3活性均高于sTRAIL-R2低表达组,差异均有统计学意义(P<0.05)。见表1。
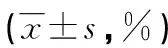
表1 两组患者斑块组织Caspase-8、Caspase-3活性比较
2.3两组患者斑块组织Bax、Caspase-3、Bcl-2蛋白表达水平比较 sTRAIL-R2高表达组患者斑块组织Bax、Caspase-3蛋白表达水平均高于sTRAIL-R2低表达组,Bcl-2蛋白表达水平低于sTRAIL-R2低表达组,差异均有统计学意义(P<0.05)。见表2、图1。

图1 两组患者斑块组织蛋白质免疫印迹检测结果

表2 两组患者斑块组织Bax、Caspase-3、Bcl-2蛋白表达水平比较
2.4两组患者斑块组织CD45、CD68阳性细胞检出数比较 sTRAIL-R2高表达组患者斑块组织CD45、CD68阳性细胞检出数均高于sTRAIL-R2低表达组,差异均有统计学意义(P<0.05)。见表3。
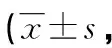
表3 两组患者斑块组织CD45、CD68阳性细胞检出数比较个/mm2)
2.5两组患者斑块组织IL-6、IL-10、CRP、TNF-α、IL-1β水平比较 sTRAIL-R2高表达组患者斑块组织IL-6、IL-10、CRP、TNF-α、IL-1β水平均高于sTRAIL-R2低表达组,差异均有统计学意义(P<0.05)。见表4。

表4 两组患者斑块组织IL-6、IL-10、CRP、TNF-α、IL-1β水平比较
2.6sTRAIL-R2表达水平与细胞凋亡及炎症反应指标水平的相关性 sTRAIL-R2表达水平与Caspase-8、Caspase-3活性,CD45、CD68、IL-6、IL-10、CRP、TNF-α、IL-1β水平及Bax、Caspase-3蛋白表达水平均呈正相关(r=0.486、0.401、0.511、0.476、0.510、0.485、0.445、0.518、0.394、0.548、0.559,P<0.05),与Bcl-2蛋白表达水平呈负相关(r=-0.681,P<0.05)。见表5。
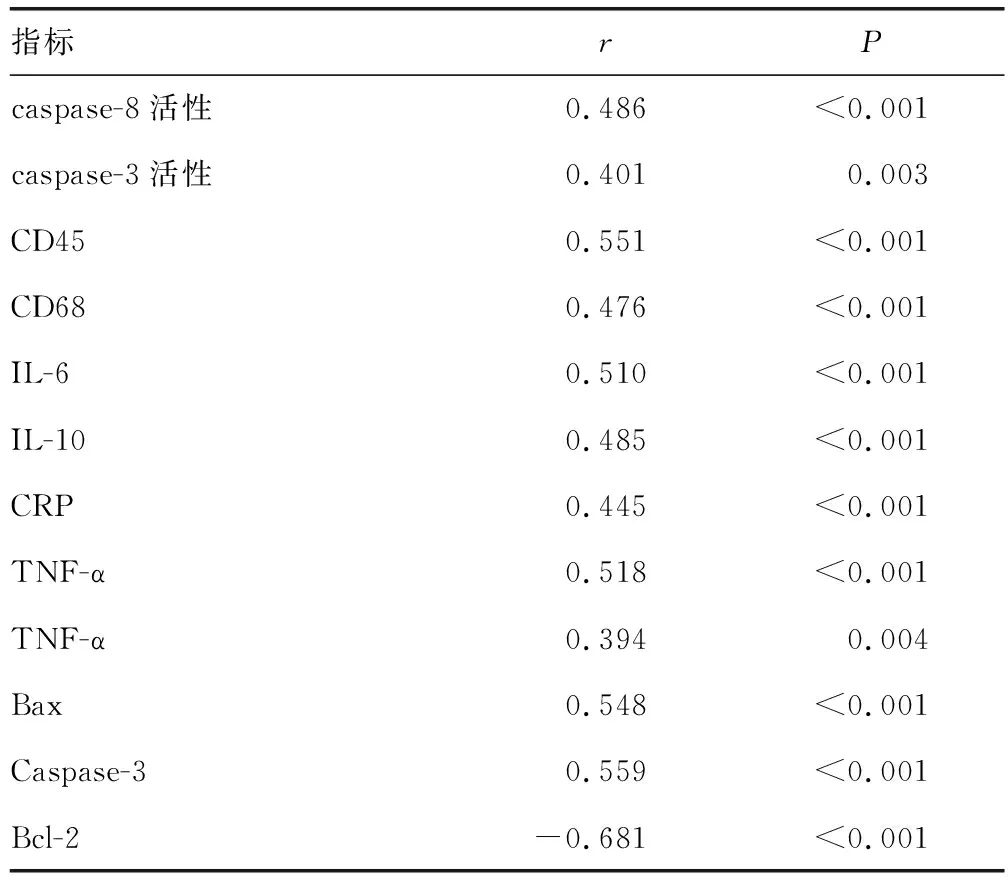
表5 sTRAIL-R2表达水平与细胞凋亡及炎症反应指标水平的相关性
3 讨 论
TRAIL-R2和TRAIL影响动脉粥样硬化斑块的发展,但关于其可溶性形式及与人类动脉粥样硬化斑块生物学的实际关联知之甚少。已有体外实验表明,TRAIL-R2的激活可诱导细胞凋亡[7],其中Caspase 激活是细胞凋亡诱导相关的关键途径之一。Caspase-3(一种效应子或执行型 Caspase)识别并分离各种靶蛋白中的短氨基酸序列,导致细胞死亡,其作为代表性的执行者在细胞凋亡中起着举足轻重的作用[8]。Caspase-8可通过分离Bid蛋白从而进一步与 Bax结合,导致细胞色素C释放,引起细胞凋亡[9]。此外,Caspase-8还以Caspase前体酶原的形式存在大多数动物的细胞中,其可在凋亡信号的作用下首先激活启动型Caspase引发级联反应,通过活化的执行型Caspase裂解特异性底物导致细胞凋亡[10-11]。Bcl-2 家族由抗凋亡蛋白 Bcl-2 和促凋亡蛋白Bax组成。Bcl-2是具有代表性的凋亡抑制因子,而Bax可以与Bcl-2结合形成异源二聚体,拮抗Bcl-2对细胞凋亡的抑制作用,促进细胞凋亡[12];另一方面Bax还激活Caspase-3,促进钙离子释放,进而导致细胞凋亡[13]。因此,Bax、Bcl-2和Caspase-3被认为是评价细胞凋亡的指标。本研究结果显示,sTRAIL-R2高表达组患者斑块组织Caspase-8、Caspase-3活性均高于sTRAIL-R2低表达组,差异均有统计学意义(P<0.05),证实sTRAIL-R2水平变化可能引起斑块细胞凋亡(活性Caspase-3)和外在死亡受体相关的细胞凋亡途径(活性Caspase-8)表达水平变化,而相关性分析进一步证实,其水平与Caspase-8、Caspase-3活性呈正相关(P<0.05),证实sTRAIL-R2表达可通过影响患者斑块细胞内在及外在凋亡途径影响其细胞凋亡。此外,本研究sTRAIL-R2高表达组患者斑块组织Bax、Caspase-3蛋白表达水平均高于sTRAIL-R2低表达组,Bcl-2蛋白表达水平低于sTRAIL-R2低表达组,差异均有统计学意义(P<0.05)。相关性分析也显示,sTRAIL-R2表达水平与Bax、Caspase-3蛋白表达水平呈正相关(P<0.05),与Bcl-2蛋白表达水平呈负相关(P<0.05)。证实sTRAIL-R2高表达还会进一步调控患者动脉斑块细胞凋亡相关蛋白表达,从而介导患者斑块细胞凋亡增加,影响患者病情进展。
炎症反应是斑块发展和易损性的另一个关键因素[14]。有研究表明,sTRAIL-R2可通过影响免疫细胞微血管屏障外渗,对炎症细胞浸润发挥作用。因此,sTRAIL-R2高表达可能导致免疫细胞浸润增加[15]。而本研究发现,sTRAIL-R2高表达组患者斑块组织CD45、CD68阳性细胞检出数高于sTRAIL-R2低表达组,差异均有统计学意义(P<0.05),且与CD45、CD68水平均呈正相关(P<0.05),进一步证实sTRAIL-R2高表达会引起白细胞、巨噬细胞等炎症细胞浸润,加重患者病灶部位炎症反应,进而引起病情进展。同时本研究还对患者病灶部位炎性细胞因子表达进行了检测,结果显示,sTRAIL-R2高表达组患者斑块组织IL-6、IL-10、CRP水平均高于sTRAIL-R2低表达组,差异均有统计学意义(P<0.05),且与IL-6、IL-10、CRP、TNF-α、IL-1β水平均呈正相关(P<0.05),进一步证实了sTRAIL-R2高表达加重患者病灶炎症反应的猜想。进一步分析sTRAIL-R2高表达可能引起免疫细胞浸润增加,导致患者斑块易损,诱发严重心脑血管疾病。由于免疫细胞浸润和血管内侧平滑肌细胞增殖,细胞数量的增加产生了对氧气和营养物质的需求,再加上远离外膜层供应滋养管的生长,引起斑块变得缺氧,刺激微血管从外膜生长到含有粥样斑块的内膜,同时吸引免疫细胞,进一步加剧炎症反应和疾病进展[16]。新形成的血管通常不成熟且具有渗漏性,易出现出血等不良事件,导致病变内的间质压力增加及被巨噬细胞吸收的游离胆固醇积累,这些过程增加了斑块的不稳定性并增加了破裂的风险[17]。
本研究不足:(1)本研究作为一个横断面研究,无法进一步证实患者sTRAIL-R2表达与其斑块炎症反应、细胞凋亡相关因子表达的因果关系,这也是未来研究工作的重点之一;(2)本研究未进行细胞层次实验或动物实验进一步观察sTRAIL-R2表达对心肌梗死患者介入治疗后细胞凋亡分子层面作用机制,仅能通过患者最终表达进行分析,深入研究也是下一步工作重点,进一步研究可通过外在手段对斑块细胞进行培养并干预其sTRAIL-R2表达,观察其与斑块细胞变化的因果关系;(3)本研究纳入样本较少,且全为本院患者,可能缺乏普遍性,下一步需扩大纳入样本进行更深层次分析。虽然本研究具有以上不足,但本研究结果依然具有一定参考价值,希望在下一步工作中进一步完善,为国内相关研究及发展提供帮助。
综上所述,sTRAIL-R2高表达可引起颈动脉斑块细胞Caspase-8、Caspase-3活性升高,细胞凋亡相关蛋白表达水平上调并引起患者斑块炎症反应加剧,可能导致患者易损斑块出现,对其进行靶向干预可能可稳定患者病情。

