紫苏叶精油微胶囊的工艺优化及稳定性研究
徐艳群,蒋爱月,唐石云,李振杰,向能军,刘志华,太志刚**
(1.云南省烟草化学重点实验室,云南中烟工业有限责任公司 技术中心,云南 昆明 650231;2.昆明理工大学 生命科学与技术学院,云南 昆明 650500)
紫苏(Perilla frutescens)为唇形科紫苏属药用植物,性温,味辛,紫苏叶具有发散风寒,行气和胃之功效,现代药理学表明紫苏具有抗过敏炎症、抗衰老、抑制血小板凝聚、预防癌变和降血脂等活性[1].中国紫苏资源丰富,在食品和化妆品等行业具有广阔的市场空间.从紫苏叶中获取的挥发油具有抑菌、提高免疫功能、抑制中枢系统及抗氧化的药理作用,其化学成分主要为单萜、倍半萜、芳香类、脂肪族类等[2].但以上成分均具有挥发性,在常温常压下,易氧化和损失.微胶囊技术可有效地解决以上问题,可延缓香气释放,在常温常压下,香味物质被包裹在囊材中,释放量较少,加热时,香味物质缓慢释放出来[3-5].目前,已有相关文献报道的紫苏叶精油微胶囊多以喷雾干燥法进行包裹,如苏刘花等[6]以紫苏精油为芯材,以壳聚糖、蔗糖、葡萄糖为壁材,采用喷雾干燥制得紫苏精油微胶囊,常温下保持紫苏精油的稳定性,在加热时缓缓释放香气,其刺激感降低,香韵增加.李会珍等[7]公开了一种紫苏精油微囊的制备方法,选用低黏度辛烯基琥珀酸淀粉酯作为壁材,通过喷雾干燥法成功制备其微胶囊,作为有效的保鲜剂,长效作用于果蔬.以上方法可有效包裹紫苏精油,保证其稳定性,但其制备方法多以喷雾干燥法为主,操作温度较高,易使部分紫苏精油挥发损失.
单凝聚是一种微胶囊包埋技术,通过在高分子囊材溶液中加入凝聚剂,降低高分子溶解度,促使其凝聚成囊,具有操作简单,容易成囊,便于扩大化生产的特点[8-9].有相关文献报道采用单凝聚法制备微胶囊,可保持其中芯材的稳定和缓释性.如吴绍明等[10]以壳聚糖为壁材,橄榄油为芯材,采用单凝聚法制备了护肤保健功能的微胶囊,有效避免橄榄油的氧化,保持了其稳定性.目前,还未发现单凝聚法制备紫苏精油微胶囊的研究报道,本研究拟以明胶为壁材,采用单凝聚法对紫苏叶精油进行包埋,以包埋率为指标,对其工艺进行优化,所得产品进行稳定性研究,以期对其在烟草和食品应用方面奠定基础.
1 材料与方法
1.1 实验材料与仪器明胶购自山东大凯生物科技有限公司,紫苏叶油购自华新植物精油公司,乙酸、甲醛、氢氧化钠和无水硫酸钠均为分析纯,购自于国药集团有限公司.SZCL2 数显智能控温磁力搅拌器,巩义市予华仪器有限责任公司;LGJ10真空冷冻干燥机,北京松源华兴科技发展有限公司;t25 高速分散机,德国IKA 公司;Quanta200 扫描电子显微镜(SEM),美国FEI 公司;Agilent 7890A/MS5977B 气质联用仪(GC/MS),美国安捷伦科技有限公司;TG/DSC 型热重/差热综合热分析仪,瑞士 Mettler Toledo 公司.
1.2 紫苏叶精油微胶囊的制备及形貌观察将适量明胶与蒸馏水混合后,保持60 ℃,时时搅拌,使其溶解,将适量紫苏叶精油加入以上溶液中,乳化,持续搅拌,滴加10%乙酸,调pH 为3.3~3.8,缓缓滴加适量20 g/100 mL 硫酸钠溶液,再适量滴加10 g/100 mL 的硫酸钠稀释液,持续搅拌,加冰冷却,滴加适量甲醛溶液(12 mol/L),持续搅拌,采用20 g/100 mL 氢氧化钠调pH 为8,搅拌一定时间,抽滤,蒸馏水反复洗涤,冷冻干燥得紫苏叶精油微胶囊.取一滴紫苏叶精油微胶囊悬浮液,将其置于载玻片上,于光学显微镜(IM)下观察,拍照记录.取少量紫苏叶精油微胶囊固定于扫描电镜平台上(SEM),保持真空度小于10 Pa,电流大于15 mA,喷金120 s,样品高度9.1 mm,电镜电压5 kVA,放大5 000 倍.
1.3 包封率测试按照Toure 等[11]的方法,稍作修改进行包封率测试,将200 mg 紫苏叶精油微胶囊置于40 mL 蒸馏水中浸泡,搅拌分散,加入40 mL正己烷,混匀,静置,取正己烷层,补加正己烷定容至50 mL,得到游离紫苏精油.余下的水液超声5~15 min 充分分散,加入40 mL 正己烷,超声5 min,并时时摇匀,密封,静置30~60 min,4 000 r/min 转速下离心3 次,每次10 min,取正己烷萃取相并定容至50 mL,得胶囊核内紫苏叶精油.对游离和核内紫苏叶精油进行气质联用测定,条件如下:色谱柱型号为HP-5 ms(30 m×ϕ0.25 mm,0.25 μm),进样口280 ℃,氦气流速1 mL/min,升温梯度如:50 ℃(保持3 min),50 ℃→280 ℃(速率为3 ℃/min),280 ℃(保持10 min).质谱条件为:EI 离子源,离子源温度为230 ℃,四级杆温度为150 ℃,扫描范围45~500.通过主要化合物峰面积对紫苏叶精油微胶囊的包埋率进行计算,公式如下:
式中:A内为紫苏叶油微胶囊核内精油峰面积;A游为游离紫苏精油峰面积.
1.4 单因素试验
1.4.1 芯壁质量比优化 在其它同等条件不变的情况下,固定凝聚时间60 min,凝聚温度40 ℃和pH 3.8,考察芯壁质量比为1∶2、1∶1、1.5∶1、2∶1,按照以上制备方法,得到不同芯壁质量比的紫苏叶精油微胶囊,测定包埋率,重复3 次.
1.4.2 单凝聚时间优化 在其它同等条件不变的情况下,固定芯材与壁材质量比为1.5∶1,凝聚温度40 ℃和pH 3.8,在单凝聚时间分别为 30、45、60、75、90、105 min 和120 min 的条件下,制备紫苏叶精油微胶囊,测定包埋率,重复3 次.
1.4.3 单凝聚温度优化 在其它同等条件不变的情况下,固定芯材与壁材质量比为1.5∶1,单凝聚时间60 min 和pH 3.8,在单凝聚温度分别在35、40、45 ℃和50 ℃的条件下制备紫苏叶精油微胶囊,测定包埋率,重复3 次.
1.4.4 凝聚 pH 在其它同等条件不变的情况下,固定芯材与壁材质量比为1.5∶1,单凝聚时间60 min,凝聚温度35 ℃,在凝聚pH 分别为3.0、3.3、3.5、3.8、4.1 和4.5 的条件下制备紫苏叶精油微胶囊,测定包埋率,重复3 次.
1.5 响应面试验设计为进一步优化单凝聚法制备紫苏叶精油微胶囊的最佳工艺条件,本研究在以上单因素实验基础上,参考文献[12],对芯材与壁材质量比、单凝聚时间、单凝聚温度、凝聚pH 值等4 个因素进行优化,并以之为自变量,以包埋率为响应值,设计四因素三水平响应面试验.
1.6 稳定性测试经工艺优化后,按照最佳条件制备的紫苏叶精油微胶囊,取适量,精确称重,常温置于空气中,定时称量其质量变化和包埋率,记录数据,研究常温稳定性.
取以上制备的样品和适量紫苏叶精油,进行热重分析.仪器开机后,于800 ℃保持15 min,排除相关杂质.分别将紫苏叶精油微胶囊和其精油置于坩埚中,起始温度为30.0 ℃,在80 mL/min 的氮气氛围内,以10 ℃/min 的速率升温至800.0 ℃.通过以上试验研究加温稳定性.
1.7 数据处理每次实验测定3 次,以平均值±SD 表述结果,采用Origin8.5 对数据进行作图,采用响应面软件Design-Expert 8.0.6.1 对响应面实验结果进行分析.其中,P<0.01 表示差异高度显著,P<0.05 表示差异显著.
2 结果与分析
2.1 单因素试验结果
2.1.1 芯壁质量比优化 芯壁质量比分别为1∶2、1∶1、1.5∶1 和2∶1 时,显微镜拍照显示见图1.

图1 不同芯壁质量比制备所得紫苏叶精油微胶囊的形貌图Fig.1 IM picture of PO/GE at different ratio of core to wall
如图1 所示,芯壁质量比在1∶2~2∶1 范围内,均能看到单壁紫苏叶精油微胶囊,为球状,当包封率为1.5∶1 时,微胶囊数量最多.图2 显示,当芯壁质量比低于1.5∶1 时,随芯壁质量比增加,包封率逐渐增加,当芯壁质量比达1.5∶1 时,包封率达到89.4%;高于1.5∶1 时,随芯壁质量比增加,包封率降低.同时,在包封率最高处,即芯壁质量比为1.5∶1 时,所对应微囊的的扫描电镜如图3 所示,视野中,微胶囊数量较多,且微囊表面光滑,囊壁完整无裂纹,尺寸范围多在20~40 μm,存在絮状物.这是因为在凝聚过程中,有部分未包裹成功的凝聚态明胶.此结果说明紫苏叶精油含量增加时,囊材相对变薄,致使部分紫苏叶精油不能进入壁材,即使进入也有部分精油再泄漏出来.以上结果说明,芯壁质量比的变化对单凝聚包裹紫苏叶精油具有显著影响,当芯壁质量比为1.5∶1 时,包封率达到最佳值89.4%.

图2 不同芯壁质量比时紫苏叶微胶囊的包埋率Fig.2 Effect of different ratio of core to wall on embedding rate

图3 芯壁质量比为1.5∶1 紫苏叶精油微胶囊扫描电镜图Fig.3 SEM picture of PO/GE at ratio of core to wall 1.5∶1
2.1.2 单凝聚时间 由图4 可知,当明胶凝聚时间在30~42 min 内,紫苏叶精油包埋率由83.5%微降至81.0%,排除误差因素,聚合初期,因浓度差大,聚合速率相对较快,单位时间产生的微胶囊较多,随着时间延长,包封率降低,部分胶囊再次解聚,致使包封率降低.当明胶凝聚时间在42~63 min内,紫苏叶精油包埋率由81.0%升至88.7%,这可能是随着时间的增加,明胶仍有较大浓度差,不断凝聚,包埋率逐渐增加.当明胶凝聚时间超过63 min 之后,包埋率反而降低,说明有部分明胶解聚致使已包裹的紫苏叶精油释放出来.由此可见,63 min 为紫苏叶精油微胶囊包埋的最佳凝聚时间.
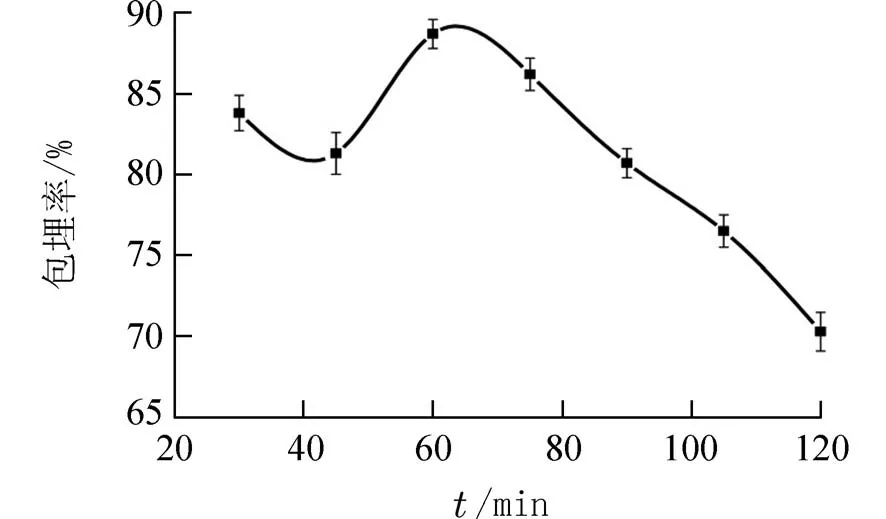
图4 不同凝聚时间紫苏叶精油微胶囊的包埋率Fig.4 Effect of coagulation time on embedding rate
2.1.3 单凝聚温度 由图5 可知,当凝聚温度处于35~50 ℃范围内时,包埋率先增大后减小,温度达40 ℃时,包埋率达到最佳值85.8%.35~40 ℃时,温度升高,聚合加速,包埋率增加,当温度为40 ℃时,聚合达到饱和,继续升高温度,明胶的分子热运动加剧,再次解聚,溶解,聚合朝逆向进行,导致包埋率较低.以上结果表明,聚合温度为40 ℃时为紫苏叶精油微胶囊包埋的最佳凝聚温度.

图5 不同凝聚温度下紫苏叶精油微胶囊的包埋率Fig.5 Effect of coagulation temperature on embedding rate
2.1.4 凝聚pH 值 由图6 可知,调pH 由3.0 至4.5 时,包埋率先增大后减小,当pH 值为3.6 时,包埋率达到了最大值86.2%.以上结果说明,明胶凝聚过程中,pH 是一个重要因素,pH 值或高或低均不利于单凝聚包裹进行,当pH 为3.6 时,凝聚效率最佳,包埋率最高.

图6 不同pH 下紫苏叶精油微胶囊的包埋率Fig.6 Effect of pH on embedding rate
2.2 试验工艺优化
2.2.1 响应面试验 根据以上单因素试验的结果,选择对包埋率影响较为显著的4 个因素,分别为芯壁质量比(A)、凝聚时间(B)、凝聚温度(C)、凝聚pH 值(D),将这4 个因素设为自变量,以包埋率为响应值,设计了四因素三水平的响应面分析试验.其中,表1 为试验因素和水平,表2 为试验方案、数据及结果.

表1 响应面试验因素及水平Tab.1 Response surface design of factors and their levels

表2 响应面试验设计及结果Tab.2 The test programme and results of response surface method
基于表2 的数据与结果,为了进一步体现芯材与壁材的质量比(A)、凝聚时间(B)、凝聚温度(C)、凝聚pH 值(D)这4 个因素对紫苏叶精油微胶囊包埋率的影响,根据文献[13]的方法,采用响应面分析软件Design-Expert.V8.0.6.1 进行二次多项回归分析,最终得到多元二次回归方程,方程如下:
Y=90.64+1.02A+0.53B-1.31C+0.38D+0.33AB-0.45AC+0.100AD-1.18BC+0.60BD+2.50CD-4.47A2-2.38B2-1.92C2-4.75D2,其中,决定系数0.84,CV 为2.42%.
2.2.2 响应面方差分析 回归方程各项的方差分析结果如表3 所示.

表3 回归方程各项的方差分析Tab.3 Analysis of variance of regression equation
由表3 可知,方差来源中的模型项所对应的P值为0.001 9,小于0.01;失拟项P值为0.119 1,大于0.05,即P=0.119 1>0.05,说明该二次方程模型差异高度显著,方程较理想,说明该方程拟合芯材与壁材的质量比(A)、凝聚时间(B)、凝聚温度(C)和凝聚pH 值(D)4 个因素,与紫苏叶精油微胶囊包埋率之间的关系可行.该方程的复相关系数R2为0.84,这个结果说明以上所得模型与实际试验之间具有良好的拟合度.综合以上结果,参考文献[14],所得二次方程模型与实际情况拟合良好,可以用于预测紫苏叶精油微胶囊包埋率的变化.
F值为均方的比值,越大说明差异越显著.F值的大小可反映各因素对紫苏叶精油微胶囊包埋率影响,F值增加,影响越显著[15].由表3 所示,A(芯壁质量比)、B(凝聚时间)、C(凝聚温度)和D(凝聚pH)的F值分别为2.99、0.81、4.87 和0.42,因此,紫苏叶精油微胶囊受各因素影响程度大小的次序为凝聚温度(C)>芯壁质量比(A)>凝聚时间(B)>凝聚pH(D),其中凝聚温度(C)对包埋率的影响显著(P<0.05).
2.2.3 响应面分析 进一步通过交互影响分析各因素对紫苏叶精油微胶囊包埋率的影响.具体如图7 所示,图7(a)为凝聚温度与凝聚pH 的交互影响,图7(b)为凝聚时间与凝聚pH 的交互影响,图7(c)为芯壁质量比与凝聚时间的交互影响,图7(d)为凝聚温度与芯壁质量比的交互影响,图7(e)为凝聚温度与凝聚时间的交互影响,图7(f)为芯壁质量比与凝聚pH 的交互影响.三维曲面能有效直观分析凝聚温度、芯壁质量比、凝聚时间和凝聚pH 因素及它们之间的交互作用对包埋率的影响.
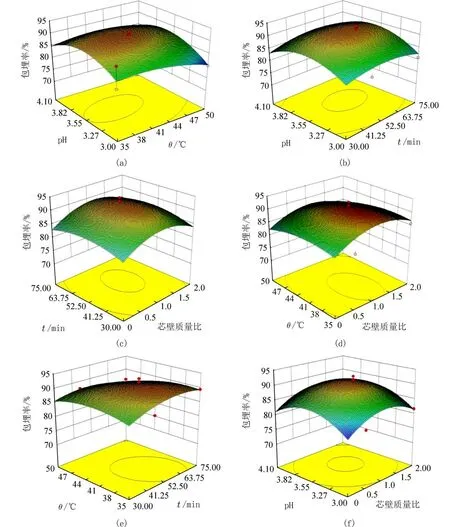
图7 各因素交互影响紫苏叶精油微胶囊的包埋率响应面Fig.7 Response surface of PO/GE embedding rate influenced by different factors
图7(a)~7(f)等高线图呈椭圆形,说明凝聚温度、芯壁质量比、凝聚时间和凝聚pH 对紫苏叶精油微胶囊的包埋率的影响显著,以上结果与表2 中的显著性分析基本是一致的.
2.3 最佳工艺条件的验证以包埋率为指标,基于所得模型,利用Design-Expert 8.0.6.1 软件对影响因素进行了优化,紫苏叶精油微胶囊最佳工艺为芯壁质量比(A)为1.5∶1、单凝聚时间(B)为63.9 min、单凝聚温度(C)为39.1 ℃、凝聚 pH 值(D)为3.6,通过以上理论计算,在此条件下所得包埋率应为90.1%.基于以上所得优化条件,开展了3 组实际验证试验,最终所得平均包埋率为88.3%,误差为±0.95%,接近于理论值,以上结果与单因素优化结果基本一致,说明采用响应面法优化工艺所得的最佳条件可靠.
2.4 稳定性分析为了进一步验证紫苏叶精油微胶囊的稳定性,采取2 种方式研究其稳定性.第1种方式为常温稳定性研究,将微胶囊置于常温空气中,研究其质量和包埋率变化.随时间推移,其质量没有减少,反而增加,其原因是微胶囊经干燥后,其饱和水低于空气中水汽饱和度,造成吸水效应,第1 天吸收率达0.39%,第2~7 天吸水率呈微小上升趋势,此结果与文献[16]报道相符.基于以上,本研究进一步测试了常温下紫苏叶精油微胶囊7 天内的包埋率,结果如图8~9 所示,在第1 天内,包封率由88.4%降到85.1%,而第2~7 天变化微小,此结果说明有少量未被包裹的精油附在微胶囊表面,并在空气中自由挥发,导致其包埋率降低.而胶囊内部的精油被明胶所包裹,不易在常温下释放出来,故后续其包埋率不变.

图8 常温下紫苏叶精油微胶囊质量变化Fig.8 Weight-change curve of PO/GE in room temperature

图9 常温下紫苏叶精油微胶囊包埋率的变化Fig.9 Content change of PO/GE in room temperature
第2 种方式是采用持续加温的方式观察其加热稳定性.如图10 所示,图10(a)和图10(b)分别为紫苏叶精油及其微胶囊的热重和热差曲线,图10(a)显示紫苏叶精油失重的温度在30~186 ℃区间,描述失重曲线和DSC 曲线的变化,数据表明失重率为82.5%.紫苏叶精油微胶囊的失重范围为110~440 ℃,描述失重曲线和DSC 曲线的变化,失重率为65%.以上结果说明紫苏叶精油微胶囊较未包裹精油热分解温度增加,热稳定性大幅增加,可有效保持紫苏叶精油的稳定性.

图10 紫苏叶精油及其微胶囊的热重和差热分析Fig.10 TG/DSC curve of PO and PO/GE
3 结论
本文采用明胶单凝聚法制备单壁微胶囊,以紫苏叶精油为芯材,结合冷冻干燥法成功制备了紫苏叶精油微胶囊,通过显微镜和扫描电镜观察其形貌.进一步以包埋率为指标,采用单因素试验,考察并初步优化了芯壁质量比、单凝聚时间、单凝聚温度和凝聚pH,根据以上结果,采用 Design-Expert 8.0.6.1 软件进行了四要素三水平的响应面试验,得到最佳优化条件为芯壁质量比为1.5∶1、凝聚时间63.9 min、凝聚温度39.1 ℃、pH 值为3.6,包埋率理论值达90.1%,实际验证为88.3%,结果证明该结果合理.基于以上,进一步研究紫苏叶精油微胶囊的稳定性,结果发现常温下,微胶囊稳定,存放时间加长,包埋率没有发生改变.加热时,其热稳定性较未包裹紫苏叶精油增强.以上研究表明,经过优化工艺制备的紫苏叶精油微胶囊包埋率较高,稳定性增强,在食品、烟草和芳香疗法产业上的应用具有良好前景.

