经导管三尖瓣缘对缘修复术操作流程
刘先宝 任凯达 蒲朝霞 林心平 王力涵 胡泼 蒋巨波 王建安
三尖瓣反流长期以来一直被忽视,美国流行病学研究显示,三尖瓣反流在一般人群中的患病率约0.55%,且随年龄增长而增加,75岁以上人群中患病率达4%[1]。随着世界人口老龄化的加速,三尖瓣反流的发生率呈现逐年上升的趋势。由于单纯外科三尖瓣修复术围术期死亡率高[1],临床实践中往往采取药物保守治疗。对于长期三尖瓣重度反流患者,单纯药物治疗无法完全缓解三尖瓣反流引起的右心衰竭症状,因此采取更为积极的临床干预治疗尤为重要。
经导管介入技术治疗主动脉瓣及二尖瓣疾病已相对成熟,经导管介入治疗三尖瓣反流,尤其是经导管缘对缘修复术(transcatheter edge-to-edge repair,TEER),逐渐成为部分高风险三尖瓣反流患者的治疗选择。2021年欧洲指南[2]推荐,对于有症状的重度继发性三尖瓣反流患者,经心脏瓣膜团队评估无法进行外科手术时,可考虑经导管治疗(Ⅱb),这表明三尖瓣经导管治疗目前可考虑作为外科手术高危患者的替代疗法。
相较于二尖瓣的缘对缘修复技术,三尖瓣对于超声影像质量及术者的器械操作要求更高。因此需要标准化的手术操作流程和密切的团队配合。目前国内外对于这部分操作流程的单独介绍较少。本单位作为国内最早开展此项技术的中心,结合早期的应用经验,并以国内首款经导管三尖瓣瓣膜夹系统DragonFly-T为例,总结出经导管三尖瓣缘对缘修复术(T-TEER)的操作流程,为新开展此项技术的中心提供参考。
1 DragonFly-T 器械特点
DragonFly-T系统是国内首款经股静脉三尖瓣缘对缘瓣膜修复系统(图1)。相较用于二尖瓣瓣膜修复的DragonFly-M系统[3-5],新增了两个规格型号:0612Pro和0609Pro。新增的型号具有更大尺寸的封堵网,这一改进可以更好地阻挡较宽的反流,有效减少瓣膜夹置入数量和手术操作时间。另外,DragonFly-T系统沿用二尖瓣 DragonFly-M系统的调整方式,可以显著缩短术者对于新操作系统的学习曲线。

图1 DrangonFly-T 器械型号及操作示意Figure 1 DragonFly-T device model and operation diagram
2 T-TEER术中常用超声切面及其与二尖瓣TEER(M-TEER)术式类比说明
三尖瓣的成像可能受到其相对位置的限制,因此术中成像主要依赖于食管中段、食管下段及经胃底切面。DragonFly-T系统操作过程中,需要使用的工作切面主要包括:(1)食管中段上下腔切面,监测并引导器械前进的方向;(2)3D en face切面,即三尖瓣外科视角,从心房面观察三尖瓣,通常主动脉瓣位于9点钟位置作为定位的解剖标志;(3)右心室流入-流出道切面,在此基础上进行双平面成像,可指导器械进行前隔和后隔方向上移动;(4)经胃底短轴切面,该切面可同时显示三尖瓣的前叶、隔叶及后叶,是器械定向与定位的重要切面(表1)。
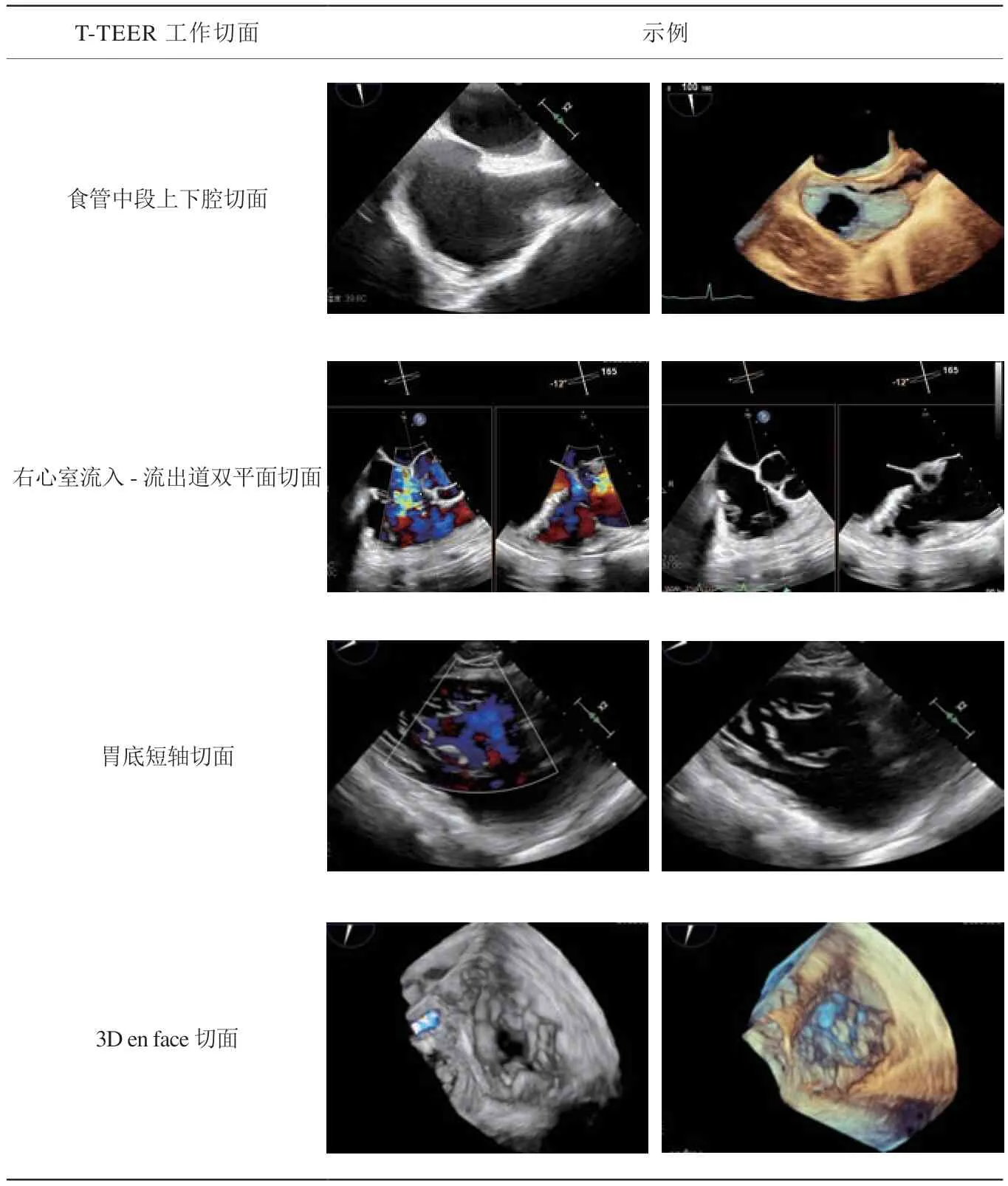
表1 T-TEER 术中经食管超声心动图常用成像切面示例Table 1 Examples of commonly used intra-operative images for T-TEER
右心室流入-流出道切面作为工作切面中的主要切面,为便于理解,可将其等效于M-TEER中的交界联合切面,即从主动脉侧往游离壁侧的节段分别定义为“1区”“2区”“3区”,“1区”对应三尖瓣前叶,“3区”对应三尖瓣后叶(图2),调节取样线角度可在对应的四腔心切面获得前隔交界(1区)到后隔交界(3区)的瓣叶情况(图3),可以此确定反流口的具体位置。此外,T-TEER术中的3D en face切面也可与M-TEER进行对比(图4),M-TEER术中往往将主动脉瓣置于12点钟方向,而T-TEER术中则建议将主动脉瓣置于9点钟方向,通过主动脉瓣及房间隔的位置判断三尖瓣的前、后、隔叶。由于三尖瓣相对超声探头位置较远及其他结构遮挡,三维切面显示不清时,通常以经胃底短轴切面为主,辅助3D en face切面对瓣膜夹进行定位。
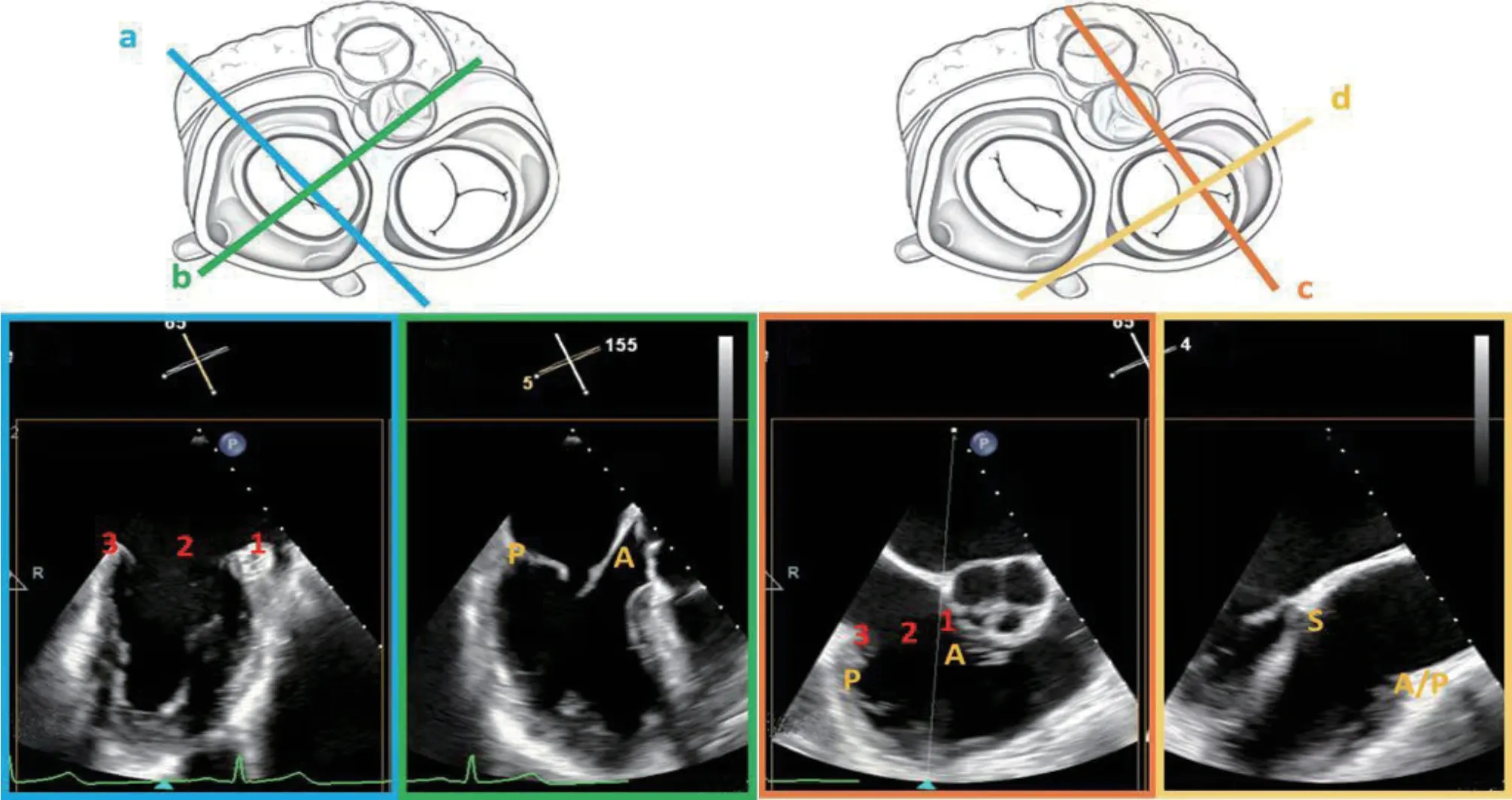
图2 T-TEER 右心室流入-流出道切面等效于M-TEER 中的交界联合切面Figure 2 T-TEER right ventricular inf low outf low T-TEER right ventricular inf low outf low view is equivalent to the commissural view in M-TEER is equivalent to the junction joint section in M-TEER
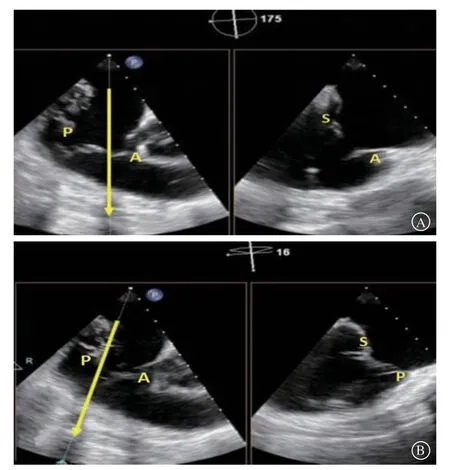
图3 在右心室流入-流出道切面调节取样线角度,可在对应的四腔心切面获得前隔交界(A)到后隔交界(B)的瓣叶情况Figure 3 Adjusting the cutting line in the right ventricular inflow and outflow view can obtain the valve leaflets from the ant-septal(Figure A)to the postseptal(Figure B)in the corresponding four chamber view
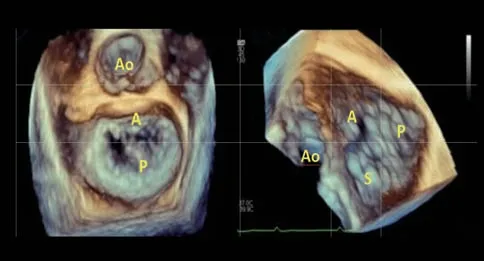
图4 T-TEER 术中的 3D en face 切面与M-TEER 的对比Figure 4 Comparison of 3D en face view between M-TEER and T-TEER
3 T-TEER 操作步骤
3.1 股静脉穿刺
TEER术式最常见的是右股静脉路径,穿刺点一般高于股深股浅分叉,首选股骨头中上段,可以股动脉搏动为参照;在股静脉分叉1 cm以上穿刺,穿刺点位于股静脉正中处,穿刺后用手术刀和剪刀充分扩皮,建议在超声引导下建立血管通路,减少血管并发症发生。可以提前预埋1把Proglide血管缝合器。使用血管扩张鞘扩张右股静脉使其可容纳24 Fr的导引鞘。
3.2 导引鞘进入右心房
保持鞘管调节刻度位于初始位置,在正位透视下将导引鞘沿着超硬导丝置入右心房,直至导引鞘头端到达上腔静脉与右心房交界处后,将导引鞘固定在金属支架上,使用螺口注射器抽负压的同时将导丝和内芯抽出。导引鞘进入右心房后可使用经食管中段上下腔切面及三维模式观察器械的位置(图5)。
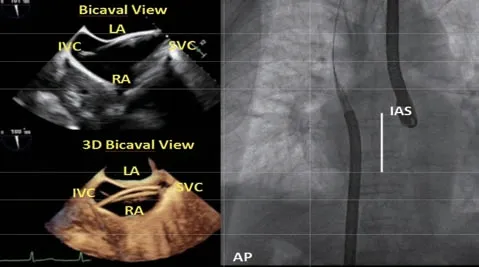
图5 导引鞘进入右心房Figure 5 Guide sheath entering the right atrium
3.3 瓣膜夹系统进入右心房
沿着导引鞘送入瓣膜夹系统,待瓣膜夹头端与导引鞘齐平,把瓣膜夹系统固定在支架上,锁定瓣膜夹。缓慢后撤导引鞘,直至导引鞘的M a r k e r点位于中鞘两个Ma r k e r点中间,实现骑跨,即“s t r a d d le”。使用正位或者右前斜位的透视确定导引鞘和中鞘何时达到最佳的“s t r a d d l e”位置,结合使用经食管中段上下腔切面及三维模式确定中鞘与导引鞘的相对位置(图6)。
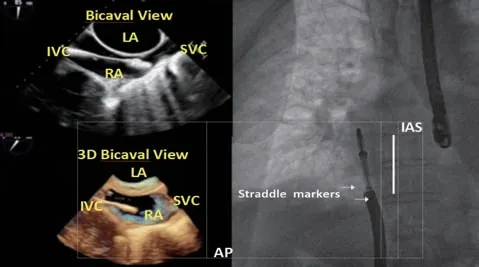
图6 回撤导引鞘,显露出瓣膜夹系统Figure 6 Retracting the guide sheath to expose the clip
3.4 瓣膜夹调弯
通过对中鞘调弯,使得瓣膜夹弯向三尖瓣瓣环平面。调弯过程中若出现瓣膜夹碰到房间隔或心房壁,可根据情况调整导引鞘,使瓣膜夹到达目标位置。操作应在经食管超声心动图(transesophageal echocardiography,TEE)的右心室流入-流出道切面的双平面成像模式下进行,避免损伤房间隔或心房壁(图7)。
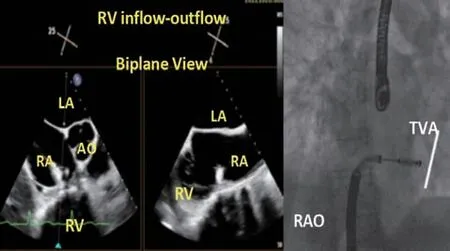
图7 器械调弯,使瓣膜夹指向瓣环Figure 7 Bending system to make the clip towards the valve annular plane
3.5 瓣膜夹定位
调整瓣膜夹位置,使其位于目标夹持区域的上方。除单独调节中鞘的M/L键外,可通过整体平移导引鞘和中鞘,使输送系统整体靠近前隔或后隔区域。这一步的超声工作切面除右心室流入-流出道切面的双平面成像模式以外,可使用经胃底短轴切面结合三尖瓣的3D en face切面对瓣膜夹进行准确定位。
3.6 调整瓣膜夹方向
打开瓣膜夹双臂至120°,顺时针或逆时针旋转操作手柄可以调整瓣膜夹的方向,在3D en f ace切面下进行观察使其垂直于目标夹持区域的瓣叶闭合线(图8)。
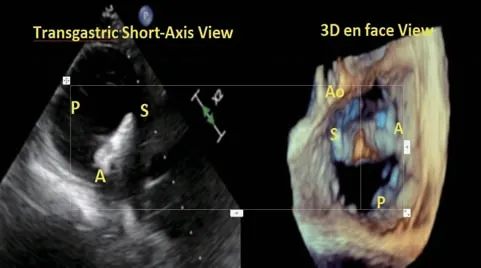
图8 在经胃短轴切面及三维切面确定瓣膜夹位置与方向Figure 8 Adjust the clip position and orientation in the trangastric short axis view and three-dimensional view
3.7 调整输送系统轴向
良好的轴向是后续抓捕瓣叶的重要前置条件,但其重要性在实践中常被低估。在右心室流入-流出道切面的双平面成像下,调整中鞘使其达到理想角度,避免发生“s e p t a l h u g g i n g”,即瓣膜夹尾端太过贴靠房间隔,增加瓣叶夹持难度(图9)。若发生“se p t a l h u ggi ng”难以抓取隔叶时,可通过调整导引鞘和中鞘的A/P键进行校正。
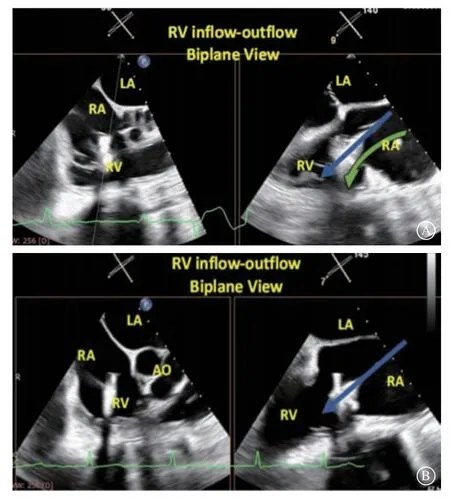
图9 调整输送系统轴向 A.发生“septal hugging”现象;B.调整轴向改善“septal hugging”Figure 9 Adjusting the alignment of the system
3.8 轨迹测试
检查瓣膜夹运动轨迹,即在右心室流入-流出道切面的双平面成像下进行轨迹测试,确认瓣膜夹的行进方向为直线,无“点头”现象,不偏向其他区域(图10)。良好的轨迹有助于提高抓捕瓣叶的成功率,并降低腱索缠绕等可能性。
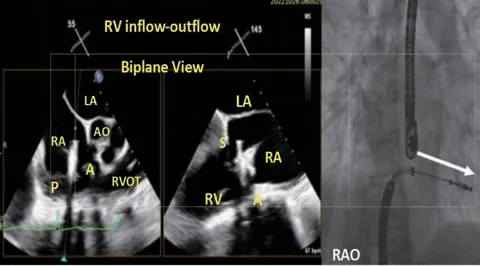
图10 轨迹测试,确认瓣膜夹前进方向Figure 10 Trajectory test
3.9 瓣膜夹进入右心室
于心脏舒张期将打开状态的瓣膜夹缓慢送入心室,到达瓣下即可,避免进入过深缠绕或损伤腱索,若夹持区域靠近交界区可关闭瓣膜夹送入。进入心室后可使用经胃底短轴或降低3D模式的增益再次确认瓣膜夹的方向及位置,若发生旋转或偏移,需再次调整方向和位置,必要时将瓣膜夹翻转撤回右心房重新调整。可以推进探头至食管下段,绕过房间隔、左心房和主动脉瓣,从而获得更清晰的右心室流入-流出道切面及相应的双平面切面。
3.10 抓捕瓣叶
缓慢回撤瓣膜夹,确认有足够的瓣叶稳定在钳臂上,放下gripper确认瓣叶捕获成功且夹合量合适后,3D en f ace切面下再次确认瓣膜夹未发生旋转,缓慢关闭瓣膜夹,同时稍向右心室推进瓣膜夹系统以释放瓣叶张力,然后可以完全关紧瓣膜夹。
可以选择同时捕获或单独捕获瓣叶,这一步在右心室流入-流出道切面及双平面成像模式下进行,瓣膜夹关闭过程中可见反流逐渐减少,关闭后可在经胃底短轴切面及3D-TEE切面确认三尖瓣呈双孔形态。可以使用多平面重建模式同时对两个正交的长轴切面、短轴切面进行成像,更加清晰地显示瓣叶抓捕过程,提高手术效率(图11)。
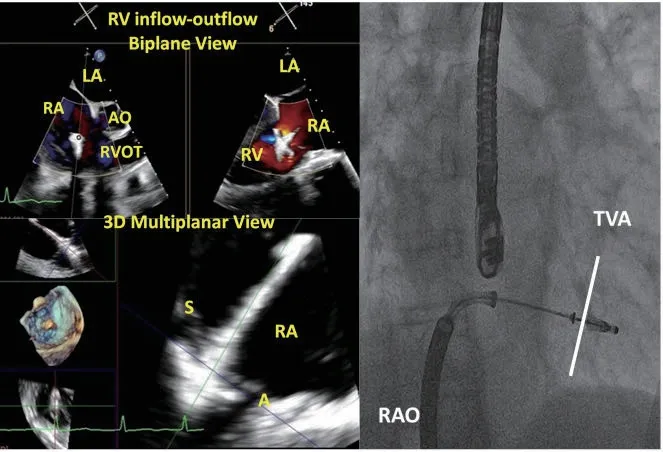
图11 瓣膜夹进入心室,捕获瓣叶Figure 11 Enter into the ventricle and grasp leaf lets
3.11 释放前评估
夹持效果评估主要分为以下4个方面:(1)评估置入位置、方向及瓣叶夹合量是否满意,确保瓣叶被充分夹持且未发生偏转或扭曲,避免因夹持不均匀或不足够发生单叶装置附着,通常使用长型号的瓣膜夹时瓣叶插入长度需达到9 mm及以上;(2)使用双平面切面及彩色多普勒血流显像对残余反流进行定量评估;(3)评估患者的血流动力学获益,右心房压与基线相比应有所下降,肝静脉流血流频谱应可见收缩期前向血流改善;(4)评估三尖瓣跨瓣压差在可接受的范围内,尤其是放置多枚瓣膜夹的情况下,避免发生三尖瓣狭窄[6-7]。
若瓣叶夹持效果不佳,可优先选择调整瓣膜夹位置,即缓慢打开瓣膜夹至270°,将其撤回右心房调整后再次夹持瓣叶。若在瓣膜夹夹持方向及位置评估良好的情况下仍有一侧的残余反流,可考虑置入第二枚瓣膜夹。
3.12 释放瓣膜夹并评估
瓣膜夹释放后,需评估与上述步骤相同的参数(图12),包括瓣叶夹持情况、残余反流、血流动力学获益、三尖瓣跨瓣压差等。若需要置入第二枚瓣膜夹,应根据当前解剖情况及第一枚瓣膜夹的型号确定再次置入的型号及位置(图13~14)。
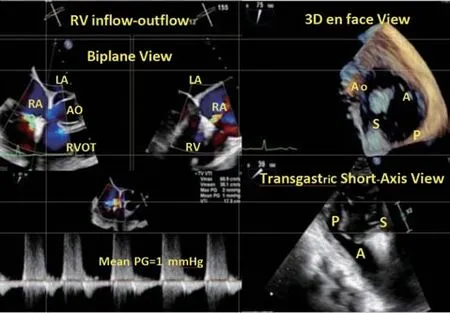
图12 第一枚瓣膜夹释放后评估Figure 12 Evaluation after release of the f irst clip
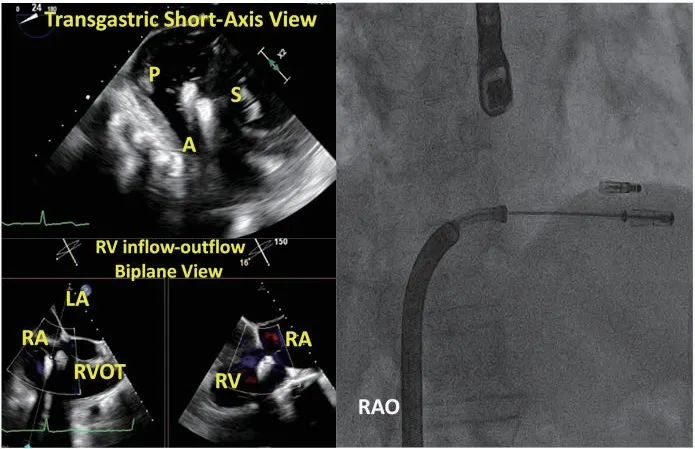
图13 置入第二枚瓣膜夹Figure 13 Implantation of the second clip
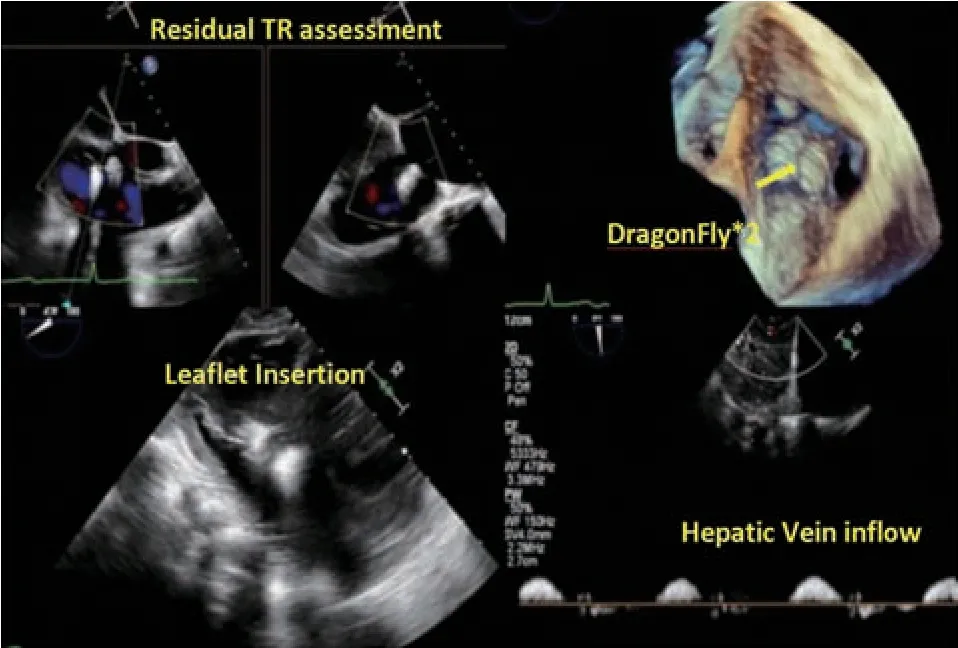
图14 术后评估Figure 14 Postoperative evaluation
3.13 闭合血管路径
手术结束后,在透视下撤出DragonFly-T瓣膜夹输送系统和导引鞘,可通过使用血管缝合器Proglide或传统的压迫“8”字缝合法封闭股静脉。以上各步骤的基本成像视图及要求总结为表2。

表2 经导管三尖瓣缘对缘修复操作及成像要点Table 2 Operation and imaging points of transcatheter tricuspid valve edge-to-edge repair
4 总结
与其他介入手术相比,T-TEER术式的成像要求相对较高,且成像水平直接影响着手术的安全性和有效性。因此,在TEE成像不理想的情况下,辅助使用其他成像方式或许能更好地指导手术进行:新的超声透视融合成像技术可将TEE影像叠加在透视上,提供更为直观的定位信息,提高手术的效率和精准度[8-9]。心腔内超声成像质量优于TEE,尤其是对于存在瓣膜假体、食管病变或其他干扰TEE影像质量因素的患者来说,使用心腔内超声更可靠[10],目前国外也已成功使用3D心腔内超声开展T-TEER[11]。
T-TEER在国内开展尚处于早期阶段。除了优异的器械性能,可重复标准的手术操作流程有利于此项技术快速安全的发展和推广,而该术式适合的获益人群、合适的手术策略及标准化的影像学指导等方面仍需积累更丰富的经验。
利益冲突 所有作者均声明不存在利益冲突

