急性ST段抬高型心肌梗死患者直接经皮冠状动脉介入治疗术后无复流现象的最新研究进展
郝伟 赵晨 胡思宁 贾海波 于波
急性ST段抬高型心肌梗死(ST-segment elevation myocardial infarction,STEMI)是冠心病最危重的疾病分型,有着极高的住院死亡率(6.3%)[1]。直接经皮冠状动脉介入治疗(primary percutaneous coronary intervention,PPCI)是目前治疗STEMI患者首选的再灌注策略。然而,即便闭塞血管血流恢复后,仍有部分患者存在心肌灌注受损的情况,这种现象称为无复流(no reflow,NR),通常又被称为微循环阻塞(microvascular obstruction,MVO)[2]。研究表明,即使是术中短暂的NR现象[通过心肌梗死溶栓治疗试验(thrombolysis in myocardial infarction,TIMI)血流分级≤Ⅱ级诊断]也是患者远期不良预后的重要预测因素[3-4]。因此,当前临床实践下,NR仍是阻碍STEMI患者从PPCI术中实现最大获益的主要障碍。本文将主要就STEMI患者PPCI术后NR的诊断、病理机制、预测因素及其防治策略的最新研究成果及进展进行综述。
1 NR 的定义与诊断
NR具体被定义为在冠状动脉机械性阻塞解除后,即明确无残余狭窄、血栓、夹层或痉挛的情况下,患者仍存在心肌灌注受损的情况。目前临床上评估NR的方法有很多,其发生率(30%~50%)也因诊断标准的差异而有所不同。多数研究使用冠状动脉造影定义NR,通常以TIMI血流分级<Ⅲ级或TIMI血流分级Ⅲ级且心肌呈色分级(myocardial blush grade,MBG)<Ⅱ级进行诊断。但事实上,仅根据血管造影评估NR很大程度上低估了其发生率。在当代临床诊疗实践下,NR不应仅限于冠状动脉NR,同时更要关注到心肌再灌注的质量,即心肌NR。
早期诊断并干预NR是改善STEMI患者PPCI术后临床结局的关键,多种新型诊断方法的应用为精准评估微循环灌注提供了技术支持,如冠状动脉血流储备(coronary flow reserve,CFR)、微循环阻力指数(index of microcirculatory resistance,IMR)及心脏磁共振成像(cardiac magnetic resonance,CMR)等[5]。
1.1 CFR
CFR是指冠状动脉血流可通过运动、压力或血管舒张而增加的比率,可以通过非侵入性方式(超声心动图、正电子发射计算机断层显像或CMR)和侵入性方式(多普勒流速或热稀释技术)测量。临床上多采用多普勒流速或热稀释技术评估心外膜冠状动脉及微循环的情况,分别定义为充血状态下多普勒导丝得出的平均峰值流速或基于热稀释技术的平均传输时间(transit mean time,Tmn)与静息状态下的比值。最近,一项纳入79项研究,共59 740例患者的荟萃分析表明,相比CFR正常患者,CFR异常的患者发生心血管事件(3.4倍)和死亡(3.8倍)的风险显著增高[6]。这一发现建议临床医师更常规地将冠状动脉血流测量作为患者诊断和危险分层工具,以制订个性化的治疗方案。
1.2 IMR
IMR是一种基于热稀释原理评价微循环功能的方法,具体定义为充血状态下冠状动脉远段压力与Tmn的乘积。与CFR相比,IMR不易受血流动力学变化和心外膜冠状动脉狭窄程度的影响,且可重复性更高。研究表明,对于行PPCI的STEMI患者而言,术后IMR>40的患者1年时主要终点(包括心力衰竭导致的再住院和死亡)的发生率显著高于IMR≤40的患者(17.1%比6.6%,P=0.027),并且IMR<40是患者死亡的独立预测因子[7]。此外,IMR与CMR检测的MVO有很好的相关性,提示IMR可评价MVO严重程度并对其进行分级。尽管IMR在评估患者微循环状态中具有潜在的优势,但由于额外增加了手术的复杂性、时间和成本,大大限制了其在临床实践中的应用。因此,一种基于造影的无导丝IMR评估方法——造影衍生的微循环阻力指数(angiography-derived index of microcirculatory resistance,IMRangio)应运而生,显著简化了冠状动脉微循环功能的评估流程,并在初步的研究中显示出与基于压力导丝测量的IMR具有较高的一致性和良好的诊断性能[8]。这种微创、可靠的微循环评估手段对于实现患者的危险分层和精准诊疗具有重要的临床意义。因此,进一步评估其安全性和有效性是非常必要的。
1.3 CMR
CMR可一站式评估梗死后心脏的形态与功能,是目前无创检测MVO最敏感的技术和最佳的随访手段。大量研究已经证实了CMR在评估微循环中的价值。一项纳入1 688例STEMI患者的荟萃分析[9]表明,CMR检测的MVO程度每增加1%,1年死亡的风险就会增加1.14倍。此外,最近一项应用CMR对STEMI患者进行10年随访的研究显示,近1/3的患者在梗死后持续存在梗死区域铁沉积和水肿[10]。这一发现提示,CMR不应仅局限于评估微循环状态,未来更是表征心肌梗死后的组织病理学特征和探究MVO具体机制的一大利器,这将有助于进一步明确缺血再灌注损伤的干预窗口和评价心脏保护策略,从而预防和减少心肌梗死后心力衰竭的发生,改善STEMI患者的长期预后。
2 NR 的病理机制
NR与冠状动脉微循环功能和结构的改变相关,目前已经明确诱发NR的5个主要因素包括:既往存在的微循环损伤、远端微栓塞、心肌缺血性损伤、心肌再灌注损伤及个体对微血管损伤的易感性[11](图1)。
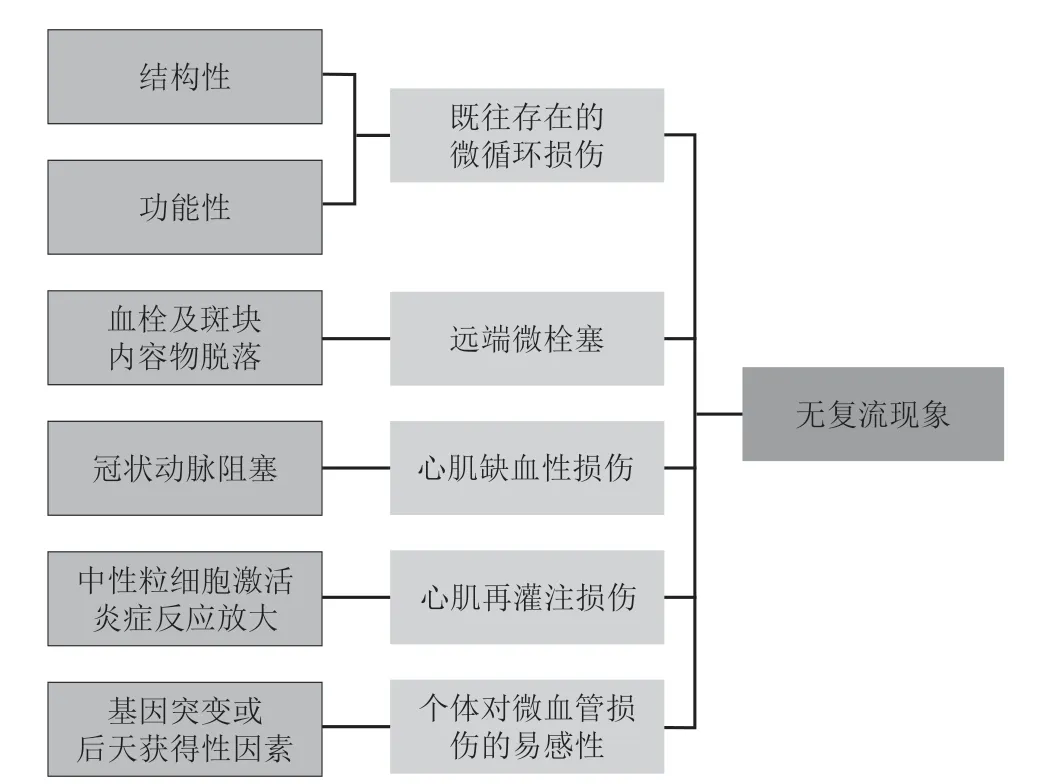
图1 无复流现象发生的主要病理机制Figure 1 The main pathological mechanisms involved in no-ref low phenomenon
既往存在的微循环损伤会增加心肌易损性,显著降低心肌血运重建后的即刻及长期获益。高危动脉粥样硬化斑块破裂后,富含脂质成分的坏死核心暴露于血液循环中,激活血小板并招募白细胞,导致凝血级联反应和冠状动脉内血栓形成。血栓和斑块内容物脱落会导致远端栓塞,进而引起远端血管阻力增加和局部微梗死的发生,同时促进炎症因子和缩血管物质的释放。在对罪犯血管行介入治疗时,残余血栓脱落会进一步加重MVO。长时间缺血会导致心肌细胞、内皮细胞死亡,间质水肿,一氧化氮生成受损,血管内皮生长因子释放,血管通透性增加,心肌灌注进一步受损。研究表明,再灌注损伤对微循环的影响比缺血损伤本身更大,突然恢复的血流通过白细胞介导氧自由基释放来放大炎症反应,并与冠状动脉长期MVO相关。基因突变或后天获得性因素(如吸烟、高血压病和糖尿病等)都可能会增加患者对微血管功能紊乱和NR的易感性。
最近发表的研究进一步明确了NR的发生机制,Zhao等[12]研究表明血小板激活后会产生大量高迁移率族蛋白B1(high mobility group box 1,HMGB1),而后HMGB1通过Toll样受体4与人微血管内皮细胞(human microvascular endothelial cells,HCMECs)相互作用,诱导促炎和促凝HCMECs表型生成,加速微血管阻塞。Mangold等[13]研究表明,中性粒细胞激活后会将其核内容物释放到细胞外形成中性粒细胞外陷阱,这些细胞外染色质是冠状动脉血栓的重要组成部分并与STEMI患者的MVO高度相关。这提示通过脱氧核糖核酸酶快速降解细胞外染色质可能改善患者的微循环灌注。一项细胞实验的研究结果表明,NR的发生与过度氧化应激引起的内皮细胞损伤有关,缺血或再灌注损伤阶段氧自由基增多会激活应激活化蛋白激酶-动力相关蛋白1信号通路,促进线粒体过度裂变,进而导致内皮细胞死亡,加重微循环功能紊乱[14]。这些发现不仅进一步完善了NR发生的确切机制,更为今后探寻新的防治靶点指明了方向。
3 NR 的预测因素
近年来提出的许多新治疗策略旨在防止NR的发生发展,从而减少心肌损伤,改善患者预后。但不论选择何种防治方式,都需将其临床效益与可能带来的潜在危害相权衡。因此,早期识别PPCI期间NR高风险患者对于改善这部分患者的临床预后至关重要。当前,NR的预测因素可以分为临床预测因素和影像学预测因素两类。
3.1 临床预测因素
一些传统的心血管危险因素已被确定与更高的NR风险相关,如高血压病、吸烟、血脂异常、糖尿病、肾功能不全等[15]。Del Turco等[16]探究了炎症特征和NR现象之间的关系,研究表明老年患者(年龄>65岁)由于其明显的促炎状态,PPCI术后NR发生率更高。此外,最近多种新的生物标志物和临床参数也被证实与PPCI期间NR的发生相关,如外周静脉神经肽-Y、水平生长分化因子-15、血液黏度等[17-22]。
3.2 影像学预测因素
一些冠状动脉造影特征(如血栓分级)与STEMI患者PPCI术后NR的相关性早已得到证实[23]。近年来,腔内影像学的发展为介入医师评估和防治NR提供了许多新的见解。
研究表明较大的脂质坏死核体积是STEMI患者PPCI术后NR的潜在危险因素[24-25]。基于当前明确的NR机制,光学相干断层成像识别的残余血栓负荷和破裂腔体积与STEMI患者PPCI术后NR的相关性值得未来进一步探究,这将有助于明确NR的具体发生机制,优化其防治策略。
对于NR的术前危险分层方法尚缺乏全球共识和建议,未来需要一个结合腔内影像学特征并在前瞻性试验中充分验证性能的NR风险预测模型,以期指导介入医师的临床实践,对明确高危患者,应及时采取适当措施预防NR。
4 NR 的防治
目前NR的主要防治策略仍是冠状动脉内给药,以促进冠状动脉血管舒张,改善微循环灌注。此外,一些非药物治疗方式也在部分试验中有着良好的疗效,如血栓抽吸、远端保护装置、延迟支架置入等。本部分将总结概括目前可用于NR的防治策略及未来可能有益于心肌灌注的方法。
4.1 药物防治
研究显示,相比冠状动脉近段给药,经冠状动脉远段给药对PCI期间NR的防治更为有效[26]。事实上,各种药物的疗效均受给药途径、给药剂量和用药时间等多方面影响,因此,确定各种药物最佳的用药方式至关重要。
4.1.1 血管扩张药物 多种血管扩张药物被证实能够显著降低STEMI患者PPCI术后NR的发生率,改善心肌再灌注。硝普钠是一种非选择性血管扩张剂,在血管平滑肌内代谢产生一氧化氮,进而舒张冠状动脉和微循环。研究显示,冠状动脉内给予硝普钠或尼可地尔可显著降低PPCI期间NR及主要不良心血管事件(major adverse cardiovascular events,MACE)的发生率[27-28]。腺苷是一种多效性的血管扩张剂,由于在MVO的防治方面有着显著的理论优势,一直被广泛应用于临床。然而,一项大型荟萃[29]分析显示PPCI术中使用腺苷可以降低术后血管造影NR的发生率,但未显示出其他临床终点的获益,包括心肌梗死、心力衰竭、MACE和全因死亡。这可能与腺苷极短的半衰期(10~30 s)相关,在这种情况下,即使增加剂量,外源性瞬时注射腺苷可能都无法达到足够的生物利用度来对抗缺血再灌注损伤的病理级联反应。最近,一种新型导丝的出现或将克服这一问题,它能在整个介入过程中源源不断地向靶部位释放高浓度的腺苷,从而在优化药理疗效的同时避免高剂量给药引起的全身效应,发挥腺苷在NR防治中的最佳效益[30]。
4.1.2 抗血小板药物 血小板糖蛋白Ⅱb/Ⅲa抑制剂是一类强效抗血小板药物,其中替罗非班在改善STEMI患者PPCI术后TIMI血流分级和减少心肌再灌注损伤方面的有效性已在大量研究中得到证实[31-32]。但临床上对其给药时间一直存在争议,短时间使用或许不能发挥其改善微循环的作用,长时间给药又可能增加患者的出血风险。最近一项回顾性研究表明,对于PPCI期间发生NR的STEMI患者而言,不论出血风险如何,延长替罗非班给药时间(>24 h)并不能带来更好的临床疗效[33],这一结果表明适当缩短NR患者替罗非班的给药时间是合理的。此外,Zeng等[34]证实冠状动脉内替罗非班联合硝酸甘油比单用替罗非班能更有效地预防NR,并且不增加出血风险。基于现有的证据,最新的血运重建指南指出,对于行PCI的STEMI患者,若血栓负荷大或出现NR时,应考虑使用血小板糖蛋白Ⅱb/Ⅲa抑制剂(推荐类别Ⅱa,证据水平C)[35]。
4.1.3 溶栓药物 近年来,PPCI期间使用低剂量溶栓药物作为一种改善冠状动脉微循环灌注的新策略备受关注。多项研究表明,冠状动脉内溶栓治疗能够在不增加患者出血风险的同时改善STEMI患者心肌微循环灌注,减少MACE发生[36-37]。然而,T-TIME研究[38]显示,对于在症状出现后6 h内行PPCI的STEMI患者,术中冠状动脉内低剂量的阿替普酶并不能改善MVO和临床预后。此外,该研究的亚组分析还发现,对于STEMI缺血时间4~6 h的患者,在PPCI期间给予低剂量冠状动脉内阿替普酶辅助治疗可能会增加心肌出血,加重MVO[39]。因此,目前的证据尚不支持其作为STEMI患者PPCI过程中的常规辅助治疗方式,需要今后进一步验证这一治疗方式的安全性和有效性。相较于冠状动脉内溶栓,超声溶栓能够在降低出血风险的同时提高溶栓效果,在STEMI患者的辅助治疗方面有着更为出色的应用前景。一项随机对照研究[40]的结果显示,PPCI术前或术后行超声溶栓可显著改善血管造影再通率和MVO。基于这一研究发现,有理由相信,超声溶栓有可能成为未来STEMI患者的标准治疗方案之一。
4.1.4 他汀类药物 他汀类药物作为冠心病的一线用药,除降低血脂外,似乎对NR的防治也有着显著益处。STATIN STEMI研究[41]显示,与低剂量阿托伐他汀相比,PCI术前给予大剂量的阿托伐他汀可通过其多效性作用(改善内皮功能、扩张冠状动脉微血管、抗炎和抗血栓等)改善患者的微循环灌注,为接受PPCI的STEMI患者提供更好的临床结果。同样,一项回顾性研究分析表明,首次的高剂量阿托伐他汀可显著降低STEMI患者PPCI术后NR和MACE的发生率[42]。然而,上述研究存在明显的局限性,这些发现需要在更大规模的随机对照试验中进一步证实。
4.1.5 其他药物 (1)冠状动脉内肾上腺素已被广泛用于治疗STEMI患者PPCI术后的难治性无血流,并被证实可显著改善该患者群体的冠状动脉血流及临床预后[43]。此外,COAR研究[44]表明对于血压正常的NR患者,肾上腺素可以作为腺苷的一种安全替代;而对于有低血压或心动过缓的患者,肾上腺素可能是更优的选择。因此,肾上腺素在NR的防治方面大有可为,值得进一步探讨其与其他一线用药的相对疗效。(2)吗啡因其可以缓解STEMI患者的疼痛和焦虑,减少伴随的交感神经兴奋,减轻血管收缩,降低心脏负荷,曾被广泛应用于临床。但随后的研究证实,吗啡在发挥功效的同时会减缓P2Y12受体抑制剂的吸收速度,导致抗血小板药物延迟生效。因此,吗啡在指南中的推荐力度逐渐减弱(2012年为Ⅰ类,C级;2017年为Ⅱa类,C级)。最近一项纳入急性心肌梗死患者的随机对照试验[45]为吗啡的临床应用提供了一些新的见解,研究显示,PPCI术前静脉注射吗啡能够显著降低MVO的发生率和严重程度。这一结果提示血栓导致的远端栓塞可能不是MVO的关键因素或者P2Y12受体抑制剂在防止远端栓塞和MVO中的作用相对较小。尽管这项研究的初步结果是积极的,但其样本量较小,未来有必要在更大规模的临床研究中探究吗啡对心肌的保护作用。
4.2 非药物防治
现有的证据表明相比药物治疗,非药物治疗在NR的预防方面有着更好的效果。因此,鉴于其发生机制多因素的性质,多种防治策略的联合应用可能才是改善患者心肌灌注的最佳选择。
4.2.1 血栓抽吸 对于PPCI过程中常规血栓抽吸的疗效一直饱受争议,但高血栓负荷一直是STEMI患者脑卒中和死亡的危险因素,并与患者的临床预后独立相关[46-47]。对此,有学者认为高血栓负荷可能只是患者高风险的标志,而并非是改善这些患者临床预后的切入点。然而,基于最近一项荟萃分析的结果,尚不能全盘否定血栓抽吸,对于有中高血栓负荷的患者选择性的血栓抽吸可能仍是有益的[48]。当前的挑战是应该如何优化血栓抽吸的设备与操作,以降低这部分患者的脑卒中风险和心血管死亡率。此外,刘金武等[49]的研究显示,与单纯血栓抽吸相比,血栓抽吸联合冠状动脉内溶栓能更有效地改善高血栓负荷的STEMI患者PPCI术后的MVO,先血栓抽吸再溶栓的效果更佳。
4.2.2 栓塞保护装置 栓塞保护装置被设计用来捕获和清除在介入过程中移位的血栓碎片和斑块成分以减少远端栓塞。既往研究显示,PCI术前常规使用栓塞保护装置并不能改善STEMI患者的临床结果。然而,最近的一项研究表明,对于血栓栓塞的高危患者(血管内超声定义的衰减斑块长度≥5 mm)而言,远端栓塞保护装置能够显著降低术中NR和其他不良事件的发生率[50]。这表明术前常规使用栓塞保护装置是不必要的,但在血栓栓塞的高危患者中选择性使用栓塞保护装置可能是有益的。
4.2.3 缺血预处理 缺血预处理是通过重复冠状动脉球囊闭塞和再灌注来减少心肌梗死程度,这曾是改善STEMI患者术后临床结果最有前途的心脏保护策略之一。CONDI-2/ERIC-PPCI研究[51]显示,缺血预处理对行PPCI的STEMI患者12个月时的心肌梗死面积和临床结果的改善并无益处。然而,最近的一项小鼠实验表明缺血预处理可抑制微血管周细胞的收缩和凋亡,减少缺血再灌注损伤,从而降低MVO的发生率[52]。这一发现提示,通过调节周细胞的收缩来保护微循环的具体机制值得进一步研究,这可能成为改善STEMI患者微循环灌注的新靶点。
4.2.4 低温疗法 选择性冠状动脉内低温是一种旨在减少心肌再灌注损伤的新型治疗方法,EURO-ICE研究的中期分析[53]显示,在STEMI患者PPCI期间选择性使用冠状动脉内低温疗法是安全的。但对于该疗法能否减少梗死面积并改善临床预后,需要等待EURO-ICE研究的最终结果来证实[54]。
4.2.5 手术策略 由于现有的防治策略并不能有效改善STEMI患者的临床预后,介入医师试图通过优化手术操作来预防NR。Kumar等[55]研究表明对于高血栓负荷的患者而言,避免在支架置入前进行球囊预扩张可减少NR的发生。DANAMI-3-DEFER试验[56]表明,初始血流恢复后的延迟支架置入(≥24 h)能够降低NR和远端栓塞的发生率,在高龄和冠状动脉完全闭塞或血栓负荷较高的患者中尤其显著。支架置入过程中采用球囊缓慢撤压与常规撤压方法相比,能够明显降低NR的发生率,缩短ST段回落时间[57]。此外,一项随机对照试验表明,在PPCI期间支架置入过程中延长球囊充气可以减少NR的发生,改善STEMI患者的微循环灌注[58]。这些方法具有可靠的理论基础,且操作简便,易于推广,若能在临床实践中得到进一步证实,将对改善STEMI患者的临床预后具有重要意义。
5 总结与展望
近几十年来,随着设备、技术和药物的不断革新,STEMI患者的临床预后得到了显著改善。然而,基于当前临床实际情况,防治PPCI相关NR的发生发展仍是介入医师所面临的重大挑战之一。目前可用于NR的防治策略有很多,需要强调的是,不论选择何种治疗方式,都要将其临床效益与可能带来的潜在危害相权衡。因此,在未来的研究中,应致力于进一步探究NR发生发展的确切机制,明确NR的相关危险因素,加强NR的早期预测,从而精准识别可能从这些疗法中实现最大获益的患者群体。此外,当前的研究一致表明,单一的NR防治策略往往收效甚微,联合应用各种有效策略才能最大程度改善STEMI患者介入治疗后的微循环灌注。
利益冲突 所有作者均声明不存在利益冲突

