IntellaNav MiFi OI导管消融局部阻抗下降与心肌损伤范围相关性研究
丁建 李赛男 金震 张洁 张诗蓓 左中印 刘子辰 丁明英 梁明 孙鸣宇 王祖禄
射频消融术是一种始于20世纪80年代的治疗心律失常的技术,利用低电压高频(30 kHz~1.5 MHz)电能,在导管头端和局部心肌组织间转换成热能,使局部心肌组织升温、变性、凝固坏死,改变组织自律性和传导性,从而根治心律失常。射频消融治疗心律失常的有效性和安全性受消融损伤的影响,过小的消融损伤可能导致消融失败或术后复发,过大的消融损伤可能导致心脏穿孔、心脏破裂及邻近组织损伤等,因此在消融过程中监测和控制组织损伤至关重要[1]。临床消融实践中监测阻抗变化可反映组织加热和提示发生气爆和焦痂等组织过热事件风险[2-5]。然而既往使用的阻抗常为射频消融仪阻抗(GI),是整个环路中的阻抗,不能单纯反映导管-组织交界面局部的阻抗情况[6]。一种新型的导管(IntellaNav MiFi OI)可借助导管尖端3个微电极与近端环状电极间形成的局部电场,测得导管头端局部阻抗(local impedance,LI)[7]。本研究利用微电极导管进行LI指导消融,旨在探究LI下降与消融损伤之间的关系。
1 材料与方法
1.1 体外实验模型
本实验选用10只新鲜离体猪心,均为实验当天购自沈阳市屠宰场。用手术刀沿左心室前壁和后壁与间隔连接处自二尖瓣环至心尖切开左心室,获取左心室游离壁心肌组织。将游离的心肌组织置于盛有0.45%氯化钠溶液的方形水槽中,使其完全浸没,用水浴加热器保持溶液温度为37℃。将方形水槽放置于最小量程0.5 g的电子秤上,用于记录实验过程中的压力变化。连接背部电极、射频消融仪、超高密度标测系统(Rhythmia HDx,Boston Scientific)和消融导管(IntellaNav MiFi OI,Boston Scientific),将背部电极及导管头端完全浸入溶液中,确保环路连接正常。采用盐水灌注模式,使用灌注泵调整消融时灌注速度为17 ml/min。分别在30 W、40 W、50 W功率下进行消融,至下降15 Ω、20 Ω、25 Ω、30 Ω时终止放电。每次消融前使导管离开心肌组织后进行电子称清零,然后将导管垂直贴靠于左心室心外膜表面,施加压力使消融过程中电子秤读数维持在(10±2)g范围。记录消融前后LI和GI数值及消融时间。实验装置示意图见图1A。
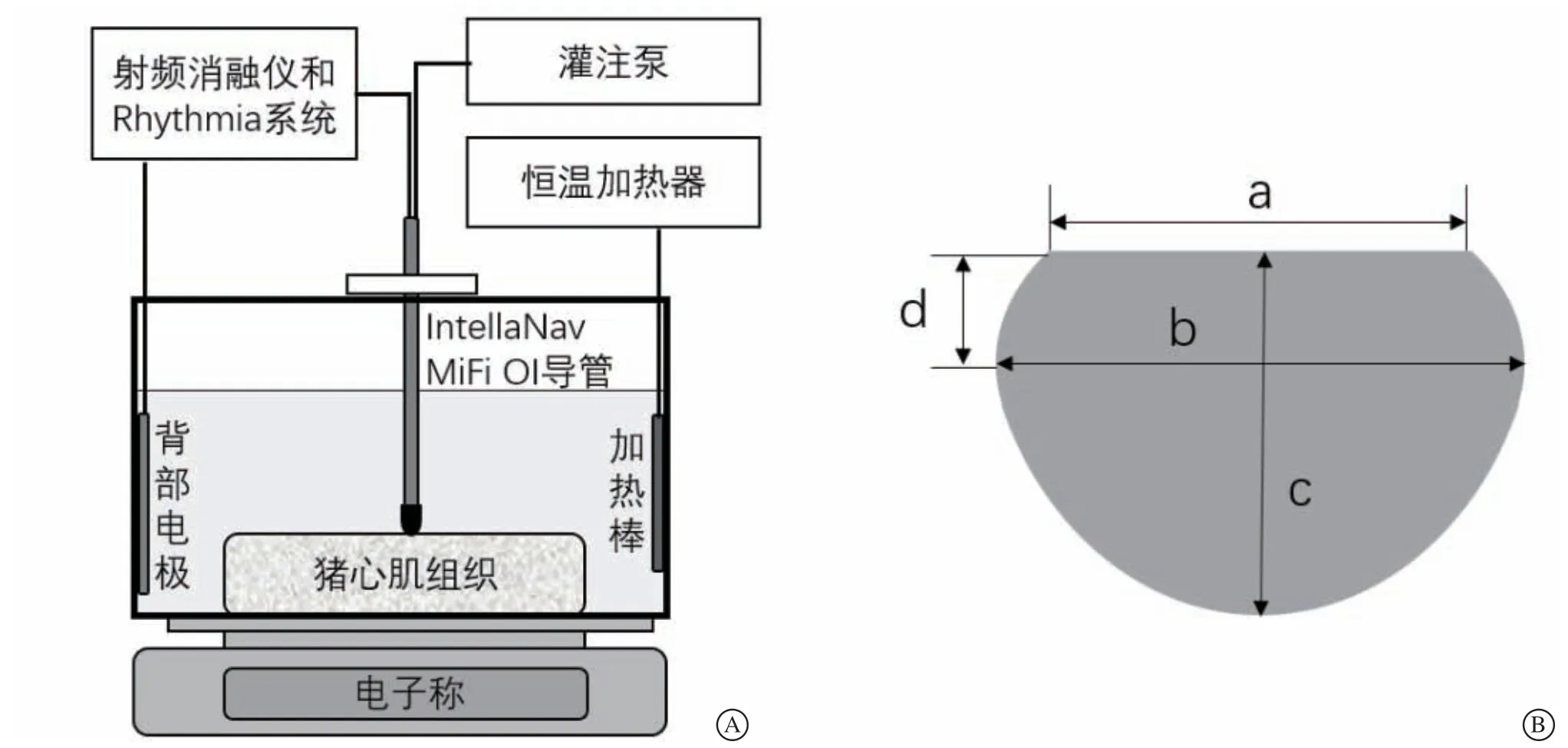
图1 实验装置及消融损伤测量示意 A.实验装置示意图;B.消融损伤测量示意(a 为表面损伤宽度,b 为最大损伤宽度,c 为最大损伤深度,d 为最大损伤宽度处的深度)Figure 1 Schematic diagram of the experimental model and the ablation lesion dimension
1.2 LI和GI
IntellaNav MiFi OI导管头端侧壁距顶点2.0 mm处有3个微电极,微电极通过发放非刺激交流电(5.0 μA,14.5 kHz)与近端环状电极间形成局部电场,通过测量电压值进而得出LI。3个微电极测得的最大LI作为系统显示的LI值。GI是射频仪通过导管尖端和背部电极间发放的交流电所测得的整个环路中电阻。消融前LI和GI为射频能量发放前导管以10 g压力接触心肌组织时Rhythmia HDx系统和射频仪分别记录的阻抗值,消融后LI和GI为终止放电即刻记录的相应阻抗值。
1.3 消融损伤范围测量
剔除消融过程中出现导管移位、压力变化过大的异常消融点,将剩余有效消融点进行消融损伤范围测量。左心室心外膜表面测得的最大消融损伤直径为表面损伤宽度。然后沿最大消融直径垂直切开,于横截面测量的组织损伤最大横向距离为最大损伤宽度,组织表面至损伤最低点的垂直距离为最大损伤深度,组织消融损伤的最大宽度处做一水平线,该水平线至与组织表面的垂直距离为最大宽度处的深度。消融损伤测量示意图见图1B。
1.4 统计学分析
采用SPSS 26.0软件进行统计学处理和分析。连续性变量用均数±标准差表示,多组间比较采用单因素方差分析,组间两两比较采用Bonferroni法。两连续变量间的相关性若服从正态分布则采用Pearson相关分析,若不符合正态分布则使用Spearman相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 预期LI下降与组织损伤范围
总共进行了115次LI指导下射频消融,预期LI下降15 Ω、20 Ω、25 Ω、30 Ω组各进行了32、27、30、26次消融,各组阻抗相关参数及消融损伤范围见表1。四个不同预期LI下降组消融损伤的表面损伤宽度、最大损伤宽度、最大损伤深度、最大宽度处的深度均存在显著差异,预期LI下降30 Ω组表面损伤宽度、最大损伤宽度、最大损伤深度、最大宽度处的深度均最大,预期LI下降15 Ω组表面损伤宽度、最大损伤宽度、最大损伤深度、最大宽度处的深度均最小,损伤范围随着各组预期LI下降幅度的增加呈现增长趋势,其中最大损伤深度的增长趋势最明显(图2~3)。
表1 不同预期LI 下降组阻抗相关参数及消融损伤范围比较(±s)Table 1 Ablative parameter and lesion dimension among groups of diff erent LI drops(x±s)
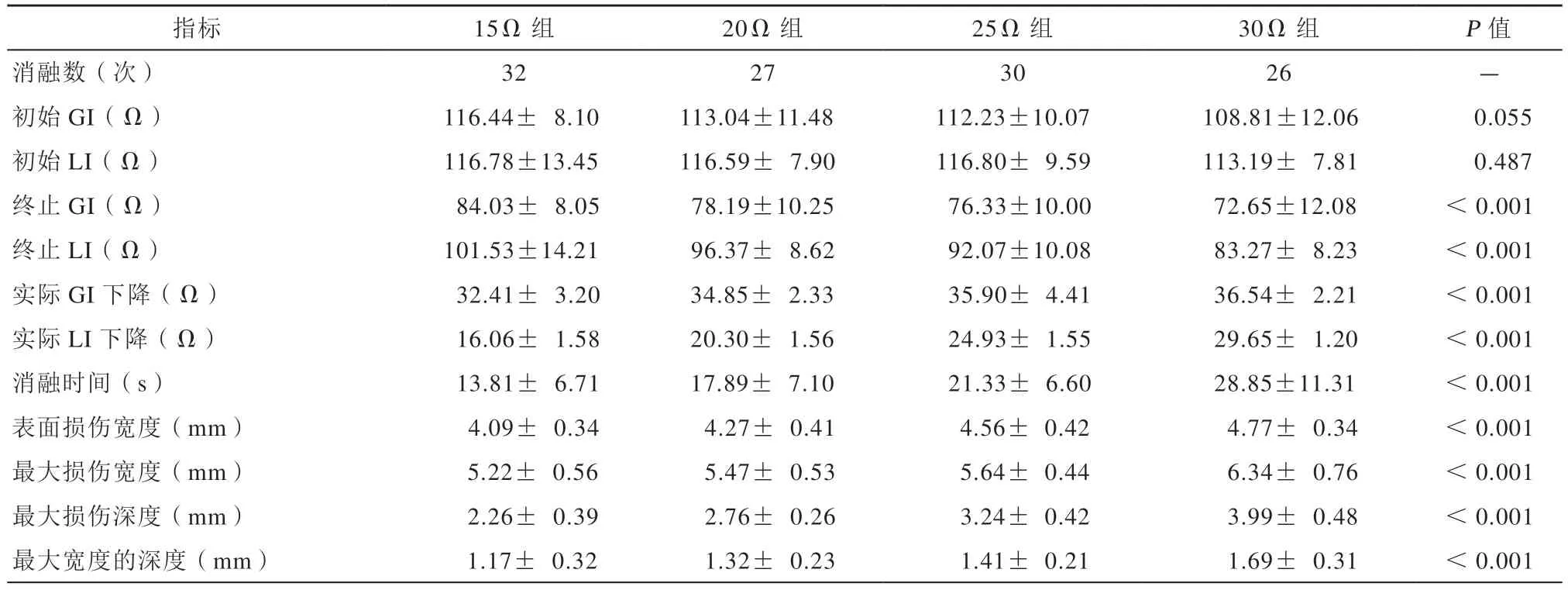
表1 不同预期LI 下降组阻抗相关参数及消融损伤范围比较(±s)Table 1 Ablative parameter and lesion dimension among groups of diff erent LI drops(x±s)
注:GI,射频消融仪阻抗;LI,局部阻抗。
指标 15Ω 组 20Ω 组 25Ω 组 30Ω 组 P 值消融数(次)32 27 30 26-初始GI(Ω)116.44± 8.10 113.04±11.48 112.23±10.07 108.81±12.06 0.055初始LI(Ω)116.78±13.45 116.59± 7.90 116.80± 9.59 113.19± 7.81 0.487终止GI(Ω)84.03± 8.05 78.19±10.25 76.33±10.00 72.65±12.08 <0.001终止LI(Ω)101.53±14.21 96.37± 8.62 92.07±10.08 83.27± 8.23 <0.001实际GI 下降(Ω)32.41± 3.20 34.85± 2.33 35.90± 4.41 36.54± 2.21 <0.001实际LI 下降(Ω)16.06± 1.58 20.30± 1.56 24.93± 1.55 29.65± 1.20 <0.001消融时间(s)13.81± 6.71 17.89± 7.10 21.33± 6.60 28.85±11.31 <0.001表面损伤宽度(mm)4.09± 0.34 4.27± 0.41 4.56± 0.42 4.77± 0.34 <0.001最大损伤宽度(mm)5.22± 0.56 5.47± 0.53 5.64± 0.44 6.34± 0.76 <0.001最大损伤深度(mm)2.26± 0.39 2.76± 0.26 3.24± 0.42 3.99± 0.48 <0.001最大宽度的深度(mm)1.17± 0.32 1.32± 0.23 1.41± 0.21 1.69± 0.31 <0.001
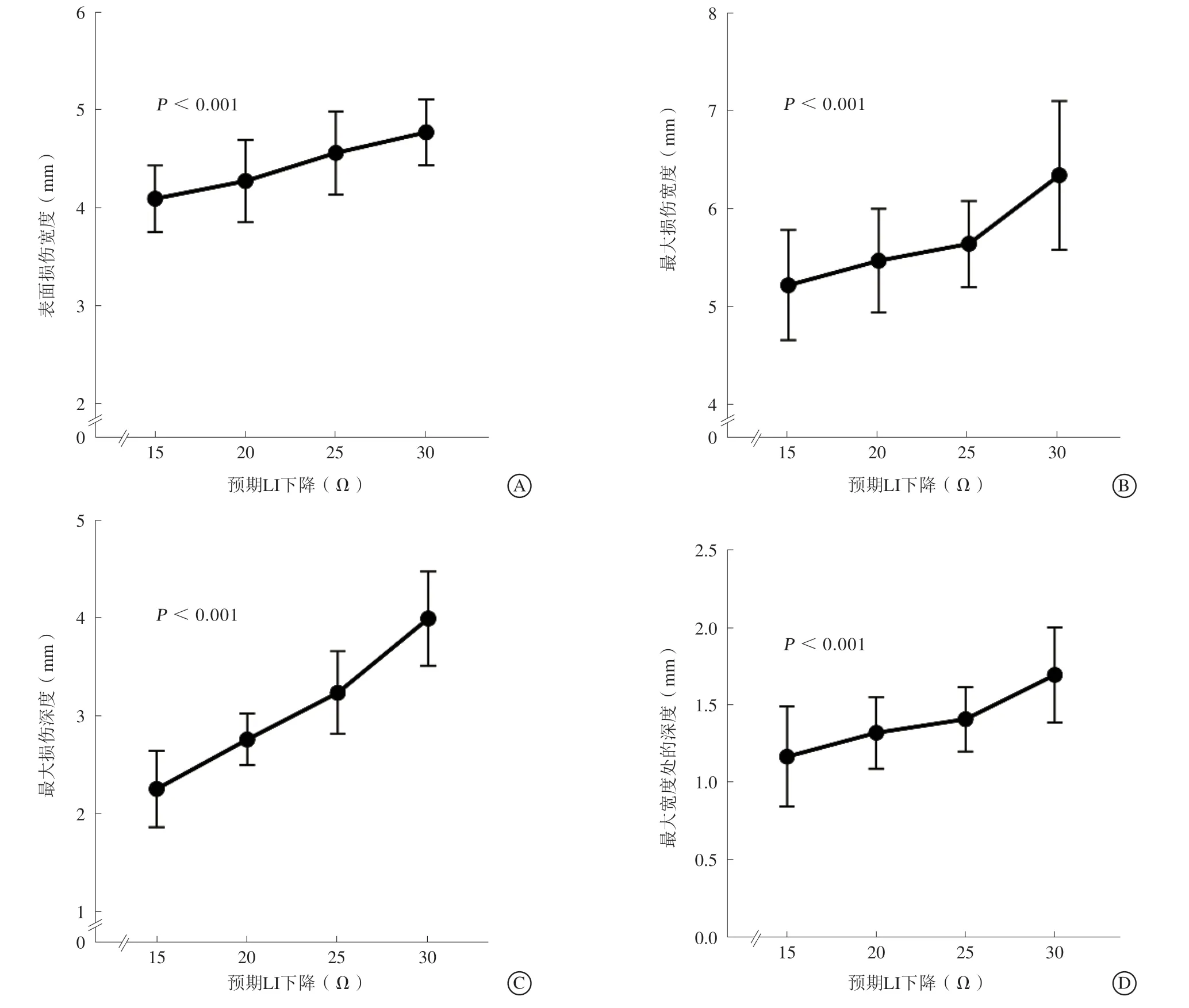
图2 不同预期LI 下降组损伤范围变化趋势 A.表面损伤宽度;B.最大损伤宽度;C.最大损伤深度;D.最大宽度处的深度Figure 2 Variation tendency of ablative lesion dimension along with the increase of LI drop
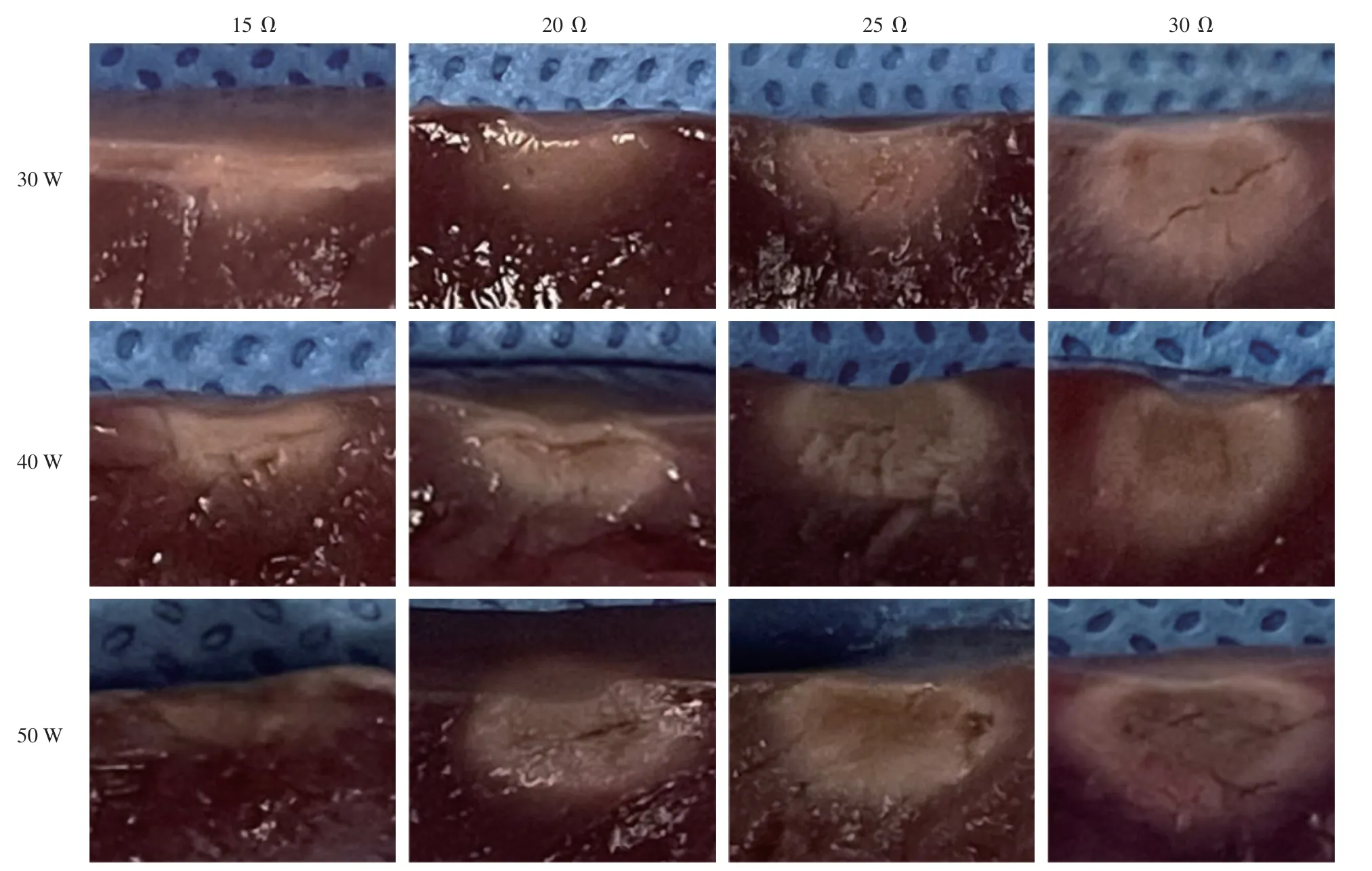
图3 不同功率下,各预期局部阻抗下降组的消融损伤范围实物Figure 3 Ablative lesion dimensions under diff erent power and LI drops
2.2 实际阻抗下降与消融损伤范围相关性
对所有消融点的实际LI下降与消融损伤范围之间的相关性进一步分析显示,实际LI下降与组织消融损伤的表面损伤宽度、最大损伤宽度、最大损伤深度、最大宽度处的深度存在正相关关系(r=0.594,P<0.001;r=0.544,P<0.001;r=0.852,P<0.001;r=0.508,P<0.001),其中与最大损伤深度相关性最强(图4)。而分析所有消融点的实际GI下降与消融损伤范围间的相关性显示,GI下降与消融损伤的表面损伤宽度、最大损伤宽度、最大损伤深度、最大宽度处的深度间不存在相关性或仅存在弱相关性(r=0.124,P=0.186;r=0.222,P=0.017;r=0.360,P<0.001;r=0.203,P=0.029),其中与消融的最大损伤深度间相关性相对更强(图5)。
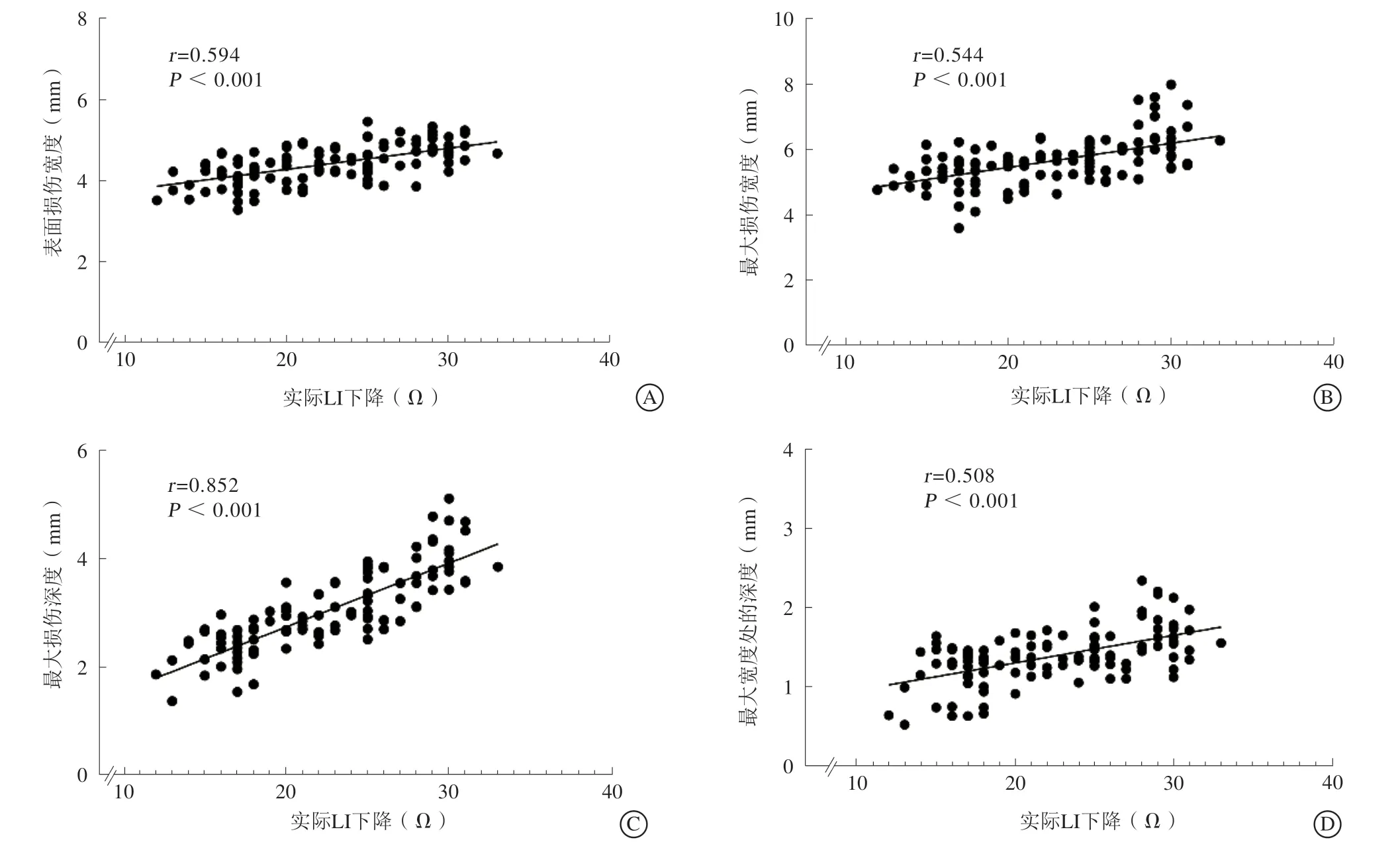
图4 LI 下降实际值与损伤范围 A.表面损伤宽度;B.最大损伤宽度;C.最大损伤深度;D.最大宽度处的深度Figure 4 Correlation between actual LI drop and ablative lesion dimension
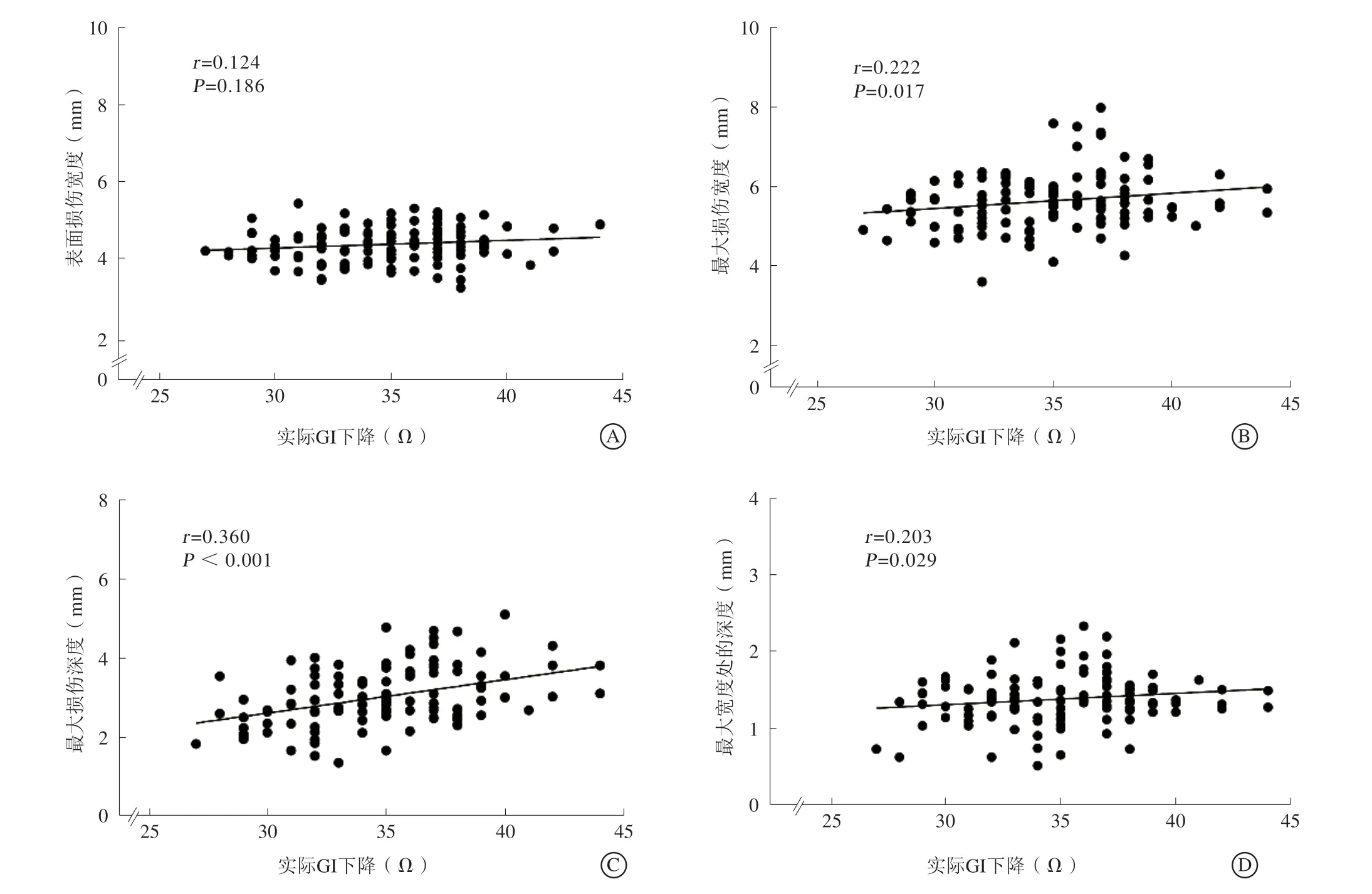
图5 GI 下降与消融损伤范围的相关性分析 A.表面损伤宽度;B.最大损伤宽度;C.最大损伤深度;D.最大宽度处的深度Figure 5 Correlation between GI drop and ablative lesion dimension
2.3 LI下降恒定时功率对消融损伤范围和消融时间的影响
在预期LI下降15 Ω、20 Ω、25 Ω、30 Ω的各组中,30 W、40 W、50 W消融时的消融损伤表面损伤宽度、最大损伤宽度、最大损伤深度、最大宽度处的深度差异均无统计学意义(均P>0.05;)而消融所需的时间差异均有统计学意义(均P<0.001),30 W消融组消融所需时间最长,而50 W消融组消融所需时间最短(表2)。
表2 不同预期LI 下降组不同功率消融的消融损伤范围及消融时间(±s)Table 2 Ablative lesion dimension and ablation duration of diff erent target LI drops in diff erent power groups(±s)
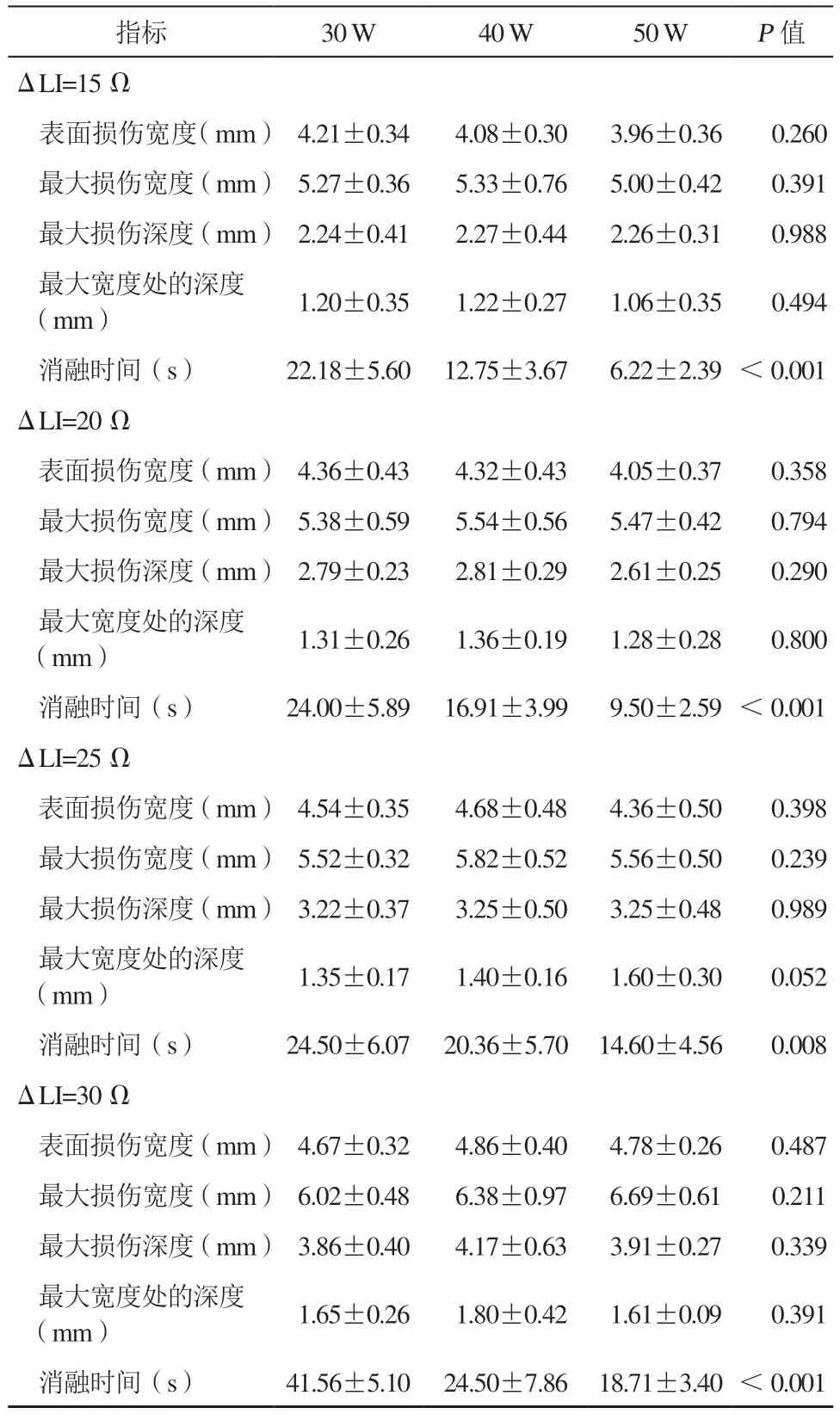
表2 不同预期LI 下降组不同功率消融的消融损伤范围及消融时间(±s)Table 2 Ablative lesion dimension and ablation duration of diff erent target LI drops in diff erent power groups(±s)
注:LI,局部阻抗。
指标 30 W 40 W 50 W P 值ΔLI=15 Ω表面损伤宽度(mm)4.21±0.34 4.08±0.30 3.96±0.36 0.260最大损伤宽度(mm)5.27±0.36 5.33±0.76 5.00±0.42 0.391最大损伤深度(mm)2.24±0.41 2.27±0.44 2.26±0.31 0.988最大宽度处的深度(mm)1.20±0.35 1.22±0.27 1.06±0.35 0.494消融时间(s)22.18±5.60 12.75±3.67 6.22±2.39 <0.001 ΔLI=20 Ω表面损伤宽度(mm)4.36±0.43 4.32±0.43 4.05±0.37 0.358最大损伤宽度(mm)5.38±0.59 5.54±0.56 5.47±0.42 0.794最大损伤深度(mm)2.79±0.23 2.81±0.29 2.61±0.25 0.290最大宽度处的深度(mm)1.31±0.26 1.36±0.19 1.28±0.28 0.800消融时间(s)24.00±5.89 16.91±3.99 9.50±2.59 <0.001 ΔLI=25 Ω表面损伤宽度(mm)4.54±0.35 4.68±0.48 4.36±0.50 0.398最大损伤宽度(mm)5.52±0.32 5.82±0.52 5.56±0.50 0.239最大损伤深度(mm)3.22±0.37 3.25±0.50 3.25±0.48 0.989最大宽度处的深度(mm)1.35±0.17 1.40±0.16 1.60±0.30 0.052消融时间(s)24.50±6.07 20.36±5.70 14.60±4.56 0.008 ΔLI=30 Ω表面损伤宽度(mm)4.67±0.32 4.86±0.40 4.78±0.26 0.487最大损伤宽度(mm)6.02±0.48 6.38±0.97 6.69±0.61 0.211最大损伤深度(mm)3.86±0.40 4.17±0.63 3.91±0.27 0.339最大宽度处的深度(mm)1.65±0.26 1.80±0.42 1.61±0.09 0.391消融时间(s)41.56±5.10 24.50±7.86 18.71±3.40 <0.001
3 讨论
本研究应用IntellaNav MiFi OI微阻抗消融导管进行不同LI下降情况下消融损伤范围的比较,探讨了LI下降与消融损伤之间的关系。研究中发现:(1)LI下降与消融损伤的表面损伤宽度、最大损伤宽度、最大损伤深度、最大宽度处的深度具有正相关关系,且与最大损伤深度的相关性最强;(2)GI与消融损伤范围的相关性很弱;(3)LI下降恒定时,功率不影响消融损伤范围,但是提高功率可以缩短消融放电时间。
射频消融利用导管头端发放射频电流在组织产生阻抗热,并向深部组织传导,造成心肌的凝固性坏死和局部损伤形成,使局部心肌组织失去电激动和电传导能力,从而治疗心律失常[8]。随着射频放电过程中组织温度升高,组织中的离子被加热而运动增强,导致电流的阻抗降低[9]。因此射频消融导致的阻抗下降可以作为组织加热的一个实时标志[5]。然而临床消融中监测的阻抗常为GI,反映整个环路中包括射频仪、传输线、导管、电极-组织界面、分散电极-皮肤界面、两电极间组织等部位的阻抗,受到的干扰因素多,有时并不能准确地反映消融组织局部的阻抗变化。不同于GI,IntellaNav MiFi OI导管通过头端3个微电极与近端环状电极间形成局部电场,可准确地测量导管头端LI值,避免了环路中其他部位阻抗形成的干扰。本研究通过分析LI下降与消融损伤范围之间的关系,发现LI下降与消融损伤范围间存在正相关性,且与消融损伤深度间的相关性最强,而GI与消融损伤范围间相关性很弱,与既往研究发现一致[7,10-13]。鉴于LI相比GI与消融损伤范围间有更强的相关性,LI可更好地预测消融损伤程度,指导进行安全、有效的消融。一些研究探索了使用IntellaNav MiFi OI导管进行LI指导射频消融在临床心律失常治疗中的效果[14-18]。Solimene等[14]分析了153例使用IntellaNav MiFi OI导管进行LI指导心房颤动消融患者的消融LI下降情况和消融结局,发现LI下降幅度与组织损伤形成的有效性相关,成功消融部位的阻抗下降幅度显著高于无效消融部位。153例患者中均未出现消融相关的主要不良事件,且超过88%的患者术后1年无复发,证实了IntellaNav MiFi OI导管LI指导下心房颤动消融的安全性和有效性。Münkler等[15]对28例室性心动过速复发接受再次消融的患者也进行了类似的研究,发现消融终止室性心动过速部位的LI下降值和下降百分比均显著高于消融非终止室性心动过速部位,而GI的下降值和下降百分比差异均无统计学意义,此外,还发现相比健康心肌,瘢痕心肌的LI更低,且非缺血性心肌病患者的成功消融点的LI下降值高于缺血性心肌病患者。说明LI不仅可以反映消融损伤的程度,还可以反映不同组织特性,在应用LI指导消融时应考虑心肌组织的潜在基质[10,15-16,19]。
一些研究进一步探索了LI指导消融的有效性及安全性界值。在50例接受三尖瓣峡部线性消融的患者中,LI下降12 Ω及LI下降11.6%可以预测有效消融损伤[17]。在心房颤动患者中LI下降超过15 Ω可以提示有效消融损伤,此外LI下降/消融时间也可以很好地预测成功消融损伤,其界值为0.65 Ω/s[14]。根据左心房心肌厚度的差异,LOCALIZE研究[20]对心房颤动消融进行了更加细致的分析,发现LI下降16.1 Ω可预测左心房前壁/顶壁消融阻滞,阳性预测值为96.3%;LI下降12.3 Ω可以预测左心房后壁/下壁传导阻滞,阳性预测值为98.1%。针对LI指导消融的安全性,有研究提示LI下降超过46 Ω时气爆的发生率高,另有研究认为消融过程中避免气爆发生的LI下降幅度上限应定为30 Ω[7,14]。目前不同研究得出的消融过程中LI下降幅度的安全上限存在较大差异,未来需要更多的研究在这一方面进一步地探索,以指导临床中通过监测LI变化进行更安全有效的消融。
此外,本研究还发现LI下降与消融损伤范围间的关系不受功率影响。LI下降幅度恒定时,不同功率下损伤范围无显著差异,而仅影响了消融所需时间,即高功率达到特定LI下降幅度所需的消融时间更短,低功率达到特定LI下降幅度所需消融时间更长。Osei等[11]在动物实验中也比较了LI指导下标准功率(30 W)和高功率(50 W)时环肺静脉消融的安全性和有效性,证明了LI指导消融时两种功率水平下的消融有效性和安全性差异均无统计学意义,但是高功率组更易实现较大的阻抗下降,并且可减少放电时间。然而Kawano等[7]发现在50 W功率设置下进行LI指导的消融,气爆的发生率显著高于30 W和40 W。因此,尽管LI下降幅度恒定时,功率不会显著影响消融损伤范围,但在临床实践中应考虑到功率对消融时间以及气爆等安全性事件的影响。
综上所述,LI下降与消融损伤范围正相关,其中与消融最大损伤深度的相关性最强。GI下降与消融损伤范围之间相关性很弱。消融功率不影响LI下降与消融损伤范围之间的关系,但是升高功率可以缩短达到特定LI下降值的消融时长。
本研究存在一些局限性。首先,本研究利用的是离体猪心消融模型,与临床中实际的消融情景存在差异,并不能完全真实地反映临床中消融损伤结果。其次,本研究仅对消融心肌损伤的范围进行了研究,但并没有针对一些焦痂、气爆等安全性指标进行探索,因此未来需要针对LI指导消融的安全性开展进一步研究。
利益冲突所有作者均声明不存在利益冲突

