白藜芦醇对糖尿病大鼠晶状体混浊的防治作用及其机制
葛晓芳 朱大强 刘亚东 罗纳丽
郑州大学第二附属医院眼科,郑州 450000
糖尿病性白内障是一种常见的代谢性白内障,在糖尿病眼病患者中发生率仅次于视网膜病变,且具有较高致盲率[1-2]。糖尿病性白内障发生和发展过程中,氧化应激所致细胞外基质聚集发挥重要作用,可诱导晶状体上皮细胞(lens epithelial cells,LECs)凋亡,造成晶状体混浊[3-4]。白藜芦醇是一种非黄酮类多酚化合物,属于抗氧化剂,通过抑制体内过量自由基,激活机体抗氧化酶系统,发挥抗氧化作用。研究发现,白藜芦醇能抑制PM2.5诱导的细胞内活性氧生成及细胞凋亡[5],推测其在抑制细胞氧化应激和细胞凋亡中发挥重要作用。还有报道显示,白藜芦醇可抑制高糖环境下的视网膜细胞凋亡,但作用机制尚不明确[6]。目前,关于白藜芦醇是否能够防治糖尿病性白内障的相关研究较少。本研究拟探讨白藜芦醇对糖尿病大鼠晶状体混浊的防治作用及其机制。
1 材料与方法
1.1 材料
1.1.1实验动物 选取50只8周龄SPF级健康雄性SD大鼠,体质量300~320 g,均购自中国医药研究开发中心有限公司[许可证号:SYXK(京)2019-0051]。实验前经托吡卡胺滴眼液扩瞳、裂隙灯显微镜检查显示晶状体透明,尾静脉采血检测血糖<6.7 mmol/L。适应性饲养7 d,常规饲料,自由饮水,12 h/12 h昼夜周期照明,温度22~24 ℃,湿度为55%。实验动物使用和喂养遵循“3R”原则。本研究经郑州大学实验动物伦理委员会审核批准(批文号:IACYC2019-02)。
1.1.2主要试剂及仪器 白藜芦醇(纯度>99%)、链脲佐菌素(streptozotoein,STZ)(纯度>98%)(美国Sigma公司);格列齐特(天津华津制药有限公司);托吡卡胺滴眼液(武汉五景药业有限公司);BCA试剂盒;BCA试剂盒(美国BioVision公司);兔抗大鼠核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)、兔抗大鼠血红素氧合酶1(heme oxygenase-1,HO-1)抗体、山羊抗兔二抗IgG(北京博奥森生物技术有限公司);过氧化物歧化酶1(superoxide dismutase 1,SOD1)、SOD2、SOD3、谷胱甘肽过氧化物酶1(glutathione peroxidase 1,GPX1)酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)试剂盒(上海雅吉生物科技有限公司);空腹胰岛素ELISA试剂盒(上海邦景实业有限公司);苏木精-伊红染色试剂盒(上海迈基生物技术有限公司)。SLICPS 2000型裂隙灯显微镜图像分析系统(中国中医研究院眼科医院、苏州医疗器械总厂);Multiskan型酶标仪(美国赛默飞世尔公司);GelDoc 2000凝胶成像系统(美国Bio-Rad公司);Mias-2000真彩色病理显微图像分析系统(成都川大智胜软件股份有限公司)。
1.2 方法
1.2.1实验动物分组及干预 采用随机体重排序法将大鼠分为空白对照组、模型组、格列齐特组、低剂量白藜芦醇组和高剂量白藜芦醇组,每组各10只。其中模型组、格列齐特组、低剂量白藜芦醇组和高剂量白藜芦醇组均建立大鼠糖尿病性白内障模型;建模成功后第3天开始给药,空白对照组和模型组以生理盐水灌胃,格列齐特组以2 mg/(kg·d)格列齐特混悬液灌胃,低、高剂量白藜芦醇组分别以20 mg/(kg·d)、40 mg/(kg·d)白藜芦醇灌胃,给药量均为10 ml/kg,1次/d,连续4周。用药期间动物自由饮水、进食,不给予胰岛素及其他降糖药物。给药结束后第2天进行后续实验。
1.2.2大鼠糖尿病性白内障模型的制备 以0.1 mmol/L无菌枸橼酸钠缓冲液(4 ℃,pH 4.2)将STZ配备成质量分数2%溶液,大鼠禁食12 h,以2% STZ溶液60 mg/kg一次性腹腔内注射[7]。建模成功标准:造模后3 d,大鼠晶状体混浊程度为早期、中期,尾静脉血检测血糖≥16.7 mmol/L。剔除不符合标准大鼠,造模成功36只,每组各9只。
1.2.3大鼠空腹血糖浓度测定 大鼠禁食12 h,取3 ml大鼠尾静脉血,滴在血糖试纸上,准确反应5 s,采用血糖仪比色、记录,检测空腹血糖浓度。
1.2.4ELISA法检测大鼠空腹血清胰岛素水平 取30 μl大鼠腹主动脉血,室温下静置2~4 h。4 ℃条件下,离心半径10 cm,12 000 r/min离心10 min,取上清液。按照空腹胰岛素ELISA试剂盒使用说明书检测。分别将5 μl标准品、待测样品加入各孔,室温下振荡1 min。各孔分别加入45 μl一抗工作液,封闭,室温下振荡2 h,4 ℃过夜;洗涤液清洗,滤纸上印干,反复6次。各孔分别加入100 μl酶标抗体工作液,封闭,37 ℃干燥箱内干燥10 min;洗涤液清洗,滤纸上印干,反复6次。各孔分别加入100 μl底物工作液,37 ℃干燥箱暗处反应15 min。各孔分别加入100 μl终止液,反应10 min,在20 min内观察酶标仪450 nm处各孔吸光度(absorbance,A)值。以A值为纵坐标,以标准液浓度为横坐标,创建浓度标准曲线,按照A值计算样本浓度。
1.2.5ELISA法检测血清氧化应激反应因子SOD1、SOD2、SOD3、GPX1含量 完成空腹血糖检测后,取30 μl大鼠腹主动脉血,室温下静置2~4 h。4 ℃条件下,离心半径6 cm,3 500 r/min离心15 min,取上清液。严格按照SOD1、SOD2、SOD3、GPX1试剂盒使用说明书操作。分别设空白孔、标准孔、待测样品孔。酶标包被板上加50 μl标准品,先后将40 μl样品稀释液、10 μl待测样品加入待测样品孔,混匀,封板膜封闭,37 ℃温育30 min。揭开封板膜,弃去液体,甩干,洗涤液洗涤,重复5次,拍干;除空白孔外,各孔均分别加入50 μl酶标试剂,封板膜封闭,37 ℃温育30 min。揭开封板膜,弃去液体,甩干,洗涤液洗涤,重复5次,拍干;各孔依次加入显色剂A 50 μl、显色剂B 50 μl,振荡混匀,37 ℃避光显色,共15 min。各孔加入50 μl终止液,反应10 min,在20 min内检测酶标仪450 nm波长处A值。以A值为纵坐标,以标准误的浓度为横坐标创建标准曲线,按照样品A值计算样本浓度。
1.2.6晶状体混浊程度检测及分期 分别在治疗前(建模成功后)、治疗后采用托吡卡胺滴眼液点眼扩瞳,质量分数2%戊巴比妥钠50 mg/kg(0.25 ml/100 g)腹腔内注射麻醉,采用裂隙灯显微镜图像分析系统分析大鼠晶状体混浊程度,裂隙宽度为0.2 mm,光带摄入角度为35°,放大30倍。每隔2周检测1次,共8周。晶状体混浊分期标准[8]:晶状体透明为0期;晶状体瞳孔区透明,周边皮质存在少量囊泡为Ⅰ期;晶状体周边皮质囊泡增多、融合,少量扩展到瞳孔区皮质,核区发生轻度絮状混浊为Ⅱ期;晶状体瞳孔区皮质出现大量囊泡,核混浊区加重为Ⅲ期;晶状体完全混浊为Ⅳ期。0期为正常,Ⅰ期为早期白内障,Ⅱ期为中期白内障,Ⅲ期为成熟期白内障,Ⅳ期为过熟期白内障。同时在治疗后24 h进行眼前节照相,以裂隙灯显微镜弥散光照明法检查,获得清晰图像后拍照。
1.2.7获取晶状体组织 各组大鼠完成以上检测后均以断颈法处死,摘取右侧眼球,去除悬韧带和玻璃体,获取晶状体组织,沿中轴平分为3份,其中1份置于液氮保存,以备检测蛋白表达;另2份置于质量分数4%多聚甲醛中固定,以备检测晶状体细胞形态、上皮细胞凋亡。每份晶状体组织所含样本量均包括空白对照组10只及模型组、格列齐特组、低剂量白藜芦醇组、高剂量白藜芦醇组各9只。
1.2.8苏木精-伊红染色法观察晶状体细胞形态 取1份4%多聚甲醛中固定的晶状体组织,流水冲洗,常规梯度乙醇脱水,二甲苯透明,石蜡包埋,4 μm厚切片,置于载玻片上。脱蜡,行苏木精-伊红染色,二甲苯透明,中性树胶封片。光学显微镜下观察,200倍视野下各标本随机选取5个视野,采用病理显微图像分析系统对大鼠晶状体细胞进行形态学分析。
1.2.9TUNEL法测定LECs凋亡 取1份4%多聚甲醛中固定的晶状体组织,石蜡包埋,5 μm厚切片。严格按照TUNEL试剂盒使用说明书进行操作,对大鼠LECs凋亡情况进行检测。光学显微镜下观察,200倍视野下随机选择4个视野计数凋亡细胞数及全部细胞数。凋亡细胞核呈棕黄色染色,细胞凋亡率=凋亡细胞数/总细胞数×100%。
1.2.10Western blot法测定晶状体中Nrf2、HO-1蛋白相对表达量 取1份液氮保存的晶状体组织,置于1~2 ml匀浆器,组织块以剪刀剪碎,裂解30 min。4 ℃条件下,离心半径7 cm,12 000 r/min离心5 min,取上清液。BCA试剂盒内A液、B液按照50∶1混合,37 ℃避光孵育30 min,检测蛋白浓度。加入5倍蛋白上样缓冲液,沸水浴10 min变性。质量分数10%聚丙烯酰胺凝胶电泳,转印到PVDF微孔膜,室温下置于脱脂牛奶中在摇床上封闭2 h。兔抗大鼠Nrf2、HO-1一抗(1∶1 000)以封闭液稀释,PVDF膜浸泡在一抗孵育液内,4 ℃孵育过夜。加入山羊抗兔二抗IgG(1∶5 000),37 ℃条件下摇床孵育2 h。采用TBST洗涤PVDF膜,晾干、ECL显色、扫描胶片,采用Band-Scan软件分析灰度值,以β-actin作为内参。目标蛋白相对表达量=目标蛋白条带灰度值/β-actin蛋白条带灰度值。
1.3 统计学方法
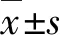
2 结果
2.1 各组大鼠空腹血糖浓度及空腹胰岛素水平比较
空白对照组、模型组、格列齐特组、低剂量白藜芦醇组、高剂量白藜芦醇组大鼠空腹血糖浓度及空腹胰岛素水平总体比较,差异均有统计学意义(F=148.731、134.154,均P<0.001)。与模型组比较,空白对照组、格列齐特组、低剂量白藜芦醇组、高剂量白藜芦醇组空腹血糖、空腹胰岛素水平降低,差异均有统计学意义(均P<0.05);与格列齐特组比较,低剂量白藜芦醇组空腹血糖、空腹胰岛素水平升高,差异均有统计学意义(均P<0.05);与低剂量白藜芦醇组比较,高剂量白藜芦醇组空腹血糖、空腹胰岛素水平降低,差异均有统计学意义(均P<0.05);格列齐特组与高剂量白藜芦醇组比较差异均无统计学意义(均P>0.05)(表1)。

表1 各组大鼠空腹血糖、空腹胰岛素水平比较(x±s)Table 1 Comparison of fasting blood glucose and fasting insulin levels of rats among different groups (x±s)组别样本量空腹血糖(mmol/L)空腹胰岛素[mmol/(L·min)]空白对照组105.52±1.0222.05±2.26模型组918.25±1.51a44.01±2.32a格列齐特组9 7.96±1.05ab 25.05±2.62ab低剂量白藜芦醇组910.02±1.35abc35.15±2.55abc高剂量白藜芦醇组98.08±1.11abd26.14±2.01abdF值148.731134.154P值<0.001<0.001 注:与空白对照组比较,aP<0.05;与模型组比较,bP<0.05;与格列齐特组比较,cP<0.05;与低剂量白藜芦醇组比较,dP<0.05(单因素方差分析,LSD-t检验) Note:Compared with blank control group,aP<0.05;compared with model group,bP<0.05;compared with gliclazide group,cP<0.05;compared with low-dose resveratrol group,dP<0.05 (One-way ANOVA,LSD-t test)
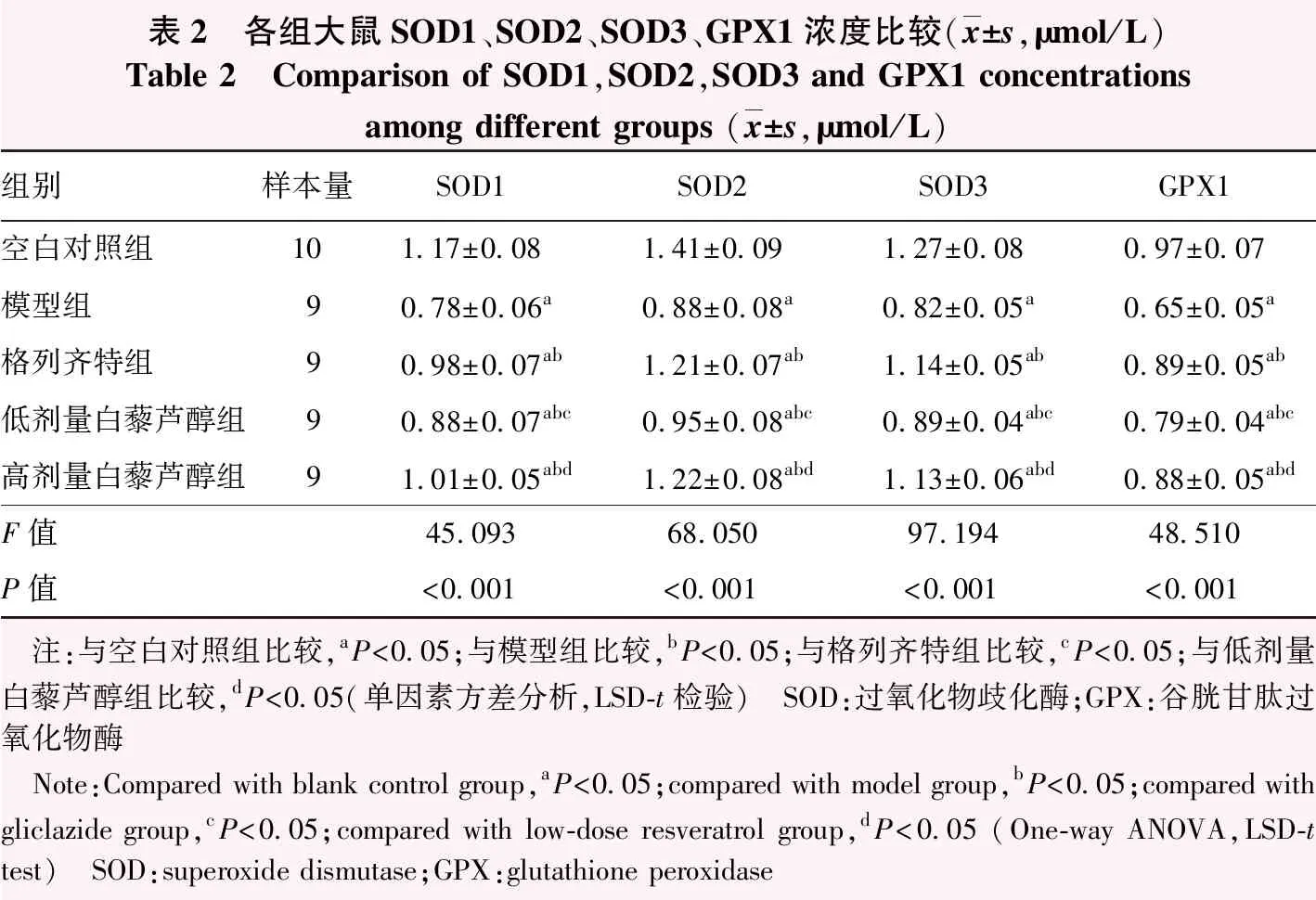
表2 各组大鼠SOD1、SOD2、SOD3、GPX1浓度比较(x±s,μmol/L)Table 2 Comparison of SOD1,SOD2,SOD3 and GPX1 concentrations among different groups (x±s,μmol/L)组别样本量SOD1SOD2SOD3GPX1空白对照组101.17±0.081.41±0.091.27±0.080.97±0.07模型组90.78±0.06a0.88±0.08a0.82±0.05a0.65±0.05a格列齐特组90.98±0.07ab1.21±0.07ab1.14±0.05ab0.89±0.05ab低剂量白藜芦醇组90.88±0.07abc0.95±0.08abc0.89±0.04abc0.79±0.04abc高剂量白藜芦醇组91.01±0.05abd1.22±0.08abd1.13±0.06abd0.88±0.05abdF值45.09368.05097.19448.510P值<0.001<0.001<0.001<0.001 注:与空白对照组比较,aP<0.05;与模型组比较,bP<0.05;与格列齐特组比较,cP<0.05;与低剂量白藜芦醇组比较,dP<0.05(单因素方差分析,LSD-t检验) SOD:过氧化物歧化酶;GPX:谷胱甘肽过氧化物酶 Note:Compared with blank control group,aP<0.05;compared with model group,bP<0.05;compared with gliclazide group,cP<0.05;compared with low-dose resveratrol group,dP<0.05 (One-way ANOVA,LSD-t test) SOD:superoxide dismutase;GPX:glutathione peroxidase
2.2 各组大鼠血清氧化应激反应相关因子浓度比较
空白对照组、模型组、格列齐特组、低剂量白藜芦醇组、高剂量白藜芦醇组大鼠血清SOD1、SOD2、SOD3、GPX1浓度总体比较,差异均有统计学意义(F=45.093、68.050、97.194、48.510,均P<0.001)。与模型组比较,空白对照组、格列齐特组、低剂量白藜芦醇组、高剂量白藜芦醇组SOD1、SOD2、SOD3、GPX1浓度升高,差异均有统计学意义(均P<0.05);与格列齐特组比较,低剂量白藜芦醇组SOD1、SOD2、SOD3、GPX1浓度降低,差异均有统计学意义(均P<0.05);与低剂量白藜芦醇组比较,高剂量白藜芦醇组SOD1、SOD2、SOD3、GPX1浓度升高,差异均有统计学意义(均P<0.05);格列齐特组与高剂量白藜芦醇组比较,差异无统计学意义(P>0.05)(表2)。
2.3 各组大鼠晶状体混浊程度比较
眼前节照相检查显示,空白对照组未见晶状体混浊。模型组、格列齐特组、低剂量白藜芦醇组、高剂量白藜芦醇组均出现不同程度晶状体混浊。空白对照组、模型组、格列齐特组、低剂量白藜芦醇组、高剂量白藜芦醇组大鼠治疗前不同晶状体混浊程度占比总体比较差异无统计学意义(H=0.233,P=0.628)。治疗后不同晶状体混浊程度占比总体比较差异有统计学意义(H=7.514,P<0.001),其中模型组晶状体混浊程度较空白对照组严重;与模型组比较,格列齐特组、低剂量白藜芦醇组、高剂量白藜芦醇组晶状体混浊程度减轻,差异均有统计学意义(均P<0.05);与格列齐特组比较,低剂量白藜芦醇组晶状体混浊程度加重,差异有统计学意义(P<0.05);与低剂量白藜芦醇组比较,高剂量白藜芦醇组晶状体混浊程度减轻,差异有统计学意义(P<0.05);格列齐特组与高剂量白藜芦醇组比较差异无统计学意义(P>0.05)。与治疗前相比,格列齐特组、低剂量白藜芦醇组、高剂量白藜芦醇组治疗后晶状体混浊程度均减轻,差异均有统计学意义(均P<0.05)(图1,表3)。
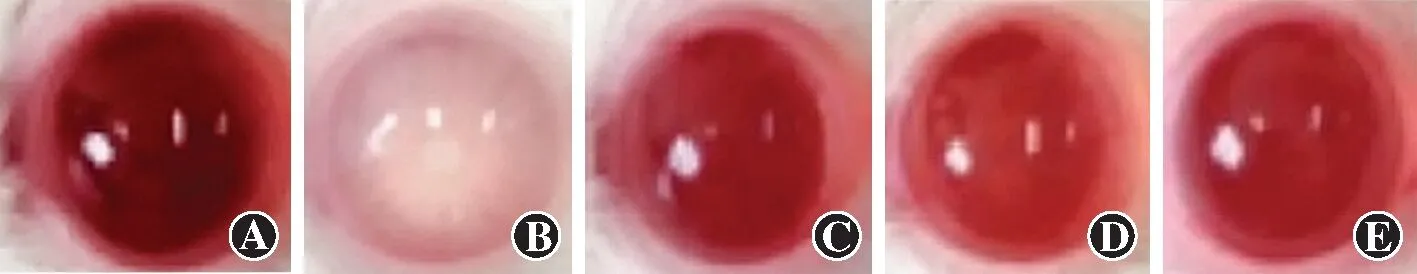
图1 各组大鼠眼前节图像分析 空白对照组未出现晶状体混浊;模型组晶状体混浊程度较明显;格列齐特组、低剂量白藜芦醇组、高剂量白藜芦醇组晶状体混浊程度均较模型组明显改善,其中高剂量白藜芦醇组改善更显著 A:空白对照组 B:模型组 C:格列齐特组 D:低剂量白藜芦醇组 E:高剂量白藜芦醇组
2.4 各组大鼠晶状体细胞形态学变化
苏木精-伊红染色结果显示,空白对照组大鼠晶状体细胞形态无异常变化。模型组大鼠LECs排列紊乱,细胞核缩小,染色不均匀,后囊区晶状体纤维细胞存在未被降解的细胞器。与模型组比较,格列齐特组、低剂量白藜芦醇组、高剂量白藜芦醇组晶状体细胞及亚细胞器异常改变减轻,其中格列齐特组、高剂量白藜芦醇组异常情况更轻微(图2)。
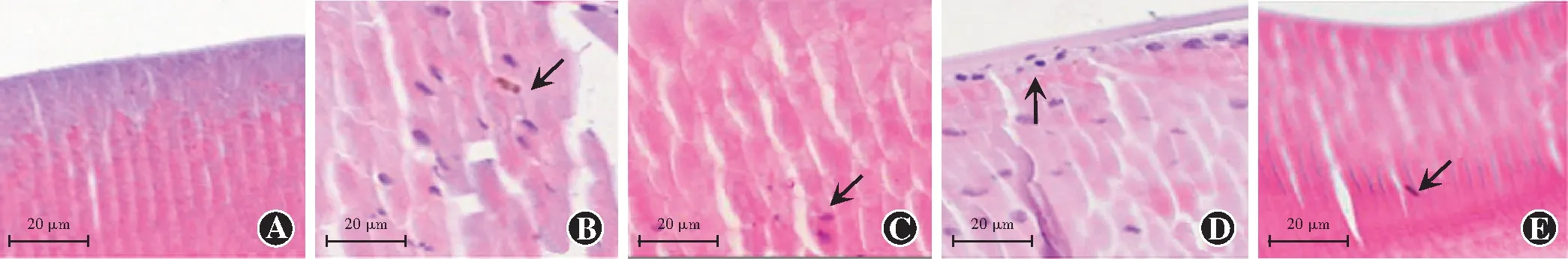
图2 各组大鼠晶状体细胞形态学变化比较(HE ×200,标尺=20 μm) 空白对照组LECs均匀分布,形态规则,细胞核呈椭圆形,染色均匀,纤维细胞无异常;模型组LECs排列紊乱,形态呈柱状或扁平状,细胞核缩小,染色不均匀,后囊区晶状体纤维细胞存在未被降解细胞器;格列齐特组、高剂量白藜芦醇组LECs排列较整齐,细胞质内空泡减少,细胞器减少;低剂量白藜芦醇组LECs排列稍紊乱,存在少量胞质内空泡,后囊区晶状体纤维细胞存在未被降解细胞器 A:空白对照组 B:模型组 C:格列齐特组 D:低剂量白藜芦醇组 E:高剂量白藜芦醇组
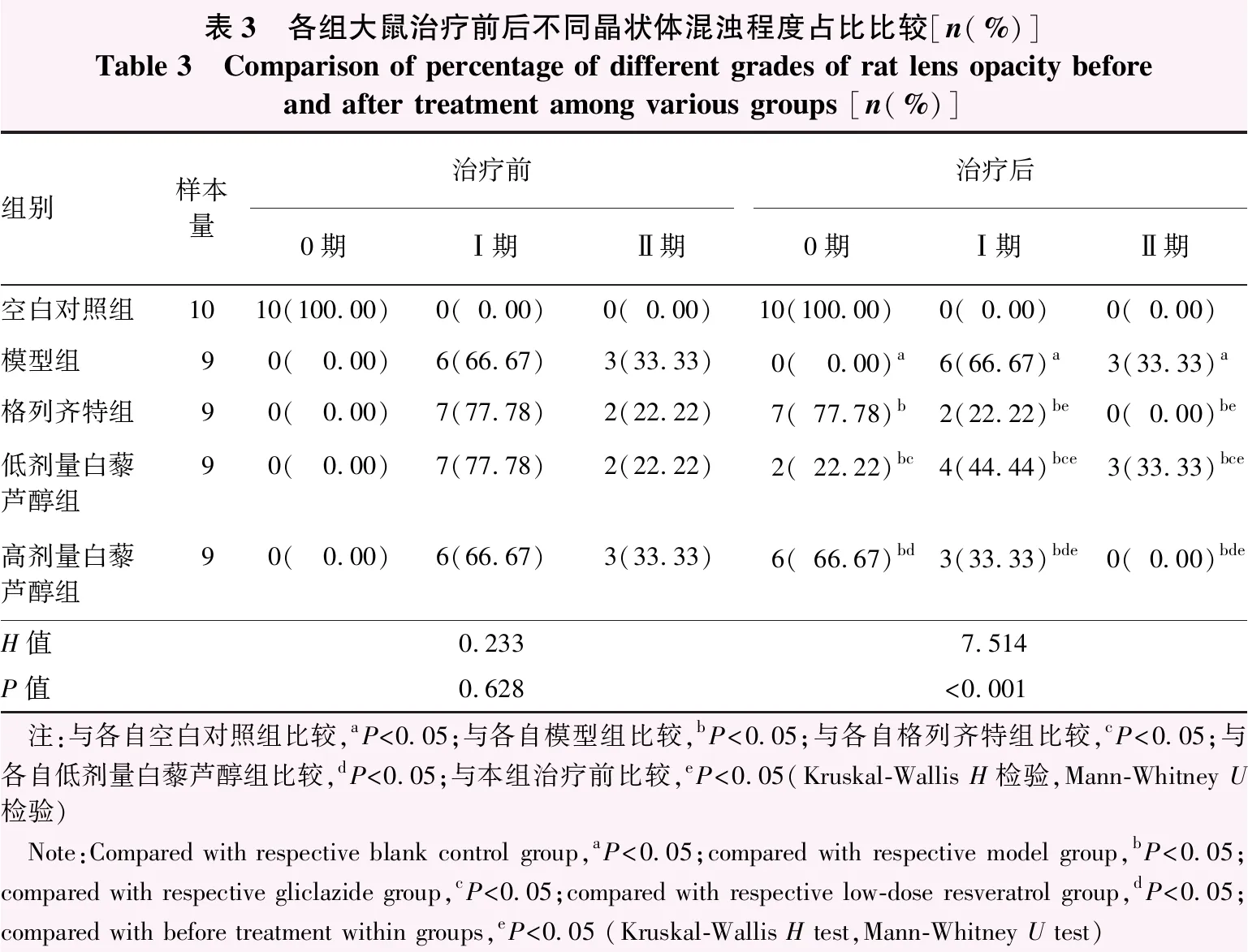
表3 各组大鼠治疗前后不同晶状体混浊程度占比比较[n(%)]Table 3 Comparison of percentage of different grades of rat lens opacity before and after treatment among various groups [n(%)]组别样本量治疗前治疗后0期Ⅰ期Ⅱ期0期Ⅰ期Ⅱ期空白对照组1010(100.00)0(0.00)0(0.00)10(100.00)0(0.00)0(0.00)模型组90(0.00)6(66.67)3(33.33)0(0.00)a6(66.67)a3(33.33)a格列齐特组90(0.00)7(77.78)2(22.22)7(77.78)b2(22.22)be0(0.00)be低剂量白藜芦醇组90(0.00)7(77.78)2(22.22)2(22.22)bc4(44.44)bce3(33.33)bce高剂量白藜芦醇组90(0.00)6(66.67)3(33.33)6(66.67)bd3(33.33)bde0(0.00)bdeH值0.2337.514P值0.628<0.001 注:与各自空白对照组比较,aP<0.05;与各自模型组比较,bP<0.05;与各自格列齐特组比较,cP<0.05;与各自低剂量白藜芦醇组比较,dP<0.05;与本组治疗前比较,eP<0.05(Kruskal-Wallis H检验,Mann-Whitney U检验) Note:Compared with respective blank control group,aP<0.05;compared with respective model group,bP<0.05;compared with respective gliclazide group,cP<0.05;compared with respective low-dose resveratrol group,dP<0.05;compared with before treatment within groups,eP<0.05 (Kruskal-Wallis H test,Mann-Whitney U test)
2.5 各组大鼠LECs凋亡率比较
空白对照组鲜见凋亡细胞。模型组凋亡细胞增多,多见棕褐色凋亡细胞核。与模型组比较,格列齐特组、低剂量白藜芦醇组、高剂量白藜芦醇组凋亡细胞逐渐减少,其中格列齐特组、高剂量白藜芦醇组减少更明显。空白对照组、模型组、格列齐特组、低剂量白藜芦醇组、高剂量白藜芦醇组大鼠LECs凋亡率总体比较差异有统计学意义(F=711.151,P<0.001)。与模型组比较,空白对照组、格列齐特组、低剂量白藜芦醇组、高剂量白藜芦醇组LECs凋亡率降低,差异均有统计学意义(均P<0.05);与格列齐特组比较,低剂量白藜芦醇组LECs凋亡率升高,差异有统计学意义(P<0.05);与低剂量白藜芦醇组比较,高剂量白藜芦醇组LECs凋亡降低,差异有统计学意义(P<0.05);格列齐特组与高剂量白藜芦醇组比较差异无统计学意义(P>0.05)(图3,表4)。
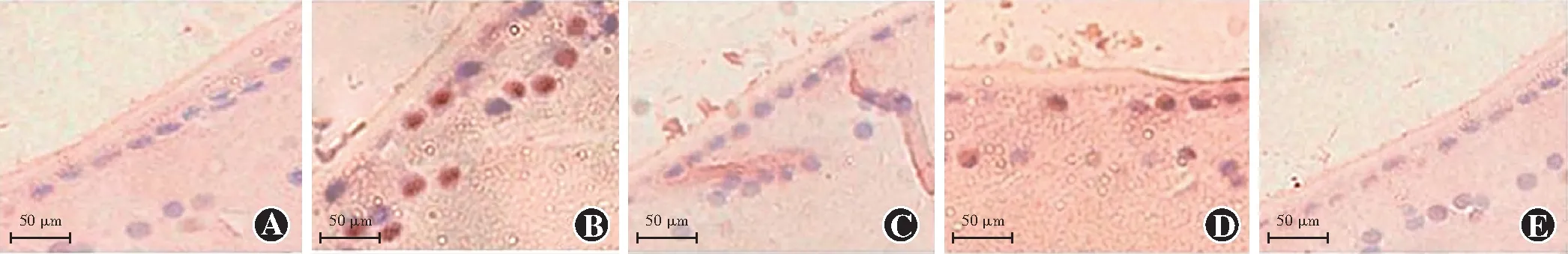
图3 各组大鼠LECs凋亡情况比较(TUNEL ×200,标尺=50 μm) 空白对照组鲜见凋亡细胞,LECs核多呈蓝色;模型组凋亡细胞增多,凋亡细胞核呈棕褐色;格列齐特组、高剂量白藜芦醇组凋亡细胞数较模型组明显减少,且少于低剂量白藜芦醇组 A:空白对照组 B:模型组 C:格列齐特组 D:低剂量白藜芦醇组 E:高剂量白藜芦醇组
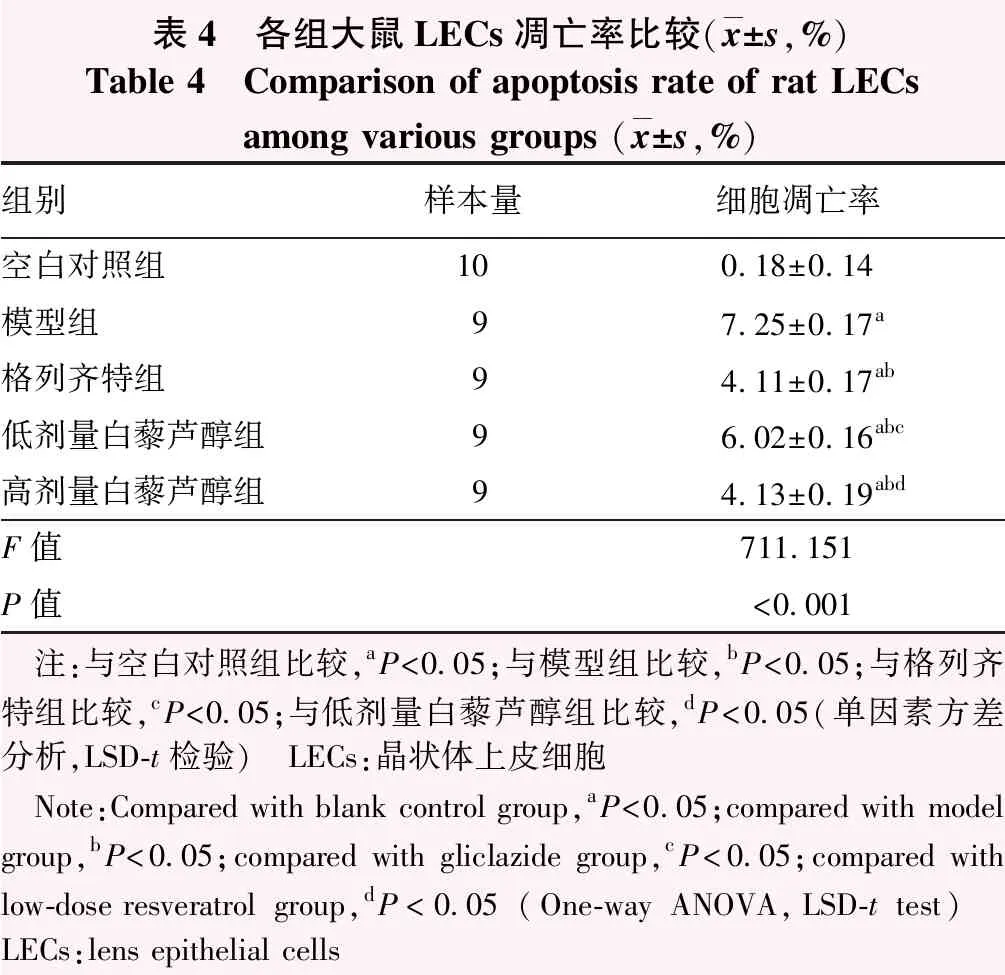
表4 各组大鼠LECs凋亡率比较(x±s,%)Table 4 Comparison of apoptosis rate of rat LECs among various groups (x±s,%)组别样本量细胞凋亡率空白对照组100.18±0.14模型组97.25±0.17a格列齐特组94.11±0.17ab低剂量白藜芦醇组96.02±0.16abc高剂量白藜芦醇组94.13±0.19abdF值711.151P值<0.001 注:与空白对照组比较,aP<0.05;与模型组比较,bP<0.05;与格列齐特组比较,cP<0.05;与低剂量白藜芦醇组比较,dP<0.05(单因素方差分析,LSD-t检验) LECs:晶状体上皮细胞 Note:Compared with blank control group,aP<0.05;compared with model group,bP<0.05;compared with gliclazide group,cP<0.05;compared with low-dose resveratrol group,dP<0.05 (One-way ANOVA,LSD-t test) LECs:lens epithelial cells
2.6 各组大鼠晶状体Nrf2、HO-1蛋白相对表达量比较
空白对照组Nrf2、HO-1蛋白条带强度较高;与空白对照组比较,模型组Nrf2、HO-1蛋白条带强度明显降低;与模型组比较,格列齐特组、低剂量白藜芦醇组、高剂量白藜芦醇组Nrf2、HO-1蛋白条带强度有所回升,其中格列齐特组、高剂量白藜芦醇组Nrf2、HO-1蛋白条带强度回升更明显(图4)。空白对照组、模型组、格列齐特组、低剂量白藜芦醇组、高剂量白藜芦醇组大鼠Nrf2、HO-1蛋白相对表达量总体比较,差异均有统计学意义(F=39.325、62.354,均P<0.001);其中与模型组比较,空白对照组、格列齐特组、低剂量白藜芦醇组、高剂量白藜芦醇组Nrf2、HO-1蛋白相对表达量升高,差异均有统计学意义(均P<0.05);与格列齐特组比较,低剂量白藜芦醇组Nrf2、HO-1蛋白相对表达量降低,差异均有统计学意义(均P<0.05);与低剂量白藜芦醇组比较,高剂量白藜芦醇组Nrf2、HO-1蛋白相对表达量升高,差异均有统计学意义(均P<0.05);格列齐特组与高剂量白藜芦醇组比较,差异无统计学意义(P>0.05)(表5)。
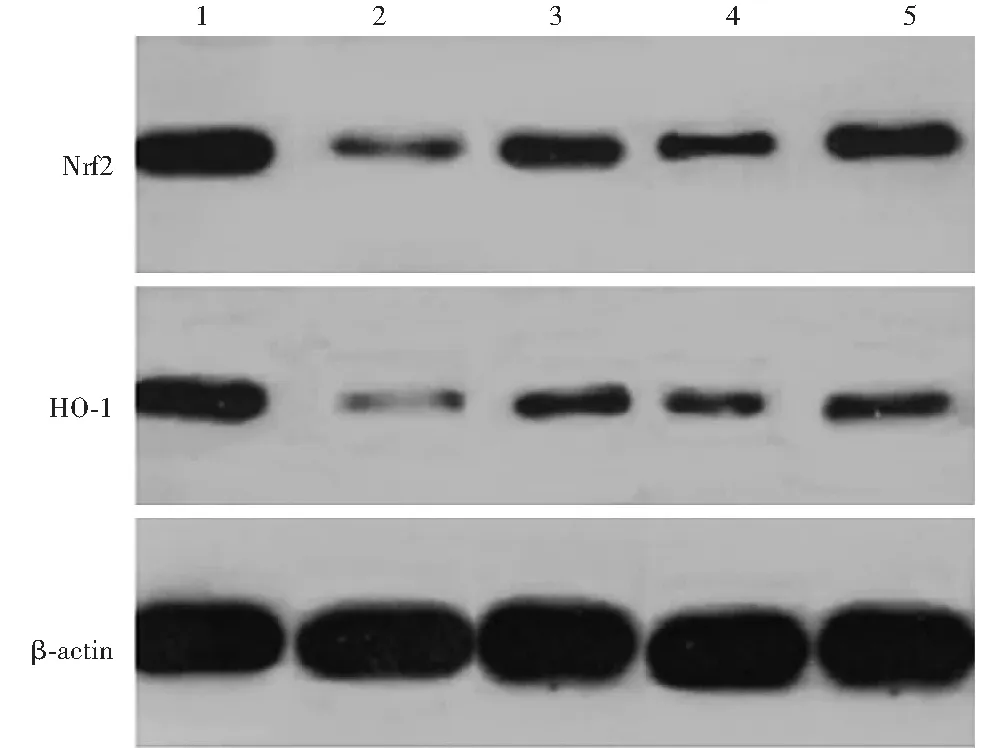
图4 各组Nrf2、HO-1蛋白表达电泳图 1:空白对照组;2:模型组;3:格列齐特组;4:低剂量白藜芦醇组;5:高剂量白藜芦醇组 Nrf:核因子E2相关因子;HO:血红素氧合酶;β-actin:β-肌动蛋白
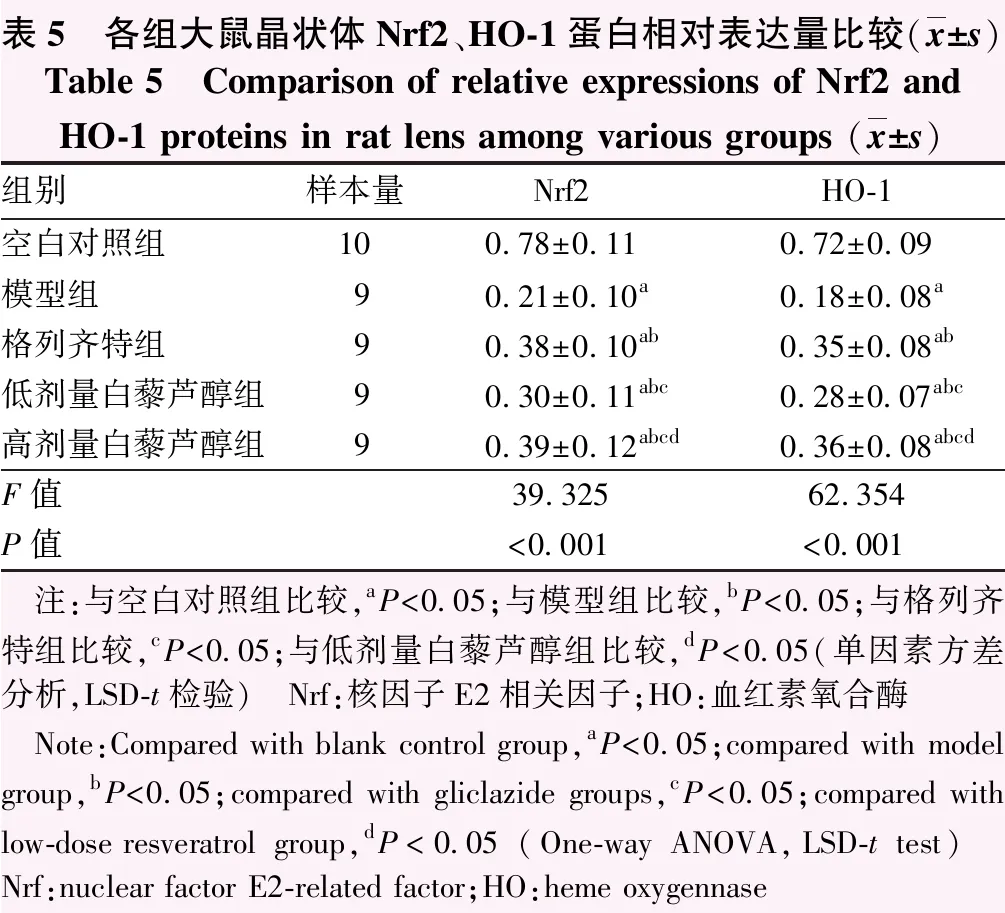
表5 各组大鼠晶状体Nrf2、HO-1蛋白相对表达量比较(x±s)Table 5 Comparison of relative expressions of Nrf2 and HO-1 proteins in rat lens among various groups (x±s)组别样本量Nrf2HO-1空白对照组100.78±0.110.72±0.09模型组90.21±0.10a0.18±0.08a格列齐特组90.38±0.10ab0.35±0.08ab低剂量白藜芦醇组90.30±0.11abc0.28±0.07abc高剂量白藜芦醇组90.39±0.12abcd0.36±0.08abcdF值39.32562.354P值<0.001<0.001 注:与空白对照组比较,aP<0.05;与模型组比较,bP<0.05;与格列齐特组比较,cP<0.05;与低剂量白藜芦醇组比较,dP<0.05(单因素方差分析,LSD-t检验) Nrf:核因子E2相关因子;HO:血红素氧合酶 Note:Compared with blank control group,aP<0.05;compared with model group,bP<0.05;compared with gliclazide groups,cP<0.05;compared with low-dose resveratrol group,dP<0.05 (One-way ANOVA,LSD-t test) Nrf:nuclear factor E2-related factor;HO:heme oxygennase
3 讨论
临床不同分期糖尿病性白内障的治疗方法存在差异,其中早中期以药物治疗为主,晚期则需行手术治疗。虽然近年来白内障手术取得一定进展,但部分糖尿病性白内障患者视力恢复效果欠佳,且手术可能引发虹膜粘连、黄斑囊样水肿等并发症,故需加强糖尿病性白内障的早期防治,探寻可延缓或控制早中期糖尿病性白内障病情的方法。近年来,糖尿病性白内障与氧化应激损伤的关系逐渐成为眼科临床研究热点,抗氧化剂的作用逐渐受到关注[9]。
白藜芦醇是一种天然抗氧化剂,主要提取自白藜芦,属于含多羟基芪类结构的非黄酮类多酚化合物,具有清除氧自由基、抗氧化、抗炎、抗凋亡等作用[10]。研究表明,白藜芦醇可通过上调内皮细胞一氧化氮合酶表达,刺激其活性,增加一氧化氮生成,且能抑制内皮素-1合成,减轻氧化应激反应,在糖尿病治疗中有一定作用[11]。相关报道还显示,白藜芦醇可控制糖尿病动物的血糖水平,改善全身葡萄糖代谢[12]。格列齐特是一种常见磺脲类降糖药物,其给药后在体内的释放曲线与糖尿病患者血糖昼夜周期性波动匹配,降糖作用温和,且可抑制血小板聚集,减轻氧化应激反应,缓解糖尿病并发症,故本研究以格列齐特作为对照药物。本研究发现,高剂量白藜芦醇治疗后模型鼠空腹血糖、空腹胰岛素及SOD1、SOD2、SOD3、GPX1水平降低,晶状体混浊程度减轻,细胞及亚细胞器异常情况更轻微,与格列齐特组效果相符,这说明高剂量白藜芦醇可控制糖尿病模型大鼠血糖,减轻氧化应激反应和晶状体混浊程度,具有与格列齐特相似的效果。LECs为晶状体代谢最活跃部位,在维持晶状体透明度中作用显著。有研究证实,LECs凋亡是除先天性白内障外所有白内障发病的细胞学基础[13]。本研究发现,高剂量白藜芦醇应用后大鼠LECs凋亡率降低,与格列齐特组相一致,这说明高剂量白藜芦醇可抑制LECs凋亡,获得与格列齐特相似效果。张剑等[14]的研究也证实,白藜芦醇可抑制糖尿病性白内障大鼠脂质过氧化反应,减轻氧化应激损伤,延缓晶状体病理改变发生,与本研究结果一致。
机体出现氧化应激损伤时可形成一系列复杂的氧化应激应答系统。Nrf2是机体各器官细胞抗氧化损伤关键因子之一,可诱导抗氧化保护蛋白酶表达,调节细胞内氧化还原反应[15]。Nrf2受外界氧化应激因子刺激后,可通过与抗氧化反应元件ARE作用,促进抗氧化蛋白HO-1表达,在2型糖尿病治疗中发挥重要作用[16]。HO-1能促使血红蛋白分子进一步降解成等摩尔的自由铁、胆绿素、一氧化氮,从而减轻氧化应激损伤,抑制细胞凋亡[17]。相关报道也显示,调节Nrf2/HO-1信号通路可抑制糖尿病小鼠肝脏氧化应激损伤[18]。还有研究发现,白藜芦醇能通过对细胞内Nrf2表达进行调节,保护糖尿病所致细胞损伤,减轻氧化应激反应[19]。以上结果表明,诱导Nrf2、HO-1表达可减轻糖尿病氧化应激反应。本研究结果显示,经白藜芦醇处理后大鼠Nrf2、HO-1表达均上调,且呈剂量依赖性,提示高剂量白藜芦醇减轻早中期糖尿病性白内障大鼠氧化应激反应的作用可能是通过调节Nrf2/HO-1信号通路实现的。
综上所述,本研究表明白藜芦醇可减轻糖尿病大鼠晶状体混浊,其作用机制可能与调节Nrf2/HO-1信号通路,发挥抗氧化应激作用有关,但是否存在其他调控机制仍有待进一步分析。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明葛晓芳:设计实验、实施研究、分析/解释数据、文献检索及整理、论文撰写及修改;朱大强、罗纳丽:设计实验、文献检索及整理;刘亚东:设计实验、对文章知识性内容的审阅和智力性内容的修改及定稿

