蒸馏水处理对体外人晶状体上皮细胞活性的抑制作用
张文文 张荣沛 刘亚军 何自芳 张司 解正高
1南京大学医学院附属鼓楼医院眼科,南京 210008;2大连医科大学研究生院,大连 116044
晶状体囊膜混浊是白内障术后常见的并发症,其中前囊膜混浊可导致晶状体前囊收缩和人工晶状体(intraocular lens,IOL)偏移[1],后囊膜混浊(posterior capsular opacification,PCO)可导致视力明显下降[2]。成人白内障术后3~5年PCO的发生率为20%~30%[3],儿童的晶状体上皮细胞(lens epithelial cells,LECs)比成人的增生和迁移能力更强[4],儿童白内障术后晶状体囊膜混浊的发生率接近100%,对视力发育有严重影响[5]。晶状体囊膜混浊的治疗方法主要是Nd:YAG激光囊膜切开或行囊膜切开术,前者相对简单,但术后仍有发生并发症的风险[3,6],后者是一种侵入性方法。因此,预防白内障术后囊膜混浊的研究具有重要临床意义。研究认为,白内障术后囊膜混浊与手术创伤刺激引起晶状体周围和赤道部残留LECs的增生、迁移和上皮-间质转化(epithelial-mesenchymal transition,EMT)有关[7]。目前,预防白内障术后晶状体囊膜混浊的研究主要集中在2个方面:(1)抑制LECs的增生、迁移和EMT,如白藜芦醇药物的应用等以及植入疏水性锐边IOL或厚的囊内开口环以抑制LECs向后囊的迁移[8-10],但LECs仍残留在囊袋内,无法消除PCO发生的机制[11];(2)采用药物和手术结合的方法,尽可能清除囊膜中残留的LECs[12-13]。然而,许多药物对眼内组织的潜在毒性作用限制了其临床应用[14-15]。研究表明,蒸馏水局部应用的低渗透压特性可诱导晶状体囊膜上LECs溶解,而对眼内组织无化学毒性,且可通过平衡盐溶液(balanced salt solution,BSS)快速中和[16],推测其具有预防白内障术后囊膜上残留LECs活性作用,但目前相关人体临床试验结果存在分歧,蒸馏水对LECs的影响及最佳作用时间也不完全清楚。本研究以年龄相关性白内障(age-related cataract,ARC)患者的分离前囊膜作为实验样本,探讨蒸馏水对LECs活性是否具有抑制作用及其联合BSS对LECs是否具有清除作用,为临床工作提供参考依据。
1 材料与方法
1.1 材料
1.1.1晶状体囊膜标本的收集 纳入2020年5—12月在南京大学医学院附属鼓楼医院确诊为ARC并行超声乳化白内障吸除联合IOL植入术的患者156例156眼,于术中收集晶状体前囊膜组织标本。患者年龄50~95岁,平均(69.40±11.52)岁;男81例,女75例。纳入标准:(1)年龄≥50岁;(2)最佳矫正视力≤0.3;(3)晶状体囊膜相对完整、直径为5.0~5.5 mm。排除标准:(1)年龄<50岁;(2)有眼部外伤史;(3)术中晶状体囊膜破碎;(4)晶状体囊膜直径<5.0 mm;(5)囊膜污染者;(6)有其他内眼手术史者。本研究遵循《赫尔辛基宣言》,研究方案经南京大学医学院附属鼓楼医院伦理委员会批准(批文号:2019-248-01)。所有患者均了解本研究的方法和目的,同意获取其生物样本用于实验研究,并自愿签署知情同意书。
1.1.2主要试剂及仪器 锥虫蓝染色液(C0040)、质量分数4%组织细胞固定液(P1110)、质量分数2.5%Gluta固定液(P1126)(北京索莱宝科技有限公司);磷酸盐缓冲液(phosphate buffer saline,PBS)(Gibco 10010023)(上海麦克林生化有限公司);伊红染色液(R20570,上海源叶生物科技有限公司);BSS(美国Alcon公司);蒸馏水(灭菌注射用水)(上海信谊金朱药业有限公司);二甲苯(10023418)、无水乙醇(100092683)(上海国药集团化学试剂有限公司);锇酸(分析纯)、环氧树脂(Epon618)(美国Sigma公司)。计算机图像分析系统(OLYMPUS cellSens Entry)(日本奥林巴斯公司);OLYMPUS BX43光学显微镜(南京奥力科学仪器有限公司);脱水机(Donatello,意大利DIAPATH公司);包埋机(JB-P5)、冻台(JB-L5)(武汉俊杰电子有限公司);病理切片机(RM2016,上海Leica仪器有限公司);组织摊片机(KD-P,浙江省金华市科迪仪器设备有限公司);烤箱(GFL-230,天津市莱玻特瑞仪器设备有限公司);防脱载玻片(Servicebio)(北京索莱宝科技有限公司);透射电子显微镜(JEOL JEM-1010,日本电子公司);透射电子显微镜制样机(EM AMW,德国LEICA公司);超薄切片机(POWERTOME XL,美国RMC公司);手术显微镜(德国Zeiss公司)。
1.2 方法
1.2.1实验分组及处理 将术中收集到的前囊膜迅速于手术显微镜下分别等分为2小片,共计312片。(1)采用计算机取随机数法选取157片,并使用同种方法将其分为正常对照组23片、阳性对照组10片、BSS浸泡组61片和蒸馏水浸泡组63片。正常对照组标本无任何处理;阳性对照组标本用4%组织细胞固定液固定;BSS浸泡组标本用BSS分别浸泡1、2、3 min,分别为20、21、20片;蒸馏水浸泡组标本用蒸馏水分别浸泡1、2、3 min,分别为20、23和20片,备用。(2)模拟白内障手术中的注吸(irrigation and aspiration,I/A)过程,采用计算机随机数法选取125片,以同种方法将其分为BSS浸泡组63片和和蒸馏水浸泡组62片,其中BSS浸泡组中浸泡1 min者20片、浸泡2 min者22片、浸泡3 min者21片;蒸馏水浸泡组中浸泡1 min者20片、浸泡2 min者22片、浸泡3 min者20片。用装有BSS的瓶子在70 cm高度冲洗1 min,备用。(3)另采用计算机随机数法选取15片,以同种方法分为5个组,每组3片,其中正常对照组不做处理,BSS浸泡组浸泡于BSS中3 min,蒸馏水浸泡组分别浸泡1、2、3 min。处理后固定液固定24 h以上,行苏木精-伊红染色,于透射电子显微镜下观察。同样的分组及处理方法处理样本15片,置入4 ℃预冷的固定液中4 ℃保存备用。
1.2.2锥虫蓝-伊红染色法检测细胞活力 将处理的样本置于质量分数0.04%锥虫蓝溶液中1 min;BSS温和冲洗2次;除阳性对照组外,其余样本用组织细胞固定液固定10 min,PBS冲洗3 min,伊红染色30 s;自来水轻轻洗涤,室温下干燥。细胞活力指标的计算:1.2.1(1)中的157个样本小片行锥虫蓝-伊红染色后于40倍光学显微镜下拼接成1/2囊膜大小并拍照,400倍光学显微镜下调整焦距,确认细胞核并进行拍照,以计算细胞核数目;辨认细胞轮廓并拍照,以计算细胞数目,每组选择10个非重叠图像。采用ImageJ软件计算LECs密度(个/mm2)、LECs死亡数(个/mm2)和LECs死亡率(%)(图1A~D)。计算公式如下:
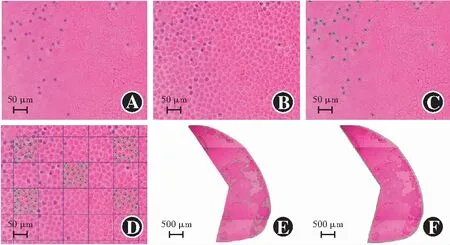
图1 蒸馏水处理的LECs活性定量分析示意图(锥虫蓝-伊红染色) A:以看清细胞核为拍照要求,计算细胞核数目(×400,标尺=50 μm) B:以看清细胞轮廓为拍照要求,计算细胞轮廓数目(×400,标尺=50 μm) C:死亡LECs的数量计数(×400,标尺=50 μm) D:计算5个正方形中的LECs数量(×400,标尺=50 μm) E:绿色标示部分为剩余的LECs面积(×40,标尺=500 μm) F:囊膜总面积(×40,标尺=500 μm)
将1.2.1(2)中经蒸馏水或BSS浸泡的125个联合BSS冲洗的样本小片进行锥虫蓝-伊红染色,40倍光学显微镜下拍照,采用ImageJ软件计算LECs脱落百分率(%),LECs脱落百分率(%)=1-处理后的LECs面积/囊膜总面积×100%。以同样方法计算1.2.1(1)中157个样本小片的LECs脱落百分率(%)(图1E~F)。
1.2.3光学显微镜和透射电子显微镜下观察各组LECs结构
本文研究了针对票据关键区域的基于卷积神经网络的识别方法,对CNN网络结构进行了改进,提出了一种改进的适用票据内容定位的CNN网络。与传统CNN网络相比,本文提取出的多阶差分特征,与原图图像构成5通道图像特征,有效地挖掘了内在特征,并且结合卷积神经网络作为分类器,发挥了图像的多通道优势,使得输入数据包含更多的静态与动态特征,从而减少了加密处理的图像像素,提高了水印加密的计算效率。
1.2.3.1光学显微镜下观察各组LECs结构 将1.2.1(3)中的15个小片样本从固定液中取出,在通风橱内用手术刀将组织修理平整,将其与对应的标签匹配后置于脱水盒内,于脱水机内依次进行梯度乙醇脱水:体积分数75%乙醇4 h,85%乙醇2 h,90%乙醇2 h,95%乙醇1 h,无水乙醇Ⅰ 30 min,无水乙醇Ⅱ 30 min,醇苯5~10 min;二甲苯Ⅰ 处理5~10 min,二甲苯Ⅱ处理5~10 min,65 ℃条件下融化石蜡Ⅰ、Ⅱ、Ⅲ分别1 h,于包埋机内,先放入包埋框,待蜡凝固之前将组织从脱水盒内取出,按照包埋面的要求放入包埋框并贴上对应的标签。于-20 ℃冻台冷却,蜡凝固后将蜡块从包埋框中取出并修整蜡块,用石蜡切片机切片,厚度为4 μm。切片漂浮于摊片机40 ℃温水上,将组织展平铺于载玻片,60 ℃烘箱内烤片。水烤干蜡烤化后取出,常温下保存。中性树胶封片,光学显微镜下观察并摄片。
1.2.3.2透射电子显微镜下各组LECs超微结构观察 取1.2.1(3)中处理好的剩余15片标本,小心倒掉固定液,用0.1 mol/L、pH 7.0的PBS漂洗3次,每次15 min。质量分数1%锇酸溶液固定样品1~2 h,用PBS漂洗样品3次,每次15 min。乙醇梯度脱水(30%、50%、70%、80%、90%)各15 min,用100%的乙醇处理20 min,纯丙酮处理20 min。用体积比1∶1的包埋剂与丙酮液的混合液处理样品1 h,体积比3∶1的包埋剂与丙酮液的混合液处理样品3 h,纯包埋剂处理样品过夜,将处理的样品包埋,70 ℃加热过夜。以超薄切片机切片,厚度为70~90 nm,经柠檬酸铅溶液和醋酸双氧铀50%乙醇饱和溶液各染色5~10 min,晾干后透射电子显微镜下观察细胞的超微结构并拍照。
1.3 统计学方法

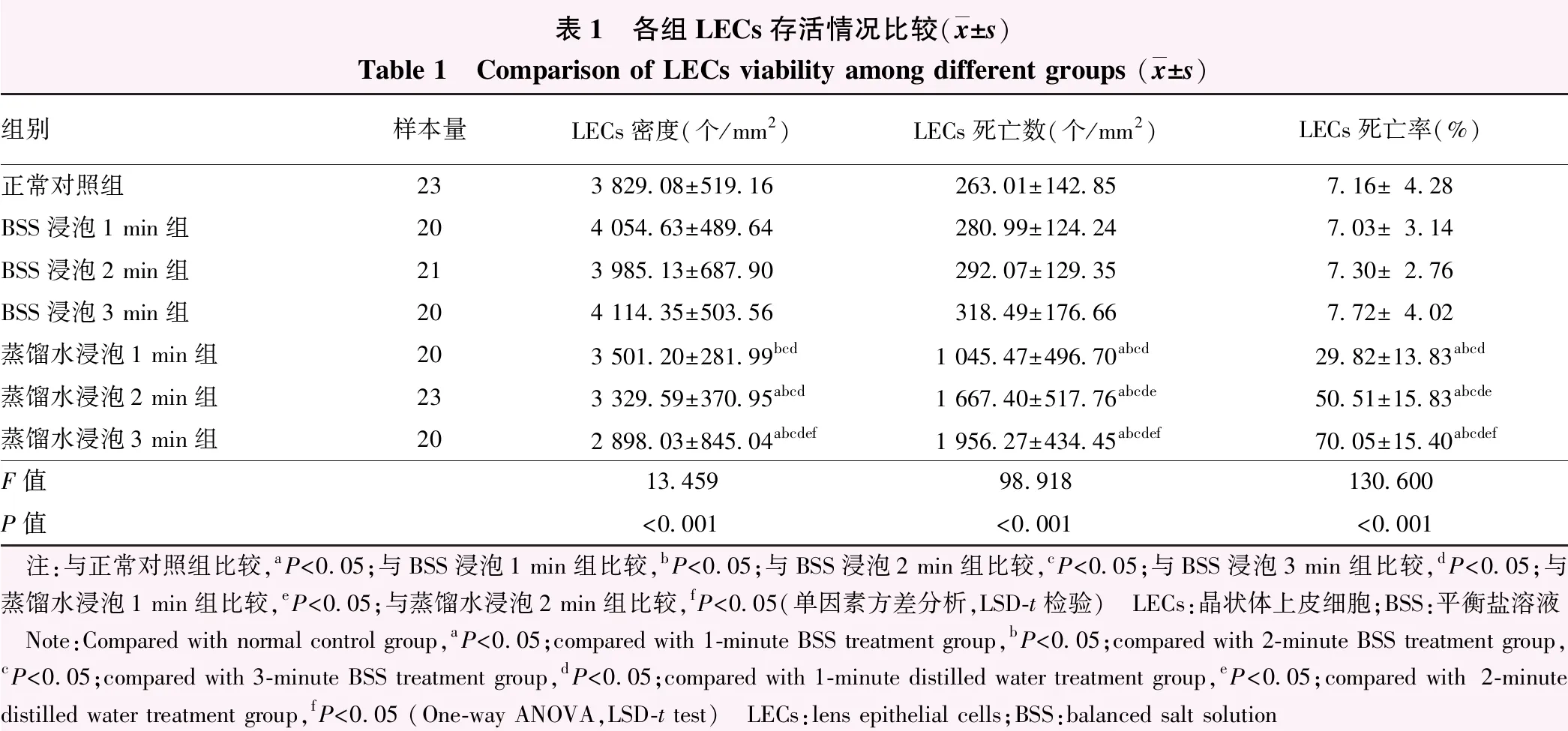
表1 各组LECs存活情况比较(x±s)Table 1 Comparison of LECs viability among different groups (x±s)组别样本量LECs密度(个/mm2)LECs死亡数(个/mm2)LECs死亡率(%)正常对照组233 829.08±519.16263.01±142.857.16±4.28BSS浸泡1 min组204 054.63±489.64280.99±124.247.03±3.14BSS浸泡2 min组213 985.13±687.90292.07±129.357.30±2.76BSS浸泡3 min组204 114.35±503.56318.49±176.667.72±4.02蒸馏水浸泡1 min组203 501.20±281.99bcd1 045.47±496.70abcd29.82±13.83abcd蒸馏水浸泡2 min组233 329.59±370.95abcd1 667.40±517.76abcde50.51±15.83abcde蒸馏水浸泡3 min组202 898.03±845.04abcdef1 956.27±434.45abcdef70.05±15.40abcdefF值13.45998.918130.600P值<0.001<0.001<0.001 注:与正常对照组比较,aP<0.05;与BSS浸泡1 min组比较,bP<0.05;与BSS浸泡2 min组比较,cP<0.05;与BSS浸泡3 min组比较,dP<0.05;与蒸馏水浸泡1 min组比较,eP<0.05;与蒸馏水浸泡2 min组比较,fP<0.05(单因素方差分析,LSD-t检验) LECs:晶状体上皮细胞;BSS:平衡盐溶液 Note:Compared with normal control group,aP<0.05;compared with 1-minute BSS treatment group,bP<0.05;compared with 2-minute BSS treatment group,cP<0.05;compared with 3-minute BSS treatment group,dP<0.05;compared with 1-minute distilled water treatment group,eP<0.05;compared with 2-minute distilled water treatment group,fP<0.05 (One-way ANOVA,LSD-t test) LECs:lens epithelial cells;BSS:balanced salt solution
2 结果
2.1 单纯浸泡处理后各组LECs存活情况比较
正常对照组前囊LECs呈规则的多边形,并有少量LECs死亡。阳性对照组所有细胞均死亡,视野内满布蓝色细胞核。BSS浸泡各组LECs边界清晰,形态接近正常对照组。蒸馏水浸泡各组随时间延长LECs逐渐胀大死亡,细胞边界不清(图2)。各组LECs密度、LECs死亡数和LECs死亡率总体比较差异均有统计学意义(F=13.459、98.918、130.600,均P<0.001),其中蒸馏水浸泡2 min和3 min LECs密度均低于正常对照组,蒸馏水浸泡1、2、3 min组LECs死亡数和死亡率均高于正常对照组,蒸馏水浸泡1、2、3 min组LECs死亡数和死亡率均高于BSS浸泡相同时长组,差异均有统计学意义(均P<0.05)。随浸泡时间的延长,蒸馏水浸泡组LECs死亡数增多,死亡率逐渐升高(表1)。
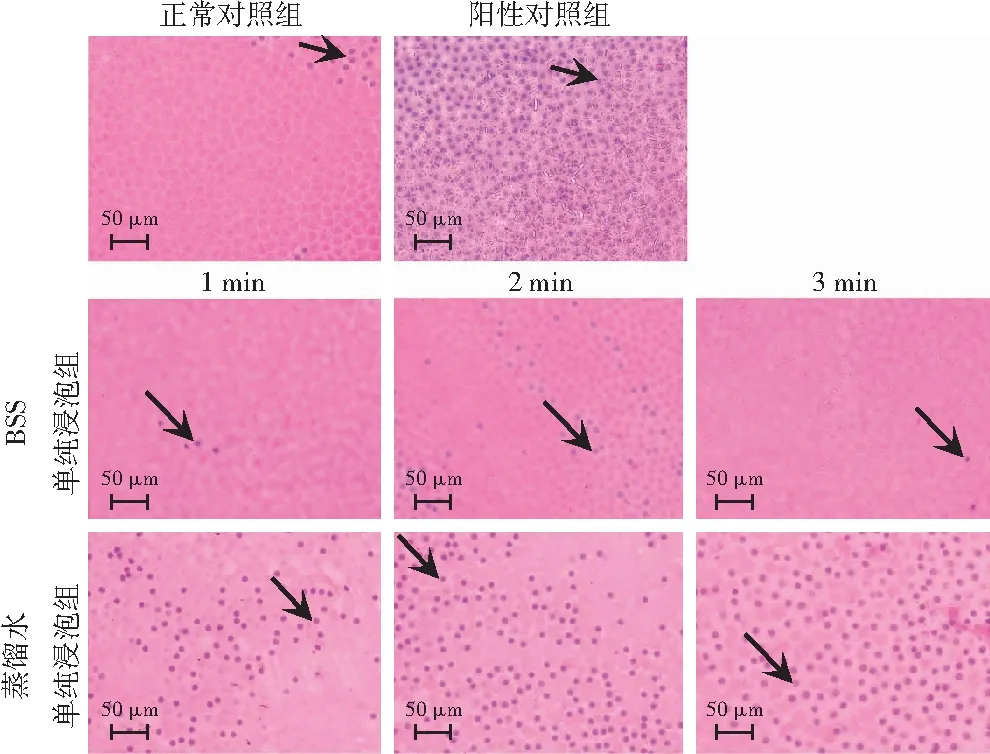
图2 光学显微镜下各组细胞形态变化(HE ×400,标尺=50 μm) 正常对照组LECs呈规则多边形,并有少量LECs死亡(箭头);阳性对照组所有细胞均死亡,视野内满布蓝色细胞核;BSS浸泡各组LECs边界清晰,形态接近正常;蒸馏水浸泡后各组LECs随时间延长逐渐胀大死亡 BSS:平衡盐溶液
2.2 单纯浸泡及联合BSS处理后各组LECs脱落情况比较
正常对照组、BSS浸泡组和BSS浸泡联合冲洗组仅检测到少量脱落的LECs。蒸馏水浸泡联合冲洗组脱落LECs明显增多,且随着蒸馏水浸泡时间的延长脱落的LECs增多(图3)。各组LECs脱落百分率总体比较,差异有统计学意义(F=386.287,P<0.001),其中与正常对照组相比,蒸馏水浸泡1min、2 min和3 min及蒸馏水浸泡1min、2 min和3 min联合冲洗组的LECs脱落百分率明显升高,差异均有统计学意义(均P<0.001);BSS浸泡1 min、2 min和3 min及BSS浸泡1 min、2 min和3 min联合冲洗组间LECs脱落百分率比较,差异均无统计学意义(均P>0.05)。相同浸泡时间点浸泡联合冲洗组LECs脱落率明显高于蒸馏水浸泡组,差异均有统计学意义(均P<0.05)(表2)。
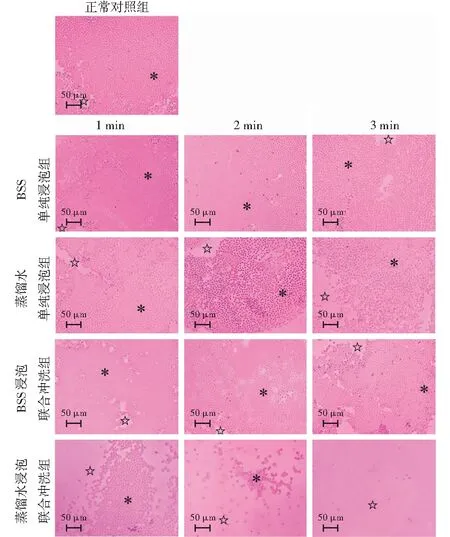
图3 光学显微镜下各组LECs脱落情况(HE ×400,标尺=50 μm) 正常对照组、BSS浸泡组和BSS浸泡联合冲洗组仅检测到少量脱落LECs。随着蒸馏水浸泡时间的延长,蒸馏水浸泡联合冲洗组LECs脱落增多 ☆:有LECs的区域;*:没有LECs的区域 BSS:平衡盐溶液
2.3 各组LECs结构变化
2.3.1光学显微镜下各组LECs结构变化 正常对照组和BSS浸泡3 min组中可见细胞形态规则及圆形细胞核的LECs,细胞呈单层排列并贴附在囊膜上。蒸馏水浸泡2 min组和3 min组LECs的细胞完整性被破坏,细胞质流出,部分LECs脱落(图4)。
2.3.2透射电子显微镜下各组LECs结构变化 正常对照组和BSS浸泡3 min组LECs细胞结构完整,细胞核呈圆形或类圆形,核膜完整,核仁清晰,染色质分布均匀,亚细胞器形态正常,细胞间连接呈指状突起,细胞呈单层排列,贴附于囊膜。蒸馏水浸泡1 min组和2 min组可见细胞溶解,细胞核形态尚规则,细胞质破坏,亚细胞器肿胀,细胞内物质流出细胞外,细胞间连接断裂,细胞与囊膜间贴附疏松。蒸馏水浸泡3 min组可见细胞内物质流出细胞外,细胞体积减小,细胞核变形并可见多处呈锐角状突起,细胞质破坏,亚细胞器肿胀,细胞间连接中断,细胞与囊膜部分分离(图5)。

表2 各组LECs脱落百分率比较(x±s,%)Table 2 Comparison of LECs shedding percentage among various groups (x±s,%)组别样本量LECs脱落百分率正常对照组2311.04±4.85BSS浸泡1 min组2010.88±5.65aBSS浸泡2 min组2111.43±4.95aBSS浸泡3 min组2018.80±7.97bc蒸馏水浸泡1 min组2036.40±15.83abcd蒸馏水浸泡2 min组2341.29±17.55abcd蒸馏水浸泡3 min组2046.22±18.88abcdeBSS浸泡联合冲洗1 min组2017.77±10.25efgBSS浸泡联合冲洗2 min组2219.81±7.37abcefgBSS浸泡联合冲洗3 min组2119.07±6.70abcefg蒸馏水浸泡联合冲洗1 min组2060.02±14.80abcdefghij蒸馏水浸泡联合冲洗2 min组2281.31±13.01abcdefghijk蒸馏水浸泡联合冲洗3 min组2094.12±4.86abcdefghijklF值123.670P值<0.001 注:与正常对照组比较,aP<0.001;与BSS浸泡1 min组比较,bP<0.001;与BSS浸泡2 min组比较,cP<0.001;与BSS浸泡3 min组比较,dP<0.001;与蒸馏水浸泡1 min组比较,eP<0.001;与蒸馏水浸泡2 min组比较,fP<0.05;与蒸馏水浸泡3 min组比较,gP<0.05;与BSS浸泡联合冲洗1 min组比较,hP<0.05;与BSS浸泡联合冲洗2 min组比较,iP<0.05;与BSS浸泡联合冲洗3 min组比较,jP<0.05;与蒸馏水浸泡联合冲洗1 min组比较,kP<0.05;与蒸馏水浸泡联合冲洗2 min组比较,lP<0.05(单因素方差分析,LSD-t检验) LECs:晶状体上皮细胞;BSS:平衡盐溶液 Note:Compared with normal control group,aP<0.001;compared with 1-minute BSS treatment group,bP<0.001;compared with 2-minute BSS treatment group,cP<0.001;compared with 3-minute BSS treatment group,dP<0.001;compared with 1-minute distilled water treatment group,eP<0.001;compared with 2-minute distilled water treatment group, fP<0.05;compared with 3-minute distilled water treatment group,gP<0.05;compared with 1-minute BSS immersion combined rinse group,hP<0.05;compared with 2-minute BSS immersion combined rinse group,iP<0.05;compared with 3-minute BSS immersion combined rinse group,jP<0.05;compared with 1-minute distilled water immersion combined rinse group,kP<0.05;compared with 2-minute distilled water immersion combined rinse group,lP<0.05 (One-way ANOVA,LSD-t test) LECs:lens epithelial cells;BSS:balanced salt solution
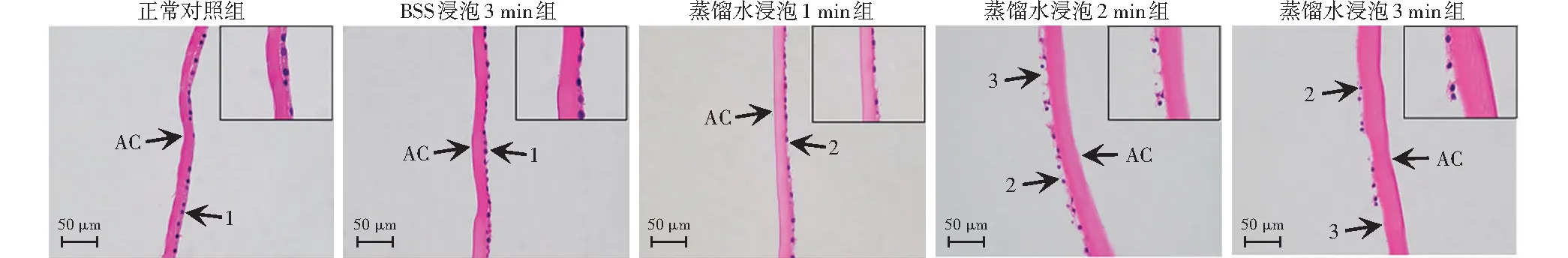
图 4 光学显微镜下各组LECs形态变化(HE ×400,标尺=50 μm) 蒸馏水浸泡1、2和3 min组细胞完整性破坏,细胞内物质外流;蒸馏水浸泡2 min和3 min组部分LECs脱落 AC:前囊膜;1:正常LECs;2:细胞溶解;3:LECs脱落 BSS:平衡盐溶液

图5 透射电子显微镜下各组LECs超微结构变化(柠檬酸铅+醋酸双氧铀 ×8 000,标尺=2 μm;×20 000,标尺=1 μm) 蒸馏水浸泡1 min、2 min组可见细胞溶解,细胞核形态尚规则,亚细胞器肿胀,细胞间连接中断,细胞与囊膜间附着疏松。蒸馏水浸泡3 min组细胞体积减小,细胞核变形,亚细胞器肿胀,细胞间连接破坏,部分细胞从囊膜上分离 N:细胞核;C:细胞质;1:正常LECs间连接呈指状突起;2:正常线粒体;3:正常溶酶体;4:细胞器肿胀
3 讨论
本研究采用锥虫蓝-伊红染色和显微镜下拍照对LECs密度、死亡数和死亡率进行了精确计算和定量分析,更全面地评估了蒸馏水对LECs活性的影响[18]。活细胞具有排除锥虫蓝的完整细胞膜,而死亡细胞则没有,基于此原理,锥虫蓝是常用的检测细胞活力的方法之一[19-20]。苏木精-伊红染色适合于组织学分析,伊红可以将细胞质染成红色,清晰显示细胞轮廓[21-22]。已发生白内障的LECs密度差异很大,平均约为4 000/mm2[23]。本研究正常对照组LECs密度为(3 829.08±519.16)个/mm2,与Laspias等[23]的研究结论相似,因此,本研究计算方法可认为是可靠的。
本研究定量分析显示,蒸馏水浸泡3 min后LECs死亡率约为70.05%,是蒸馏水浸泡1 min组的2.35倍,这一结果与Rekas等[24]的蒸馏水浸泡3 min有70.8%的细胞溶解结果相似。本研究同时设置了正常对照组及相同作用时间的BSS组与蒸馏水浸泡组进行比较,结果表明在蒸馏水中浸泡2 min或3 min可有效导致LECs死亡,蒸馏水浸泡3 min的效果最好。但Duncan等[25]的研究中,FHL124细胞暴露于蒸馏水中2 min后有50%的细胞存活,这可能与实验方法和计数方法不同有关。Rabsilber等[26]研究认为,使用蒸馏水处理并不能显著减轻PCO的发展,与本研究结论不同。这可能是由于蒸馏水的作用时间不足造成的。
白内障手术过程中,需用I/A冲洗整个囊袋,以去除晶状体皮质和黏弹剂。因此,可考虑在吸除晶状体皮质后采用蒸馏水联合囊袋冲洗,既可以充分发挥蒸馏水对LECs的破坏作用,又可以将蒸馏水冲出囊袋,同时清除与囊膜连接松散的细胞。本研究中采用70 cm高处BSS冲洗囊膜1 min模拟白内障术中I/A操作,结果显示蒸馏水浸泡结合冲洗有助于LECs清除,最有效的暴露时间为3 min。有研究认为360°前囊膜抛光并不能降低PCO的发生率[27],这意味着单独的机械前囊膜抛光不能清除囊袋中的所有LECs。而本研究结果显示低渗蒸馏水浸泡联合冲洗可以有效清除LECs。
为使蒸馏水对眼内其他组织的危害降至最低,可能需要加用保护措施。密闭囊袋灌洗装置可暂时封闭囊袋以保护眼内组织,并可将药液注入及冲洗出囊袋[6]。Rękas等[28]在人眼白内障手术中吸除晶状体皮质后,借助密闭囊袋灌洗装置将蒸馏水注入囊袋,停留3 min后冲洗囊袋,结果显示该方法可有效降低晶状体囊膜混浊发生率。但密闭囊袋灌洗装置不适用于深前房或小瞳孔者[26],不适合微切口(1.8 mm或2.2 mm)白内障手术[12]。在去除细胞核和皮质抽吸后,Zhang等[12]在玻璃体切割机辅助下,用空气和黏弹剂维持前房并封闭囊袋,吸除晶状体皮质后向囊袋注入蒸馏水或BSS,停留3 min后冲洗囊袋,术后随访发现BSS组患者部分发生晶状体囊膜混浊,而蒸馏水组患者无明显晶状体囊膜混浊形成。但此方法对手术设备要求高,难以在基层医院推广。蒸馏水浸泡联合冲洗可有效清除LECs,从而预防术后PCO的发生,本课题组正在进行后续临床试验,并将介绍一种方便的给药方式,以便于该方法的广泛传播和利用。
细胞死亡有坏死和凋亡2种方式。坏死是指细胞受到物理、化学因素影响后的被动死亡,以细胞质膜和核膜破裂、细胞骨架和核纤层解体为特征。本研究结果显示,蒸馏水浸泡可导致LECs死亡并清除LECs。采用苏木精-伊红染色后光学显微镜下观察结果显示,在蒸馏水浸泡2 min和3 min亚组中LECs细胞溶解被破坏和部分脱落。在Rekas等[24]的研究中,显微镜下可偶见基底膜和LECs,与本研究光学显微镜下观察结果相同。透射电子显微镜下观察结果显示,蒸馏水浸泡组LECs破坏,蒸馏水浸泡1 min组和2 min组细胞与囊膜之间连接松散,蒸馏水浸泡3 min组LECs与囊膜部分分离。核固缩是细胞坏死的重要标志之一,可以在蒸馏水浸泡3 min组透射电子显微镜下观察到。在每个处理时间的蒸馏水组的光学显微镜和透射电子显微镜结果中可以观察到细胞质破坏和肿胀,这是细胞器坏死的另一个标志。因此,可以得出蒸馏水可以导致LECs坏死的结论。而且本研究结果表明,蒸馏水不仅可以导致LECs死亡,还可以使细胞与囊膜之间的连接变得松散,从而使LECs从囊膜上脱落。因此,蒸馏水浸泡组的细胞脱落百分率升高。这些组织细胞学表现与锥虫蓝-伊红染色结果显示的LECs脱落百分率的结果相一致。
本研究仍存在一定的局限性:(1)虽然蒸馏水可以导致LECs死亡,但还不足以清除所有LECs;对此,我们考虑蒸馏水经常作为溶剂存在,是否可以尝试联合其他药物以更充分地破坏LECs?(2)本研究结果显示冲洗可以提高细胞脱落百分率,但并不能达到百分之百,可能是因为冲洗过程中囊膜的部分折叠。(3)本研究的材料为前囊膜,而赤道部囊膜的LECs形态和功能与前囊膜并不相同[29],因此,需要进一步的动物实验来探讨蒸馏水对赤道部囊袋LECs的清除效果。(4)蒸馏水处理后LECs的组织病理学改变显示细胞坏死,提示蒸馏水除低渗机制外还有其他作用机制。这些方面均有待进一步研究。
本研究证实蒸馏水处理后可导致LECs死亡,蒸馏水浸泡联合冲洗是清除LECs以预防白内障术后晶状体囊膜混浊的有效方法。蒸馏水处理后的细胞组织病理学变化提示细胞坏死是LECs死亡的原因之一。本研究结果为采用蒸馏水预防白内障术后晶状体囊膜混浊提供了理论依据。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明张文文:设计实验、实施研究、采集数据、统计分析、文章撰写;张荣沛:设计实验、实施研究、采集数据、统计分析;刘亚军、何自芳、张司:实施研究、采集分析数据;解正高:设计实验、指导研究、对文章的知识性内容作批评性审阅

