长链非编码RNA Neat1对紫外线B诱导人晶状体上皮细胞焦亡的抑制作用及其机制
王敏 王妍茜 陈颖 赵越越 杨涛 康刚劲
西南医科大学附属医院眼科,泸州 646000
年龄相关性白内障是造成视力损害和盲的主要原因之一,既往已有研究证实,晶状体上皮细胞(lens epithelial cells,LECs)凋亡参与了白内障的形成[1]。日光紫外线辐射作为不可避免的环境和物理因素,是导致白内障发生的重要原因之一[2-4],其中紫外线B对白内障的影响最为重要[5]。近年来研究发现,紫外线B照射还可使LECs发生焦亡,从而导致白内障形成[6]。焦亡在1922年首次被发现并正式命名[7]。目前在心肌梗死、肾炎、创伤性脑损伤、急性肝损伤、糖尿病肾病、阿尔茨海默病等疾病中均发现有焦亡参与[8]。近年来亦有研究表明,年龄相关性黄斑变性、白内障、干眼、蚕食性角膜溃疡和青光眼的形成中也有焦亡的参与[9-11]。细胞焦亡有经典和非经典2种途径:(1)经典途径 核苷酸结合寡聚化结构域样受体蛋白3(nod-like receptor protein 3,NLRP3)参与且依赖胱天蛋白酶1(cysteine aspartic acid specific protease-1,caspase-1)的焦亡经典途径目前研究较多也较成熟;(2)长链非编码RNA(long noncoding RNA,LncRNA)核旁斑长点组装转录本1(nuclear enrichment abundant transcript 1,Neat1)途径 LncRNA是一类长度大于200个核苷酸且不具有编码蛋白质能力的RNA,调控许多生物学过程[12-13]。近来有研究显示,Neat1参与H2O2诱导的LECs凋亡和LECs的上皮-间质转化[7,14],还可调控caspase-1介导的细胞焦亡,但其是否参与了LECs细胞焦亡目前尚不清楚,我们推测LECs发生焦亡可能与Neat1的表达相关。本研究拟探讨Neat1对紫外线照射诱导LECs焦亡的作用及机制,以期为延缓年龄相关性白内障的发生和发展提供新的研究方向。
1 材料与方法
1.1 材料
1.1.1细胞来源 人晶状体上皮细胞系HLE-B3购自美国菌种保藏中心。
1.2 方法
1.2.1细胞培养及紫外线B照射 HLE-B3细胞培养于含体积分数10%胎牛血清的低糖DMEM培养基中,置于37 ℃、含体积分数5% CO2的培养箱内培养,隔天换液,待细胞生长至对数生长期时进行传代。将细胞暴露于辐照峰为297 nm且光谱波长为280~320 nm的紫外线灯下,调整高度,使照射强度为2 W/m2,分别照射细胞0、2、4、8 h。
1.2.2Western blot法检测照射不同时长细胞中caspase-1浓度 按照紫外线B照射不同时长处理HLE-B3细胞,磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤细胞3次,吸尽PBS,加入全蛋白裂解液使细胞完全裂解,收集上清液,BCA蛋白定量试剂盒测定蛋白浓度,电泳、转膜,脱脂奶粉封闭1 h,加入caspase-1一抗稀释液(1∶1 000)和GAPDH稀释液(1∶10 000),4 ℃过夜,采用TBST洗涤3次,加入二抗稀释液(1∶10 000)室温孵育30 min,滴加ECL试剂,凝胶成像系统进行显影、拍照。以GAPDH为内参,采用Fusion软件分析各组灰度值。目的蛋白相对表达量=目的条带灰度值/GAPDH条带灰度值。
1.2.3实时荧光定量PCR法检测照射不同时长细胞中Neat1 mRNA相对表达量 收集紫外线B照射后的HLE-B3细胞,采用Trizol试剂盒提取细胞总RNA,逆转录试剂盒转录为cDNA,扩增程序设置如下:95 ℃预变性30 s;95 ℃变性10 s,58 ℃退火30 s,72 ℃延伸30 s,共40个循环。Neat1正向引物序列为5'-AGTGA TGTGGAGTTAAGGCGC-3',反向引物序列为5'-CGGGC TTACCAGATGACCAG-3';GAPDH正向引物序列为5'-CATCATCCCTGCCTCTACTGG-3',反向引物序列为5'-GTGGGTGTCGCTGTTGAAGTC-3'。以GAPDH为内参,采用2-ΔΔCt法计算Neat1 mRNA相对表达量。
1.2.4CCK-8法检测照射不同时长细胞活力 将处于对数生长期的细胞用胰蛋白酶消化混匀后,细胞板计数,调整细胞密度为1×105个/ml,每孔100 μl细胞悬液接种于96孔板中,每组5个复孔,培养箱中过夜,次日吸去培养基,每孔加入40 μl完全培养基,按相应时长进行照射处理,照射结束后,每孔加入10 μl CCK-8溶液,37 ℃培养箱中孵育2 h,采用酶标仪测量波长450 nm处吸光度(absorbance,A)值,计算照射不同时长后的细胞活力值,根据细胞活力值确定UVB的照射时长。细胞活力值(%)=照射不同时间点A值/照射0 hA值×100%。
1.2.5细胞转染及分组 将处于对数生长期的细胞接种于6孔板,细胞密度为1×106个/ml,随机分为阴性siRNA转染组、siRNA Neat1转染组、阴性siRNA转染+照射组和siRNA Neat1转染+照射组,各组均根据siRNA转染试剂盒说明书转染相应试剂24 h,阴性siRNA碱基序列为5'-GGTTGTGAAGGGAGGGAAGG TCCAG-3',siRNA Neat1碱基序列为5'-GAGTCAGG AGGAATAGGCCGCAGCA-3'。其中阴性siRNA转染+照射组和siRNA Neat1转染+照射组转染相应试剂后采用紫外线B照射4 h。收集细胞,用于后续实验。
1.2.6CCK-8法检测各组细胞活力 按照1.2.4方法检测各组细胞A值,计算各组细胞活力值。细胞活力值(%)=各实验组A值/阴性siRNA转染组A值×100%。
1.2.7流式细胞术检测细胞焦亡 收集处理后的各组HLE-B3细胞,PBS清洗2次,用不含EDTA的胰蛋白酶消化,离心半径5 cm,1 000 r/min离心5 min,收集细胞,采用预冷的PBS洗涤细胞2次,每组加入300 μl的1倍结合缓冲液重悬细胞,室温避光加入5 μl膜联蛋白V-异硫氰酸荧光素(annexin V-fluorescein isothiocyanate isomer I,Annexin V-FITC)染液,混匀后避光孵育10 min,加入5 μl碘化丙啶(propidium iodide,PI)染液再次混匀后,避光反应5 min,1 h内上机检测。计算Annexin V-FITC/PI双阳细胞的晚期凋亡率,即为细胞焦亡率。
(3)机会主义。威廉姆森认为机会主义指的是人们出于自身的自利动机以及信息失真的情况下所做出的决策。简言之,机会主义行为是在信息不对称下,人们依靠不完全地信息,从而获取他人不正当利益的行为。合约的行为一旦难以被察觉,以及因果关系复杂时,交易主体就很容易做出机会主义的行为。在退耕还林政策中,地方政府为了实现造林的计划要求,会出现利用植树节造林造假的现象;而农户为了领取相应的造林补贴,也会出现补栽等现象。为了保证政策的实施,政策的制定者不得不采用制定更加严格的制度,或者加大监控的力度,而这样做就会增大政策的交易成本。
1.2.8Western blot法检测各组细胞中caspase-1、GSDMD、NLRP3蛋白表达 按照1.2.2方法检测各组紫外线B照射不同时长处理HLE-B3细胞中caspase-1、GSDMD、NLRP3蛋白表达量,caspase-1、GSDMD、NLRP3一抗稀释比例分别为1∶1 000、1∶1 000和1∶500。
1.2.9ELISA法检测IL-1β质量浓度 将处理后的细胞冰冻溶解,2 000 r/min离心20 min,收集上清液,按照ELISA检测试剂盒说明书进行操作,酶标板中加入稀释后的细胞上清液,加入抗体后封闭,37 ℃孵育1 h后洗涤,加入酶标抗体后,37 ℃孵育30 min,加底物显色后加入终止液,分光光度计450 nm处读数,检测各孔A值。IL-1β浓度与A450值呈正比,通过参考品绘制标准曲线,对照未知样本中A值,计算样本中IL-1β质量浓度。
1.2.10透射电子显微镜下观察各组HLE-B3细胞超微结构变化 将细胞收集后离心,1 000 r/min离心5 min,弃去培养液,加入体积分数3%戊二醛,4 ℃固定过夜,PBS清洗4次,每次静置15 min,质量分数1%锇酸固定液(pH=7.4)室温固定2 h,再次用PBS清洗4次,乙醇脱水后用丙酮置换2次,丙酮与包埋剂混合液浸渍后使用包埋剂包埋,60 nm厚切片,醋酸双氧铀、醋酸铅染色,透射电子显微镜下观察各组HLE-B3细胞超微结构变化。
1.3 统计学方法
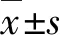
2 结果
2.1 紫外线B照射不同时长后caspase-1蛋白表达比较
随照射时间的延长,caspase-1蛋白表达条带灰度呈递增趋势。照射0、2、4和8 h后caspase-1蛋白相对表达量分别为0.05±0.01、0.25±0.07、0.51±0.04和0.74±0.02,总体比较差异有统计学意义(F=168.223,P<0.001),照射不同时长两两比较,差异均有统计学意义(均P<0.05)(图1)。
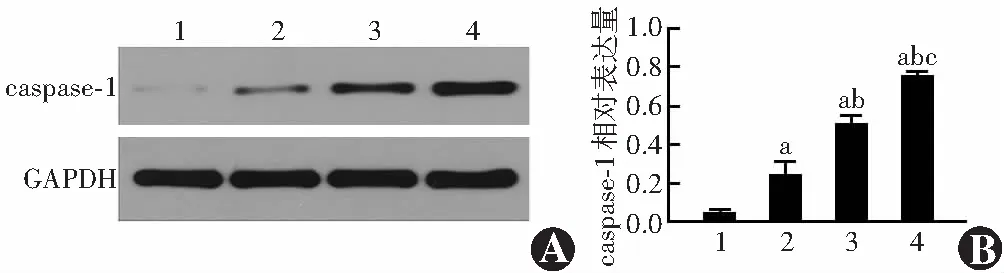
图1 紫外线B照射不同时长后caspase-1蛋白表达量比较 A:照射不同时长后细胞caspase-1蛋白表达电泳图 随照射时间的延长,caspase-1蛋白表达条带灰度呈递增趋势 B:照射不同时长后细胞caspase-1蛋白表达量比较 F=168.223,P<0.001.与照射0 h比较,aP<0.01;与照射2 h比较,bP<0.01;与照射4 h比较,cP<0.01(单因素方差分析,LSD-t检验;n=3) 1:照射0 h;2:照射2 h;3:照射4 h;4:照射8 h caspase:胱天蛋白酶;GAPDH:甘油醛-3-磷酸脱氢酶
2.2 紫外线B照射不同时长后HLE-B3细胞中Neat1 mRNA相对表达量比较
Neat1 mRNA相对表达量随照射时间延长呈递增趋势。照射0、2、4和8 h后Neat1 mRNA相对表达量分别为1.11±0.55、7.52±0.48、11.89±0.50和21.16±2.48,总体比较差异有统计学意义(F=123.105,P<0.001),其中照射不同时长两两比较差异均有统计学意义(均P<0.05)。
2.3 紫外线B照射不同时长后HLE-B3细胞活力比较
倒置显微镜下可见,照射0 h时HLE-B3细胞贴壁良好,呈梭形及多边形,轮廓清晰,细胞饱满,聚集生长;照射2 h后,贴壁细胞数量减少,形态改变,为不规则多边形,细胞密度低于照射0 h;照射4 h后,贴壁细胞数量及密度进一步降低,明显低于照射2 h后,细胞肿胀;照射8 h后,贴壁细胞零星分布,细胞形态不规则,肿胀明显,细胞质不清晰(图2)。照射0、2、4和8 h后细胞活力值分别为(100.00±0.00)%、(89.22±3.26)%、(65.94±9.03)%和(21.50±8.17)%,总体比较差异有统计学意义(F=152.615,P<0.001),其中照射不同时长两两比较差异均有统计学意义(均P<0.05)。考虑到后续实验转染试剂对细胞的毒性作用,故确定紫外线B的照射时长为4 h。
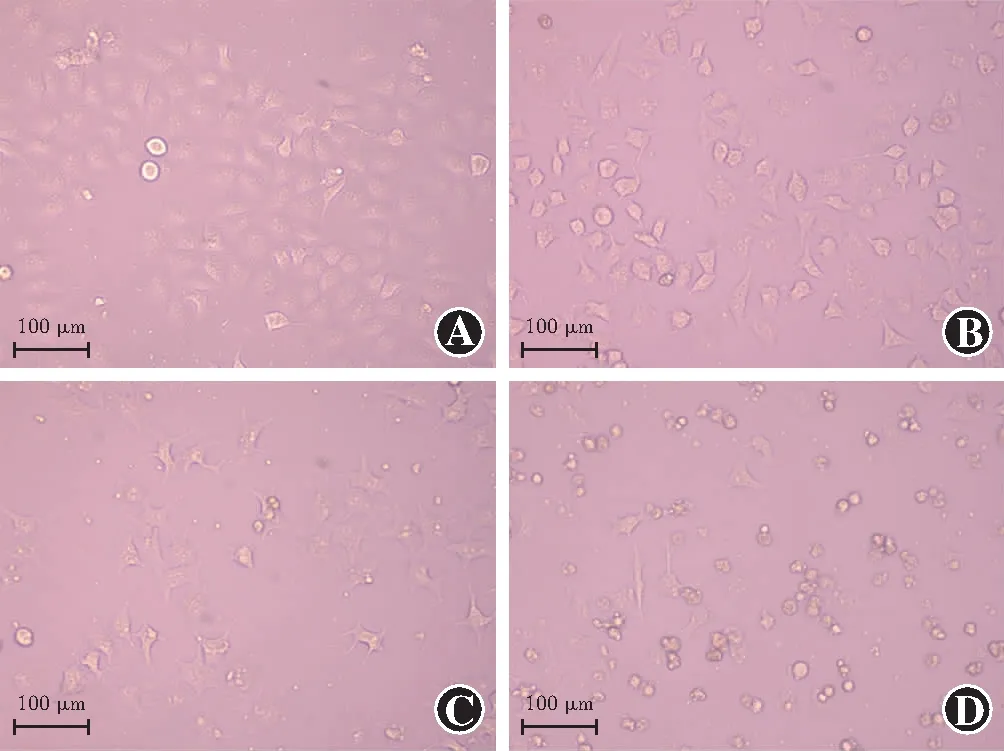
图2 紫外线B照射不同时长后HLE-B3细胞形态(×100,标尺=100 μm) A:照射0 h后 细胞贴壁良好,呈梭形及多边形,细胞饱满,聚集生长 B:照射2 h后 贴壁细胞数量减少,形态改变,为不规则多边形,细胞密度低于照射0 h C:照射4 h后 贴壁细胞数量及密度进一步降低,明显低于照射2 h后,细胞肿胀 D:照射8 h后 贴壁细胞零星分布,细胞形态不规则,肿胀明显,细胞质不清晰
2.4 不同siRNA转染组HLE-B3细胞中细胞活力比较
阴性siRNA转染组、siRNA Neat1转染组、阴性siRNA转染+照射组、siRNA Neat1转染+照射组细胞活力值分别为(100.00±0.00)%、(130.33±8.18)%、(58.66±8.24)%和(77.12±10.69)%,总体比较差异有统计学意义(F=46.417,P<0.001),其中与阴性siRNA转染组比较,siRNA Neat1转染组细胞活力值升高,阴性siRNA转染+照射组降低,差异均有统计学意义(均P<0.01);与阴性siRNA转染+照射组比较,siRNA Neat1转染+照射组细胞活力值升高,差异有统计学意义(P<0.05)(图3)。
图3 各组HLE-B3细胞活力值比较 F=46.417,P<0.001.与阴性siRNA转染组比较,aP<0.01;与阴性siRNA转染+照射组比较,bP<0.05(单因素方差分析,LSD-t检验;n=3) 1:阴性siRNA转染组;2:siRNA Neat1转染组;3:阴性siRNA转染+照射组;4:siRNA Neat1转染+照射组
2.5 不同siRNA转染组HLE-B3细胞焦亡率比较
阴性siRNA转染组、siRNA Neat1转染组、阴性siRNA转染+照射组和siRNA Neat1转染+照射组HLE-B3细胞焦亡率分别为(4.60±0.09)%、(2.74±0.03)%、(25.80±1.67)%和(10.73±1.01)%,总体比较差异有统计学意义(F=333.868,P<0.001),其中阴性siRNA转染组和siRNA Neat1转染+照射组细胞焦亡率明显低于阴性siRNA转染+照射组,差异均有统计学意义(均P<0.01)。siRNA Neat1转染组细胞焦亡率略低于阴性siRNA转染组,差异无统计学意义(P>0.05)(图4)。

图4 各组细胞焦亡情况 A:各组细胞焦亡流式细胞图 B:各组细胞焦亡率比较 F=333.868,P<0.001.与阴性siRNA转染组比较,aP<0.01;与阴性siRNA转染+照射组比较,bP<0.01(单因素方差分析,LSD-t检验;n=3) 1:阴性siRNA转染组;2:siRNA Neat1转染组;3:阴性siRNA转染+照射组;4:siRNA Neat1转染+照射组
2.6 不同siRNA转染组HLE-B3细胞中caspase-1、NLRP3、GSDMD蛋白相对表达量比较
阴性siRNA转染组、siRNA Neat1转染组、阴性siRNA转染+照射组和siRNA Neat1转染+照射组细胞中caspase-1、NLRP3和GSDMD蛋白相对表达量总体比较,差异均有统计学意义(F=64.562、37.885、40.949,均P<0.001),其中阴性siRNA转染+照射组caspase-1、NLRP3、GSDMD蛋白相对表达量均高于阴性siRNA转染组,差异均有统计学意义(均P<0.01);siRNA Neat1转染+照射组HLE-B3细胞caspase-1、NLRP3、GSDMD蛋白相对表达量均低于阴性siRNA转染+照射组,差异均有统计学意义(均P<0.01);siRNA Neat1转染组与阴性siRNA转染组caspase-1、NLRP3、GSDMD蛋白相对表达量比较,差异均无统计学意义(均P>0.05)(图5,表1)。
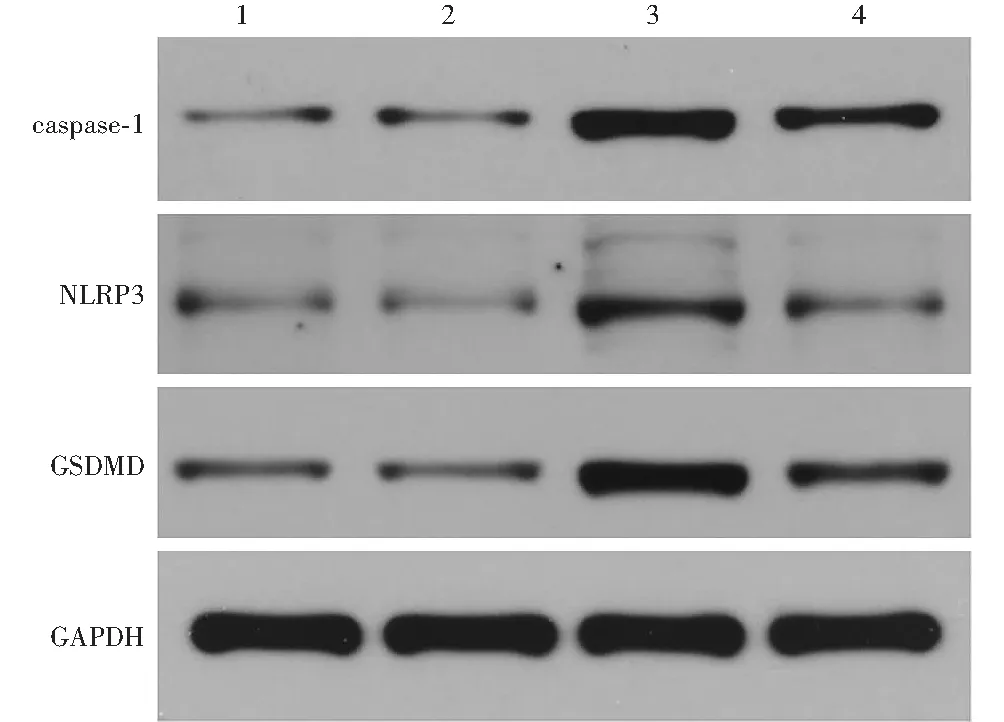
图5 各组细胞caspase-1、NLRP3和GSDMD蛋白表达电泳图 siRNA Neat1转染+照射组caspase-1、NLRP3、GSDMD蛋白条带灰度弱于阴性siRNA转染+照射组,强于siRNA Neat1转染组;阴性siRNA转染+照射组3种焦亡相关蛋白条带灰度均强于阴性siRNA转染组;siRNA Neat1转染组与阴性siRNA转染组caspase-1、NLRP3、GSDMD蛋白条带灰度均无明显差异 1:阴性siRNA转染组;2:siRNA Neat1转染组;3:阴性siRNA转染+照射组;4:siRNA Neat1转染+照射组 caspase:胱天蛋白酶;NLRP:核苷酸结合寡聚化结构域样受体蛋白;GSDMD:gasdermin D蛋白;GAPDH:甘油醛-3-磷酸脱氢酶
2.7 不同siRNA转染组HLE-B3细胞中IL-1β质量浓度比较
阴性siRNA转染组、siRNA Neat1转染组、阴性siRNA转染+照射组和siRNA Neat1转染+照射组HLE-B3细胞中IL-1β质量浓度分别为(19.29±1.41)、(16.80±1.29)、(66.59±8.11)和(31.10±4.74)pg/ml,总体比较差异有统计学意义(F=68.851,P<0.001),其中与阴性siRNA转染+照射组相比,阴性siRNA转染组和siRNA Neat1转染+照射组IL-1β质量浓度明显降低,差异均有统计学意义(均P<0.05);siRNA Neat1转染组IL-1β质量浓度略低于阴性siRNA转染组,差异无统计学意义(P>0.05)(图6)。
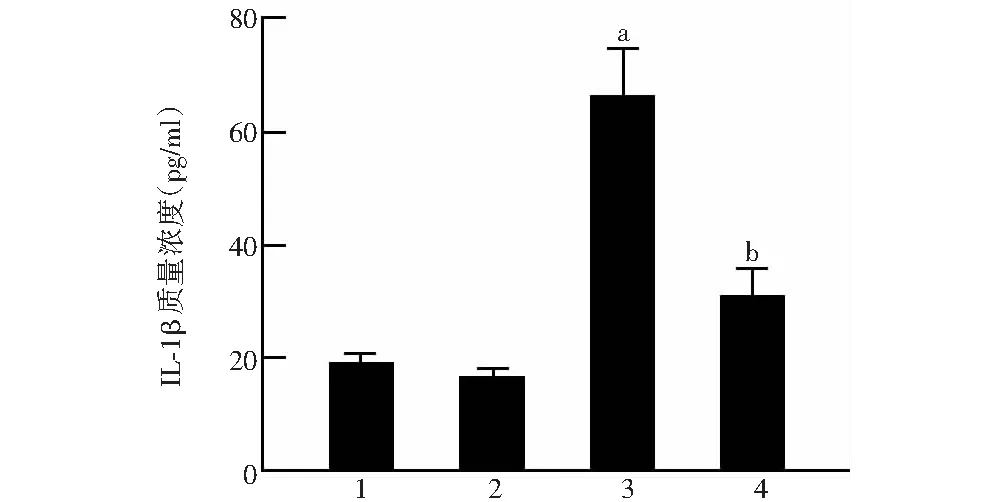
图6 各组细胞中IL-1β质量浓度比较 F=68.851,P<0.001.与阴性siRNA转染组比较,aP<0.05;与阴性siRNA转染+照射组比较,bP<0.01(单因素方差分析,LSD-t检验;n=3) 1:阴性siRNA转染组;2:siRNA Neat1转染组;3:阴性siRNA转染+照射组;4:siRNA Neat1转染+照射组 IL:白细胞介素
2.8 不同siRNA转染组HLE-B3细胞超微结构比较
透射电子显微镜下观察可见,阴性siRNA转染组和siRNA Neat1转染组细胞肿胀不明显,细胞膜完整,线粒体大小正常,线粒体嵴清晰;阴性siRNA转染+照射组和siRNA Neat1转染+照射组细胞肿胀,细胞膜孔隙形成,线粒体肿胀,呈空泡状,线粒体嵴模糊,其中与阴性siRNA转染+照射组相比,siRNA Neat1转染+照射组细胞肿胀程度减轻,细胞膜孔隙减少,线粒体肿胀程度亦减轻(图7)。
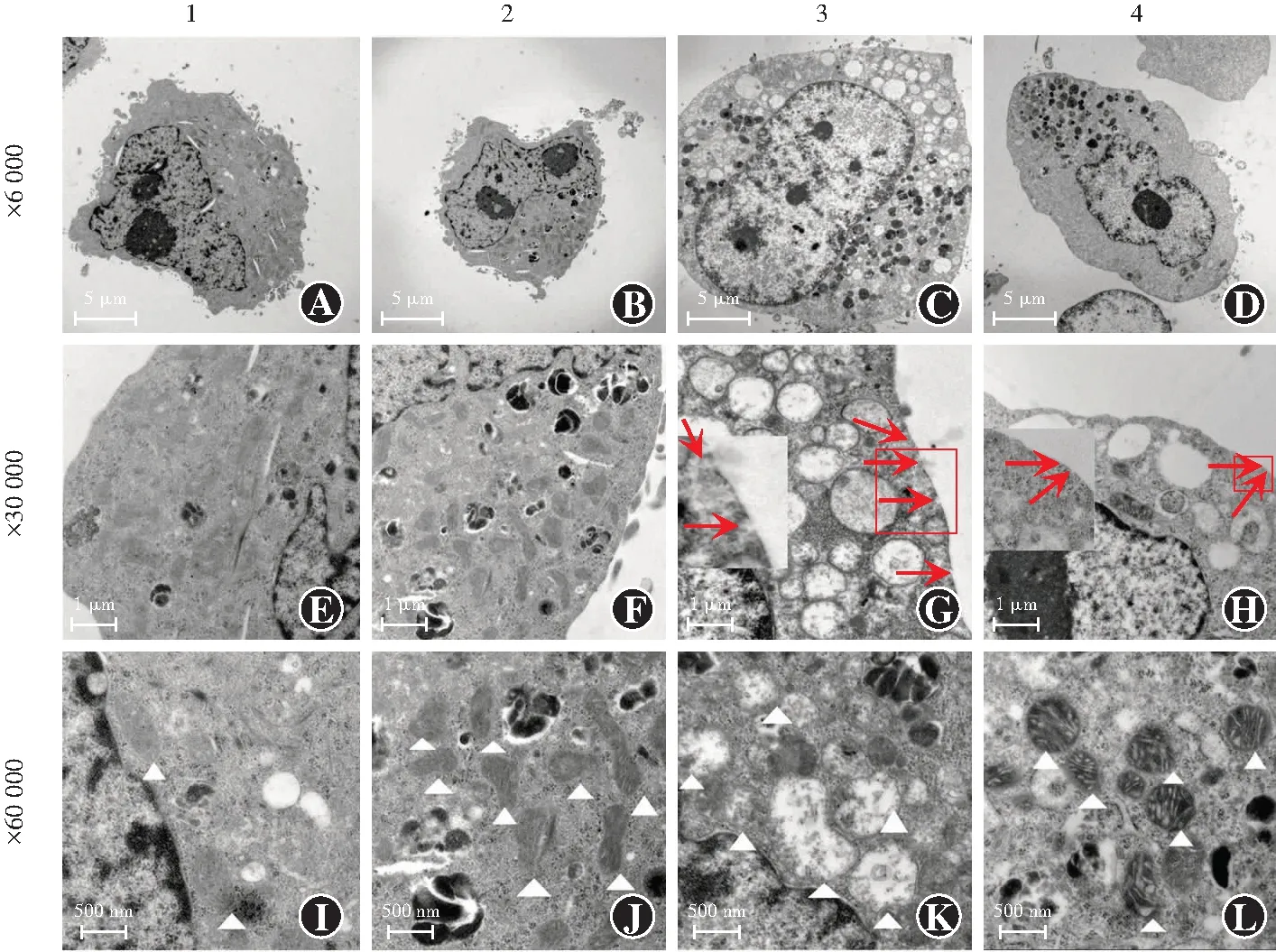
图7 透射电子显微镜下各组细胞形态变化(醋酸双氧铀+醋酸铅) A~D:siRNA Neat1转染+照射组细胞肿胀,程度较阴性siRNA转染+照射组轻(×6 000,标尺=5 μm) E~H:siRNA Neat1转染+照射组细胞膜孔隙(红色箭头)形成,但较阴性siRNA转染+照射组减少(×30 000,标尺=1 μm) I~L:阴性siRNA转染+照射组线粒体(白色三角)肿胀明显,呈空泡状,线粒体嵴模糊,siRNA Neat1转染+照射组线粒体肿胀程度较阴性siRNA转染+照射组明显减轻(×60 000,标尺=500 nm) 1:阴性siRNA转染组;2:siRNA Neat1转染组;3:阴性siRNA转染+照射组;4:siRNA Neat1转染+照射组
3 讨论
焦亡是一种由caspase介导,异于凋亡和坏死的细胞程序性死亡。Duprez等[15]认为caspase-1是一种炎性caspase,调控细胞焦亡途径,不参与凋亡过程。Wang等[16]在紫外线照射诱导白内障形成的动物模型中发现细胞焦亡参与了白内障的发生。本研究团队既往研究发现,雌激素对LECs的保护机制与抑制LECs焦亡过程相关,并且有经典途径的参与[17]。LncRNA是一种非蛋白编码的转录单元,可调节基因转录、mRNA加工、运输等多种生物过程。研究发现,Neat1可促进caspase-1依赖的细胞焦亡[13],且在年龄相关性白内障组织中的表达增加[7]。本研究结果显示,紫外线B照射HLE-B3细胞后caspase-1表达增加,证明HLE-B3细胞焦亡模型诱导成功,并且随紫外线照射时间延长,Neat1的表达也增加,由此推测Neat1可能参与了紫外线B诱导的HLE-B3细胞焦亡。
在细胞焦亡发生的2种途径中,经典途径是细胞在外界刺激下,NLRP3等模式识别受体与有caspase激活募集域(caspase activation and recruitment domain,CARD)的凋亡相关微粒蛋白(apoptosis-associated speck-like protein containing CARD,ASC)、caspase-1前体结合形成NLRP3炎性小体,NLRP3炎性小体剪切激活caspase-1前体,生成活性caspase-1,caspase-1激活后切割GSDMD,生成N端结构域和C端结构域,GSDMD的活性N端异位到细胞膜,形成跨膜孔[18],IL-1β、IL-18等因子从胞内释放,引发炎症反应,最终导致细胞肿胀、破裂[19]。非经典途径由脂多糖直接激活caspase-4/5/11,活化后的caspase-4/5/11作用于GSDMD导致其活化裂解,膜孔形成,引起焦亡[20]。焦亡与凋亡形态学特征不同,焦亡发生时离子内流、细胞肿胀、膜孔形成,线粒体去极化,染色质凝集,而凋亡时细胞膜完整[21]。Neat1可与caspase-1前体P20结构域结合,促进NLRP3炎症小体的组装,增加caspase-1蛋白酶活性,促进细胞焦亡[13]。细胞焦亡时,细胞膜孔隙形成,Annexin V-FITC与PI进入细胞,细胞膜内磷酯酰丝氨酸与Annexin V-FITC结合从而染色,DNA与PI结合从而染色,因此Annexin V-FITC/PI双阳的晚期凋亡可认为是细胞焦亡。
本研究发现,转染阴性siRNA的HLE-B3细胞经紫外线B照射后细胞肿胀程度高、线粒体去极化及膜孔形成均较多。但转染特异性siRNA Neat1沉默Neat1后,紫外线B照射的HLE-B3细胞肿胀程度、线粒体去极化程度及膜孔形成均减轻,并且细胞活力和细胞焦亡率均明显降低,表明Neat1确实参与了紫外线B诱导的HLE-B3细胞焦亡,沉默Neat1可以抑制焦亡发生,维持HLE-B3细胞形态。Caspase-1、NLRP3和GSDMD是细胞焦亡经典途径的相关蛋白,本研究结果显示,沉默Neat1后再经紫外线B照射的HLE-B3细胞中caspase-1、NLRP3和GSDMD表达下调,且细胞因子IL-1β分泌量减少,表明siRNA Neat1沉默Neat1抑制HLE-B3细胞焦亡可能有caspase-1依赖的焦亡经典途径的参与。
Neat1主要分布在细胞核,在胃癌、食管癌、肺癌、结肠癌、肝癌等许多恶性肿瘤中高表达[22],同时也可以促进视网膜细胞及LECs的上皮-间质转化[14,23]。本研究结果显示,Neat1通过caspase-1介导的焦亡经典途经参与紫外线B诱导的人LECs焦亡,沉默Neat1可以抑制LECs焦亡,维持LECs形态,推测沉默Neat1可能延缓白内障的发生。但本研究仅探讨了Neat1参与的经典焦亡途径,尚未研究具体经何种信号通路介导,因此,未来的研究将进一步探索Neat1/caspase-1通路的上下游调控网络,进而为预防白内障的形成提供新的治疗靶点。
利益冲突所有作者均声明不存在任何利益冲突
作者贡献声明王敏:酝酿和设计实验、实施研究、采集数据、统计分析、分析/解释数据、起草及修改文章;王妍茜:酝酿和设计实验、分析/解释数据、对文章的知识性内容作批评性审阅及指导;陈颖:酝酿和设计实验、实施研究、分析/解释数据、对文章的知识性内容作批评性审阅;赵越越:实施研究、分析/解释数据;杨涛:分析/解释数据;康刚劲:酝酿和设计实验、分析/解释数据、对文章的知识性内容作批评性审阅及定稿

