水稻致死突变体基因克隆与分子机制研究进展
夏小东,张晓波,施勇烽,许如根
(1.扬州大学 农学院,江苏 扬州 225009; 2.中国水稻研究所,浙江 杭州 311401)
水稻全基因组测序完成极大地推动了功能基因组学研究。水稻突变体作为重要的遗传材料,在水稻功能基因组学研究中,发挥了重要作用。叶片是水稻进行光合作用的主要场所,水稻叶色突变包括黄化、白化、条纹、淡绿等,研究者通过物理诱变和化学诱变等方法处理水稻,获得了大量的叶色突变体。对水稻叶色突变体的研究有助于对叶片光合作用机制的剖析。衰老是植物生长发育必经阶段,主要由内部和外部信号所引发,且伴随着生理生化的改变,而早衰是非正常的衰老,往往会对植物造成伤害,产生斑点叶和黄化等表型,导致作物籽粒最终产量损失,品质下降。
水稻致死突变体主要包括叶色突变体和早衰突变体两大类。目前,国内外的科学家克隆了大量叶色基因,这些基因主要涉及叶绿素合成与代谢、叶绿体发育等。水稻早衰表现出叶绿素降解、光合作用速率下降、细胞结构遭到破坏、活性氧大量积累,甚至抗氧化酶活性降低等生理特性变化[1],使植物细胞死亡,植物器官或组织凋零,最终导致植株过早衰老甚至死亡。水稻中的转录因子、激素代谢、蛋白质代谢等途径都可能影响早衰的发生。延迟叶片衰老对产量和品质有积极作用。
1 水稻白化致死突变基因的克隆
水稻叶片白化致死基因很多,包括细胞核基因、细胞质基因和核-质互作基因,多数突变由1对隐性核基因控制。截至2022年4月,有127个控制水稻叶色的基因被克隆,其中,叶片白化致死基因有13个,分布在第1、2、3、5、6、7、9、10、11号染色体上(表1)。

表1 已克隆的水稻白化致死基因Table 1 Albino lethal genes cloned from rice
2 水稻白化致死突变基因的分子调控机制
2.1 参与光合色素生物合成与降解
植物的光合作用在叶绿体中完成,需要叶绿素(包括叶绿素a和叶绿素b)和类胡萝卜素的参与。叶绿素合成始于谷氨酰-tRNA,终于叶绿素a和b的合成,需要27个基因编码的15种酶参与[14]。叶绿素的生物合成主要包括2个过程:一是由δ-氨基乙酰丙酸在叶绿体基质生成原卟啉Ⅸ(protoporphyrin Ⅸ);二是由原卟啉Ⅸ与镁离子螯合,经过多个膜结合酶催化反应生成叶绿素[15]。镁离子螯合酶是一个依赖ATP的异源聚合酶,由I(40 ku)、D(70~80 ku)和H(140 ku)3个亚基组成,突变植株叶片呈现黄化[16]或者白化表型[17],甚至导致植株死亡。Zhang等[17]对一个叶绿素缺乏的突变体——白化叶致死突变体(ell)进行了研究,突变体叶绿素含量约为野生型的1%,叶绿体发育完全受阻,未见类囊体结构;并在OsCHLI(镁螯合酶Ⅰ亚基编码基因)中发现1个单碱基突变,导致1个高度保守区域的氨基酸发生改变;突变体中原卟啉Ⅸ含量较高,而镁原卟啉Ⅸ含量较低,引入外源OsCHLI基因能够恢复突变体叶绿体损伤;突变引起了光合作用相关的核和质体基因的转录下调,阻断了OsCHLI和OsCHLD之间的内在相互作用;此外,OsCHLI还与硫氧还蛋白(TRXs)发生物理作用,表明在单子叶和双子叶植物中Mg-螯合酶活性具有相似的调节机制。
八氢番茄红素脱氢酶(PDS)、ζ-胡萝卜素脱氢酶(ZDS)、类胡萝卜素异构酶(CRTISO)和番茄红素β-羟化酶(β-LCY)是水稻类胡萝卜素生物合成途径中的关键酶[11,18]。ALE1编码一个ζ-胡萝卜素脱氢酶,参与类胡萝卜素的生物合成,在水稻叶绿体发育和植株生长中起着重要作用[11]。ale1突变体叶片呈现白化表型,叶绿体类囊体发育不良,光合色素含量下降,活性氧积累,导致ale1在3周内死亡。
2.2 叶绿体发育相关基因
叶绿体是植物进行光合作用的主要场所,是一种含有遗传物质的半自主细胞器,由双层膜包裹的前质体发育而来。叶绿体的发育通常包括质体的复制和质体DNA合成、叶绿体遗传系统建立、叶绿体光合作用系统建立3个阶段,任何阶段表达异常都有可能造成叶绿体发育异常,甚至导致植株死亡。
2.2.1 质体转录复合物参与叶绿体的发育
科学家已经在水稻中鉴定了一些质体基因编码的RNA聚合酶(plastid-encoded RNA polymerase,PEP)复合物,这类质体RNA聚合酶是成熟叶绿体中占主导地位的RNA聚合酶,由核心亚基和外周亚基组成,外周亚基在PEP活性控制中具有重要作用。WSL3基因编码水稻PEP复合物关键外周亚基OsPAP1/OspTAC3,水稻wsl3突变体缺乏1个外围亚基,白化致死,表现出典型的质体编码基因表达模式,提示PEP活性受损,WSL3定位于叶绿体,与PEP复合物亚基相互作用,对叶绿体的早期发育至关重要[13]。OspTAC2编码一个含有10个PPR(pentatricopeptide repeat)结构域的叶绿体蛋白,在叶绿体发育中起关键作用,osptac2突变体呈现白化表型,苗期致死[5]。ASL3编码一个具有10个PPR基序的水稻PPR蛋白,定位于叶绿体,在水稻的早期发育和叶绿体发育中起重要作用,水稻PPR突变体asl3苗期白化致死,asl3突变严重影响了相关重要基因的转录水平、质体的翻译和光合作用,最终导致asl3突变体幼苗死亡[4]。OsPPR6基因位于第5染色体,编码一个定位于质体上的PPR蛋白,OsPPR6通过参与质体基因编码的ndhB转录本编辑和ycf3转录本剪接,调控水稻早期叶绿体生物合成;osppr6突变体不能形成类囊体膜,表现出叶绿体早期发育缺陷,幼苗白化死亡[8]。OsPPR1是核基因,编码PPR蛋白,可能参与叶绿体的形成;OsPPR1主要在水稻叶片中积累,反义转基因水稻表现出典型的叶绿素缺陷型突变型,白化致死[12]。OsTRXz编码一个Z型硫氧还蛋白,OsTRXz与2个果糖激酶FLN1 和HSA1/FLN2 互作,参与PEP 复合物的形成;Ostrxz突变体表现为叶片白化致死[19]。tcm1突变体在低温(20 ℃)下三叶期前表现为白化表型,叶绿体畸形,但在较高温度(>28 ℃)下为正常表型,质体编码依赖聚合酶(PEP)的基因转录水平明显下调,在高温下能部分恢复,这表明TCM1编码一个染色体转录激活复合物(transcriptionally active chromosome,TAC)的叶绿体蛋白,水稻核编码TAC的TCM1蛋白是叶绿体正常发育和低温胁迫下保持PEP活性所必需的[20]。水稻LAS1/OsHMBPP编码HMBPP还原酶,参与催化甲基-D-赤藓醇磷酸盐(MEP)转化为IPP和DMAPP,影响叶绿体核糖体的生物合成,最终影响叶绿体的发育,水稻突变体las1幼苗白化致死;可见,LAS1/OsHMBPP在水稻叶绿体早期发育中发挥了重要作用[6]。核糖体在叶绿体中负责质体编码蛋白质的转录和翻译,是叶绿体发育和植物生长所必需的;水稻ASL4编码的30S核糖体蛋白S1定位于叶绿体,对叶绿体核糖体的合成和叶绿体的早期发育至关重要[7]。
2.2.2 转录后修饰调控叶绿体发育
植物中参与质体基因转录后修饰的蛋白主要有PPR蛋白、MORF(multiple organellar RNA editing factor)蛋白和一些质体基因剪切因子[14]。分子克隆结果表明,AL2编码水稻叶绿体内IIA型内含子剪接促进因子(CRS1),AL2也可能参与叶绿体I型内含子的剪接,破坏AL2的表达导致叶绿体合成相关基因的表达改变,包括叶绿素生物合成基因、质体编码聚合酶和核编码的叶绿体基因,影响多个质体基因内含子剪切;al2突变体早期发育阶段叶绿体结构即遭到破坏,导致整个叶绿体分解,该突变体在发育早期形成明显的白化叶片表型,最终在幼苗期死亡[21]。OsCAF1编码一个含有CRM结构域的叶绿体蛋白,参与atpF、ndhA、ndhB、rpl2、rps12、ycf3共6个质体基因内含子剪切,OsCAF1的C末端与OsCRS2相互作用,OsCAF1-OsCRS2复合物可能参与水稻叶绿体中IIA型和IIB型内含子的剪接;oscaf1突变体叶肉细胞中的叶绿体数量减少,叶绿体结构受损,呈现白化表型,并在苗期死亡[3]。
2.2.3 核质信号转导参与质体发育
质体代谢与发育状态若发生改变,质体与细胞核之间的信号传递反馈使细胞核能够随之做出相应的反应,从而调控细胞核基因的表达。OsGUN4可以与水稻镁离子螯合酶H亚基结合,参与由原卟啉合成镁原卟啉的生物过程,从而调控叶绿素的生物合成,同时,镁-原叶琳IX也是质体与细胞核信号转导过程中的信号分子[15]。
2.2.4 叶绿体蛋白酶调节叶绿体发育
叶绿体蛋白酶在叶绿体的降解中起到了不可替代的作用。叶绿体光系统蛋白的降解需要SPP(stromal processing peptidase,基质加工肽酶)与TPR(thylakoid processing peptidase,类囊体加工肽酶)的参与,而叶绿体中其他蛋白的降解主要依赖于FtsH(filamentous temperature sensitive protein H, 丝状温度敏感蛋白H)和Clp(caseinolytic protease)。质体核糖体蛋白(PRPs)在质体蛋白生物合成、叶绿体分化和叶绿体早期发育中起着重要作用。水稻ASL2基因编码叶绿体核糖体大亚基一个重要组分——50S核糖体蛋白L21(RPL21c),定位于叶绿体中,受光的调控,与叶绿素的生物合成、光合作用和叶绿体发育有关;水稻asl2突变体呈白化表型,苗期死亡,叶片颜色变化与叶绿素含量和叶绿体发育异常有关[22]。
2.2.5 其他叶绿体发育相关基因
叶绿体蛋白的突变可能导致植株叶色异常。氨酰合成酶是蛋白质合成的关键酶,RA1基因编码甘氨酰tRNA合成酶(RA1),RA1定位于叶绿体中,参与叶绿体早期发育和核糖体的合成,缺失RA1导致质体发育障碍;水稻ra1突变体在苗期表现为叶片白化,叶绿体发育异常,叶绿素和类胡萝卜素含量显著降低,类囊体膜结构异常,嗜锇颗粒增加[9]。
2.3 其他途径
叶绿体在植物碳水化合物代谢中起着至关重要的作用。水稻OsBE1基因编码一个糖苷水解酶13家族的蛋白,osbe1突变体叶绿体数量较少,无明显的基质片层结构,幼苗呈现白化表型,且其白化表型不能用外源糖类恢复,最终在三叶期死亡[10]。
3 水稻早衰致死突变的遗传机理与基因克隆
植物衰老是一个非常复杂的过程,受内部因素和外部环境共同影响,也受遗传调控的负影响(图1)[23]。科学家利用各种物理和化学方法,创造了大量水稻叶片早衰相关突变体,定位了大量叶片衰老相关基因(senescence-associated genes, SAGs),包括SMS1[24]、psl2[25]、LAD[26]、MPS1[27]、es5、g398[28]、OsLES[29]、lmes1[30]、LMES2[31]、LTS1[32]、Oswss1[33]、WL4[34]等。
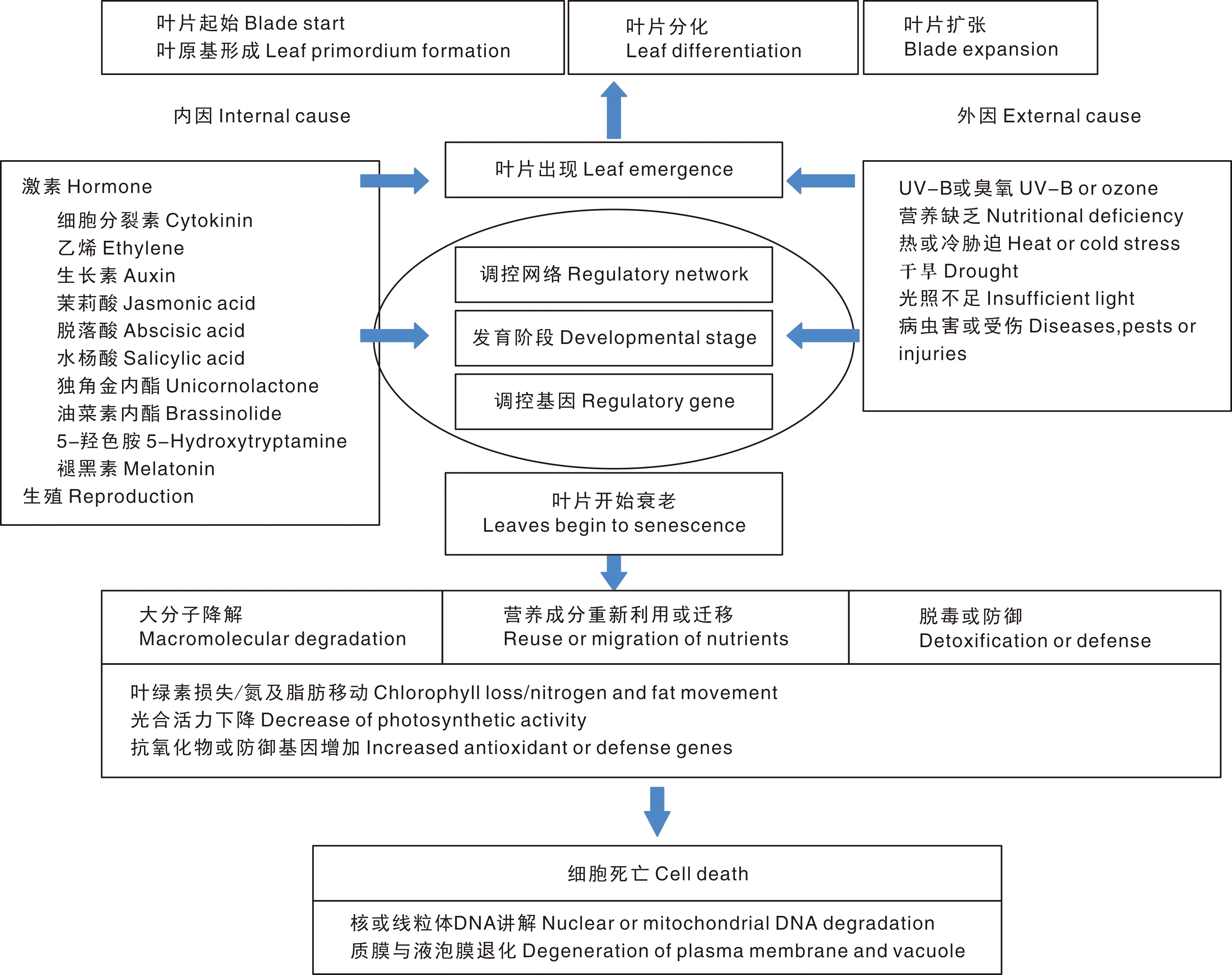
图1 水稻叶片衰老调控途径[23]Fig.1 Mode of regulation approach in rice leaf senescence[23]
3.1 叶绿体的发育和叶绿素降解途径调控早衰
叶绿体的发育和叶绿素降解途径与衰老密切相关。水稻类病变和早衰突变体lms开花后加速衰老,对稻瘟病的抗性增强[35]。水稻Ospse1编码一种果胶酸裂解酶,Ospse1突变体中与衰老相关的基因OsNYC1和OsSgr上调表达,推测ospse1的早衰可能受果胶酸裂解酶介导的机制调控[36]。PLS2/PSL2定位在第3染色体,编码一个糖基转移酶(glycosyltransferases,GTs);pls2突变体中PLS2第9个外显子第41位的C→T发生替换,使精氨酸替换为半胱氨酸,突变体在孕穗期表现早衰,株高下降,节间和穗长缩短,光合能力降低,分蘖数和有效分蘖数减少,穗粒数和结实率明显下降,千粒重降低,穗发育不良,灌浆不充分;叶片的CAT活性显著降低,H2O2积累,死亡细胞增加,叶绿体结构变差,叶绿体中淀粉和嗜锇颗粒增多;黑暗处理加速突变体叶片衰老,叶绿体超微结构球状化[25,37-38]。SPL29编码UDP-N-乙酰基葡萄糖焦磷酸化酶1(UAP1),UAP1参与水稻叶片衰老和防御反应的调控,spl29突变体叶片衰老,叶绿体降解,衰老转录因子和衰老相关基因表达水平上调,光合作用相关基因表达水平下调,对白叶枯病的抗性和防御反应基因表达水平上调,植株中积累茉莉酸和脱落酸[39]。ZS编码细胞色素单加氧酶(P450),zs突变体第2外显子上1个碱基突变导致苏氨酸突变为甲硫氨酸,该基因可能参与调控叶绿素合成和质体的发育[40]。YPD1在叶片中优先表达,编码一个类LRR蛋白YPD1,YPD1定位于叶绿体膜上,可能影响叶绿体发育和叶片衰老;ypd1突变体中YPD1第13外显子发生G→A替换,影响剪接并导致编码蛋白的提前终止,造成叶绿体异常,光合色素水平降低[41]。
3.2 蛋白质的合成、降解和转运途径调控早衰
科学家在水稻中发现了多种参与蛋白质合成、降解、运输途径的基因与植物的早衰致死相关。GnT1编码N-乙酰氨基葡萄糖转移酶,该酶功能缺失使水稻对细胞分裂素的敏感性降低,细胞分裂素信号通路受损;gnt1突变体出苗后发育不良,细胞壁生物合成不完全,导致分蘖失败、叶片变脆、细胞壁厚度减少、纤维素含量降低,最终导致植株在早期死亡[42]。水稻衰老或接种病原体后诱导OsSAG12-1的表达,粳稻品种TP309中获得的OsSAG12-1 RNAi转基因株系表现出不同程度的早衰,接种细菌Xanthomonasoryzaepv.oryzae时死亡细胞增多,表明OsSAG12-1编码OsSAG12-1半胱氨酸蛋白酶前体,是水稻细胞死亡的负调控因子[43]。Osh69编码碱性半乳糖苷酶,在叶片自然衰老过程中上调表达,而且在黑暗、激素(茉莉酸甲酯、水杨酸)、过氧化氢胁迫下也能迅速上调;Osh69特异地定位于衰老叶片的叶绿体中,在叶片衰老过程中叶绿体半乳糖脂的降解中发挥重要作用[44]。psd128突变体从六叶期开始叶片发黄发白,同时产生褐色斑点,抽穗期除剑叶外,其他叶片、茎秆均已枯死;LOC_Os03g05730的编码区(CDS)中第2 347位碱基由C突变成T(C2347T),其编码的蛋白质比野生型减少27个氨基酸残基;OsCDC48编码一个AAA-ATPase酶,OsCDC48突变通过相关激素代谢途径影响psd128突变体对白叶枯病的抗性[45-46]。RLS3编码一个具有AAA+结构域的蛋白质,定位于叶绿体,在维持水稻正常生长中发挥着关键作用;rls3突变体中RLS3基因在第10外显子/第11外显子的剪接位点出现了单核苷酸替换(G→A),导致第11外显子的第1个核苷酸被剪切,使RLS3蛋白翻译提前终止;相比野生型,rls3突变体叶片衰老速度快,株高和穗长更短,结实率低[47]。类病斑和早衰性状均由编码细胞色素P450单加氧酶家族CYP71P1蛋白的SL基因隐性等位基因控制,分蘖期,msl-2突变体叶片出现较大的橙色斑点,抽穗期msl-2植株完全死亡,突变体中叶绿体降解、光合色素含量下降、叶绿体合成/光合相关基因表达下调、衰老相关基因表达上调[48]。
3.3 激素途径调控早衰
在水稻生长发育的过程中,激素起至关重要的调控作用,水稻的衰老也受激素调控。生长素(Auxin)、赤霉素(GA)、细胞分裂素(CTK)抑制水稻叶片衰老,而ABA、ETH、SA、JA和油菜素内酯(BRs)的作用正好相反[49]。HD-Zip Ⅲ成员OsHox33在水稻叶片衰老中起重要作用,源自OsHox33 5′末端区域和3′-UTR的2个特定RNAi载体转基因植株均表现出相似的叶片早衰症状,表明敲除OsHox33基因促进了叶绿体降解,导致水稻叶片早衰;OsHox33可以调节2个衰老相关基因GS1和GS2的表达[50]。
3.4 细胞程序性死亡相关基因对早衰的调控
SPL28编码网格型衔接蛋白复合物1的中间亚基μ1(AP1M1),绿色荧光蛋白SPL28融合蛋白(SPL28::GFP)定位于高尔基体;SPL28似乎参与囊泡转运的调控,SPL28功能障碍导致类HR病斑的形成,使叶片开始衰老;spl28突变体早期发育正常,开花后可溶性叶绿素含量、蛋白质含量、光系统Ⅱ效率显著降低,对稻瘟病和白叶枯病的抗性增强[51]。RLS1编码一个含有NB(核苷酸结合位点)的蛋白,其羧基端有ARM(armadillo)结构域,在暗诱导的叶片衰老过程中,RLS1表达上调,说明RLS1参与叶片衰老过程并且受细胞分裂素诱导下调表达;叶片衰老过程中叶绿素含量的快速降低是导致叶片衰老的主要原因。有趣的是,随着转基因水稻植株叶绿素含量的降低,RLS1的组成性表达也略微加速了叶片衰老;rls1突变体出现了类病斑,早期分散在整个叶片表面,导致早衰[52]。
3.5 转录因子对早衰的调控
转录因子是植物中最大的特异性转录因子家族之一,参与植物的各种生物学过程,包括植物发育、叶片衰老、细胞分裂、木材形成和生物/非生物应激反应[53-54],多个转录因子家族参与衰老调控,包括NAC、WRKY(Zn)、MYB、C2H2(Zn)、AP2/EREBP、HB、bHLH、bZIP、NAC(NAM/ATAF/CUC)等[55]。
PS1编码一个植物特异性NAC转录激活因子OsNAP,过表达OsNAP显著促进衰老,而敲除OsNAP则显著延缓衰老。OsNAP的表达与叶片衰老的发生密切相关,OsNAP通过直接靶向叶绿素降解和营养转运相关基因,以及其他与衰老相关的基因,正向调控叶片衰老;由ABA特异性诱导,OsNAP对ABA生物合成反馈抑制,是ABA和叶片衰老之间的重要环节;此外,OsNAP表达量减少导致叶片衰老延迟和籽粒灌浆期延长,使籽粒产量提高;推测调整OsNAP的表达是未来提高水稻产量的一种有效策略[56]。
3.6 早衰的其他调控基因与调控机理
Ospls1突变体早期幼苗发育正常,但其叶片表现出类病斑和早衰,种子休眠;编码空泡H+-ATPase A1亚基(VHA-A1)的OsPLS1基因中的胞嘧啶缺失导致了该突变体的表型异常;OsPSL1/VHA-A1的转录水平在Ospls1突变体及其野生型中均随叶片衰老而逐渐下降,VHA活性也显著下降,表明正常的OSPLS1/VHA-A1基因在水稻叶片衰老开始过程中起负调控作用;Ospls1突变体中水杨酸和活性氧(ROS)含量较高,并通过上调叶片WRKY基因激活信号转导;上述结果表明,OsPSL1/VAH-A1突变通过ROS和SA信号的组合在叶片早衰中发挥作用[57]。psls1发育到七叶期以后叶片自下而上叶绿素含量下降,叶片逐渐黄化至枯萎,由于PSLS1基因突变使得谷氨酸合酶失活,氮代谢异常而导致突变体psls1早衰[58]。osled突变体受到1个隐性基因调控,OsLED基因 (AK111569,LSD1相关基因)发生2个碱基(AA)缺失,造成移码突变,该基因编码一类锌指蛋白LSD1;osled突变体自分蘖期开始,叶片出现不同程度早衰,生育期更长,植株变矮,穗粒数、千粒重、结实率均显著降低;剑叶、倒二叶和倒三叶的丙二醛(MDA)含量、超氧化物歧化酶(SOD)活性和过氧化物酶(POD)活性显著升高,JA、SA和H2O2抑制突变体植株生长发育[59]。Os03g0131200编码一个过氧化氢酶OsCATC,w330突变体中该基因在第1个内含子的末位发生了一个C到G的替换,造成第1个内含子没有剪切,最终导致翻译提前终止;w330突变体从3叶期开始出现叶片衰老,直至抽穗期、黄熟期,w330株高变矮、分蘖减少、叶片变窄、抽穗期不变,每株有效穗数、每穗着粒数和结实率亦显著降低[60]。
已定位克隆的水稻早衰相关基因见表2。

表2 已定位或克隆的水稻早衰致死基因Table 2 Mapped or cloned premature lethal genes in rice
4 对高光效育种分子机理解析的作用
叶片是植物进行光合作用主要的器官,光合作用是水稻生长发育的生理基础。创制水稻新的叶色突变体,并深入剖析突变叶色背后的分子机制对水稻育种具有重要意义。叶绿体是一个具有复杂结构和功能的亚细胞系统,其发育机制和光合作用的调控网络依然存在许多未知,需要加强水稻叶色基因种质资源的发掘,克隆鉴定更多的叶色基因,并深入探究其作用机制,为培育高光效水稻新品种奠定理论基础。叶色突变体在研究水稻光合作用、叶绿素合成与降解及其生长发育调控机制方面具有重要作用,而且在水稻杂交制种、提高生物量等方面具有较高的实际应用价值。水稻叶色调控机制涉及多个调控途径,包括色素生物合成与降解、质体转录复合物、转录后修饰、核质信号转导、叶绿体蛋白酶,以及转录因子与表观遗传。叶色突变体也可以在育种中得到应用。一些白色条纹与白化转绿突变体在不同生长时期或因温度的变化而呈现出不同的叶色,但主要农艺性状相比野生型并无明显变劣,这些叶色突变体在育种中已广泛应用,如玉兔S、中紫S、白丰A、全龙A等不育系。在水稻中过表达叶绿体基因D1可以提高CO2净同化速率,增加生物量和产量,增幅高达8.1%~21.0%,显示出巨大的育种利用价值[61]。VAL1编码磷酸核糖基胺-甘氨酸连接酶(PurD),参与叶绿体发育、叶绿素代谢和细胞分裂的调控,过表达该基因植株光合能力显著提高,可以将该基因运用到育种中,提高水稻的产量[62]。
长期以来,科学家希望利用筛选出的水稻叶片早衰突变体研究早衰的生理与分子机制,以及延缓叶片衰老的栽培调控途径并提高作物的产量和品质。OsNAP的下调表达可以延缓叶片衰老,使籽粒灌浆期延长,其RNAi株系的籽粒产量提高了10.3%[56]。在暗诱导和自然衰老条件下,Oself3.1突变体衰老延迟,而OsELF3.1过表达植株衰老提前,提示了该基因在育种中的利用价值[63]。SGR是一个与衰老相关的基因,编码一种新的叶绿体蛋白,SGR在转录水平上调控叶绿素的降解,与LHCPII相互作用,SGR诱导LHCPII的分解,进而调控叶绿素的降解,而sgr突变体叶绿素降解延缓,叶片保持绿色[64]。上述突变体在育种中具有较高的价值。
目前,水稻早衰突变体呈黄化、白条纹、斑点叶等表型,一些类病斑突变体[30-31,35]在发育早期发生早衰现象,叶片出现类病斑。接种试验表明,lms突变体相比野生型对稻瘟病菌株非亲和小种的抗性上升;早衰突变体spl29[39]防御信号传导相关基因的表达量上调,对白叶枯病的抗性也明显增强。阐明突变体的分子生物学机制,有助于加深对植株衰老机理的阐释,也具有一定的育种应用价值。
5 问题与展望
水稻叶色突变体是研究水稻叶绿素合成、光合作用和叶绿体发育的理想材料。截至2022年,国内外科学工作者已经克隆鉴定了超过120个叶色基因,并利用分子生物学和基因组学的方法对这些基因的功能进行深入研究,阐明了它们在光合色素合成和叶绿体发育中的功能。一些白条纹转绿叶色突变体作为叶色标记等在杂交制种中得到应用。一些叶色突变体受限于其劣变的农艺性状而未能在生产中得到广泛应用,但这些突变体对于阐明水稻叶色分子调控机制、完善叶绿体发育调控网络和培育高光效作物新品种具有重要意义。
与野生型相比,水稻叶色突变体叶绿素合成途径受阻,光合作用受抑,长势不及野生型,产量下降,但其各异的叶色具有较高的观赏价值,可以发掘其观赏价值,在旅游观光中具有一定的潜力。此外,可以利用传统或者分子生物学的方法将叶色基因转入观赏植物中去,定向创制观赏植物新品种。
水稻衰老的过程非常复杂,多个调控途径涉及水稻衰老进程,到目前为止,其调控网络远未成型。水稻中存在大量的转录因子参与水稻衰老进程的调控,NAC转录因子家族的研究相对完善,形成了相对完整的调控网络。水稻衰老过程中,一些早衰相关基因的敲除有助于延缓水稻衰老进程,从而达到增加生物学产量的目的,但如何有效抑制(敲除)或利用已知早衰基因提高作物产量仍需进一步研究。未来研究中应首先注重不同类型早衰突变体的筛选鉴定,不断发掘早衰相关种质资源,挖掘早衰新基因,通过基因敲除等分子生物学方法,深入剖析调控衰老新基因的功能,不断完善其调控网络。在阐明水稻衰老调控机制的基础上,设计分子和栽培调控植物衰老的策略,发掘其育种和生产价值。
水稻早衰在一定程度上影响稻米品质。目前对于水稻衰老与品质的关系研究较少,且少有涉及其分子机理。在以后的研究中,产量作为最重要的农艺性状之一,在关注产量的同时,稻米品质也应该得到充分的重视。以早衰水稻灌浆期淀粉合成相关酶活性为抓手,深入研究早衰对淀粉理化性质的影响,系统运用分子生物学的方法,调控叶片衰老进程,解决水稻衰老的内部制约因素,有效延缓衰老,为优质抗衰水稻品种的选育提供支撑。
——有效的抗弓形虫药物靶标

