萝卜胞质雄性不育(Ogura CMS)芥菜材料的创制
李崇娟,吕凤仙,杨 鼎,张丽琴,兰 梅,杨红丽,徐学忠,胡靖锋,申时品,吴毓飞,和江明,*,董相书
(1.云南大学 资源植物研究院,云南 昆明 650504; 2.云南省农业科学院 园艺作物研究所,云南 昆明 650205; 3.国家蔬菜改良分中心云南分中心,云南 昆明 650205; 4.镇雄县农业科技推广中心,云南 镇雄 657200)
芥菜(Brassicajuncea,AABB,2n=36)是十字花科芸薹属一种重要蔬菜,由黑芥(Brassicanigra,BB,2n=16)与芸薹(Brassicarapa,AA,2n=20)天然杂交后自然加倍形成的双二倍体进化而来[1]。作为异源多倍体,芥菜的营养器官在自然演变进化和人们的选择驯化栽培过程中发生了多向而强烈的分化,形成了如今的根用、茎用、叶用、薹用4大类16个变种和众多的变异类型[2]。叶用芥菜是其中最为广泛种植的一类,主要用于腌制加工或鲜食,具有重要的经济价值。由于目前叶用芥菜生产上大多以地方品种或者提纯复壮的常规品种为主,存在品种单一、混杂、优良性状退化等问题[3],急需高产优质、性状优良、满足市场生产需求的新品种,来补足目前生产上叶用芥菜品种的短板。利用杂种优势育种是品种改良的有效途径之一,但由于芥菜是常异花授粉作物,与甘蓝和白菜类蔬菜相比,芥菜自交亲和指数高,无法利用自交不亲和系配制杂交种,所以雄性不育材料的利用成为了芥菜优良品种选育的主要途径。
萝卜胞质雄性不育(Ogura cytoplasmic male sterility,Ogura CMS)是Ogura在日本鹿儿岛的一个萝卜群体中发现的天然雄性不育类型[4],其不育度和不育株率均可达100%,且不育性稳定,是目前为止十字花科作物中不育性最彻底的胞质不育源之一,有极高的研究价值[5]。在白菜、甘蓝等蔬菜育种中已被广泛利用,但在芥菜育种中研究报道尚少。
目前,我国叶用芥菜杂种优势育种研究中利用较广泛的细胞质雄性不育类型是hau CMS,华中农业大学利用转育的多个叶用芥菜变种hau细胞质雄性不育系选育出的华芥1号、华芥2号等优良杂交种已在生产上大面积推广应用[6]。但长期使用一种不育细胞质开展杂种优势育种,会造成细胞质单一、负效应增加等问题,创制新的雄性不育源有利于丰富芥菜杂种优势利用途径。Nilornpun等[7]将美国引进的胞质不育源转育到泰国叶芥中,得到的8个叶芥品种均出现苗期低温黄化、蜜腺不发达、雄蕊败育不彻底等问题,未能在生产上大面积推广利用。金海霞等[8]通过种间杂交、多代回交的方式,将白菜的不育胞质转移到叶用芥菜中,育成了5个芥菜雄性不育系。章时蕃等[9]以改良型萝卜胞质大白菜雄性不育系为不育源,成功转育了结球芥和长柄芥不育系。由于芥菜类蔬菜的杂种优势利用相比其他十字花科蔬菜研究起步较晚,目前报道的不育系大多存在育性不稳定、蜜腺不发达等问题[10],创制优良的Ogura CMS芥菜材料成为了选育新品种芥菜的关键。
本试验以课题组选育的新型Ogura CMS白菜为不育源,开展细胞质雄性不育源种间杂交转育的研究,通过远缘杂交和连续回交法,把芥菜的B基因组导入到白菜的不育细胞质中,达到回交核替换的目的,育成雄性不育性稳定、植株形态与轮回亲本相近、有正常结籽能力的芥菜雄性不育材料,以丰富芥菜种资质源,拓宽芥菜杂种优势利用途径,为芥菜类蔬菜品种改良提供理论基础和材料来源。
1 材料与方法
1.1 试验材料
供试的萝卜胞质不育源白菜CCR17001和轮回亲本叶用芥菜JC17000皆由云南省农业科学院园艺所十字花科课题组提供。
1.2 试验方法
1.2.1 远缘杂交与连续回交
远缘杂交:为促使花期相遇,白菜CCR17001于2017年10月上旬播种,芥菜JC17000于15 d后播种。2017年12月初,将材料定植到云南省农业科学院嵩明基地大棚内,进行常规管理。植株现蕾10 d后开始杂交,以CCR17001为母本,JC17000为父本,杂交前2~3 d摘除父母本花序上已开放的花朵,并喷施适量杀虫剂,套以硫酸纸袋隔离。于父本花蕾开放当天上午取花粉授至母本的柱头上,每隔2~3 d重复授粉1次,重复2~3次,以克服远缘杂交的不亲和性。
连续回交:白菜与芥菜杂交后,在田间常规管理,收获杂种F1代种子,于2018年春,与轮回亲本芥菜JC17000进行回交,次年从回交后代中选择表现为雄性不育的植株,再与轮回亲本回交,如此连续回交多年,同时适当进行加代繁殖,至2022年春季完成5个世代的回交转育,逐步将胞质不育源材料的核基因替换为芥菜核基因,得到胞质不育芥菜。转育模式见图1。
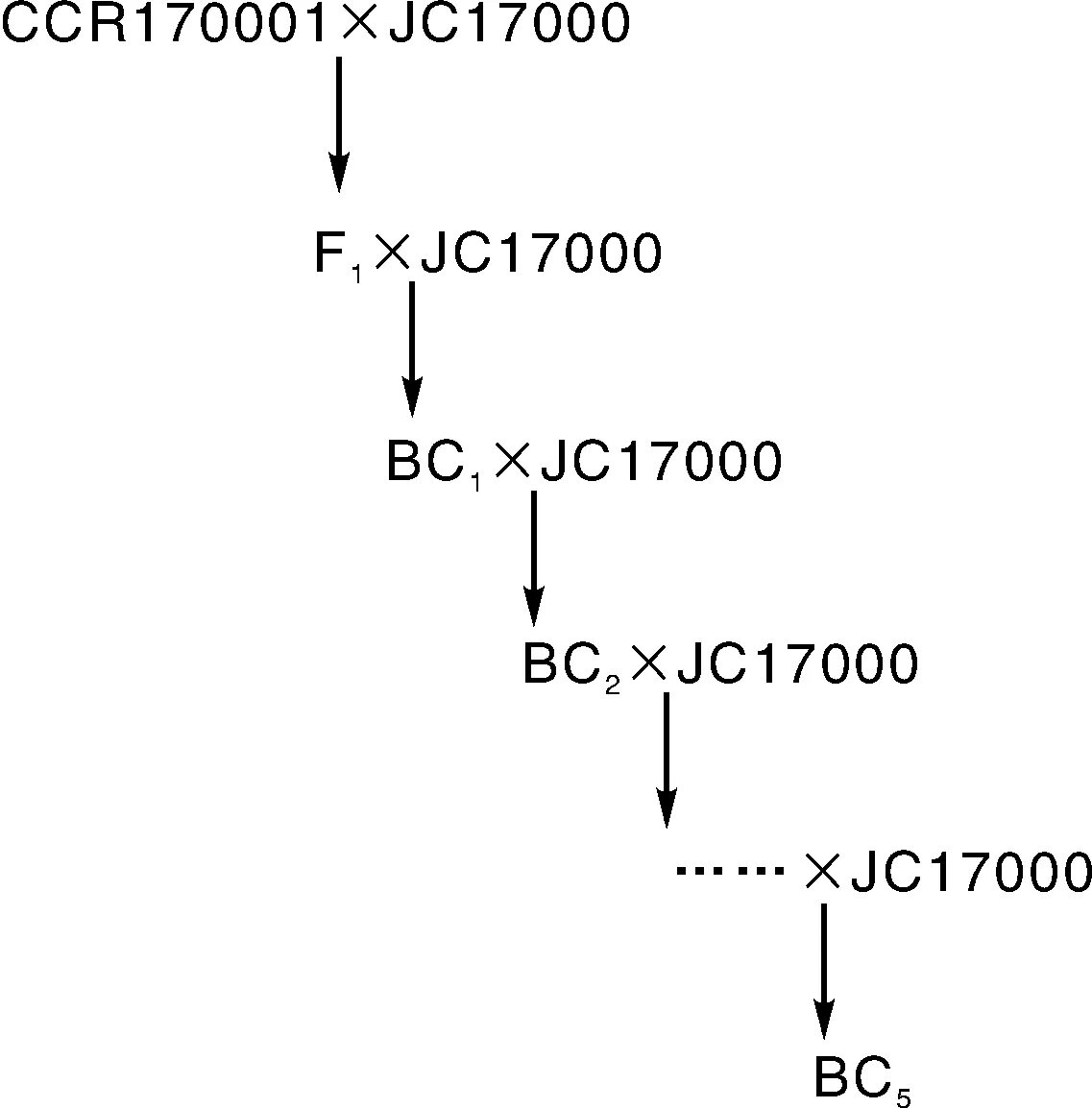
图1 萝卜胞质雄不育芥菜转育模式Fig.1 Breeding model for the transfer of Ogura CMS in mustard
1.2.2 胚挽救条件优化
不同激素含量的培养基。回交第1、2年,由于三倍体在减数分裂过程中染色体的非正常配对,导致胚败育,常规培养无法得到回交后代,需对回交后的胚珠进行人工培养。分别于第1次、第2次回交授粉后第13天,选取表面有明显膨大的角果,自来水冲洗干净,置于超净工作台内,先后用75%乙醇和10% NaClO浸泡50 s、15 min,消毒完毕后,用无菌水冲洗3次,并浸泡5 min,滤纸吸干表面水分。用解剖刀和镊子轻轻切开荚果,挑取饱满且呈绿色的胚珠,接种到不同激素含量的培养基(表1)中。置于(25±2)℃、光照12 h·d-1、光照强度1 500 lx的培养箱中培养。接种后及时观察污染和萌发情况,每15 d更换1次培养基,30 d后统计不同取材时间和不同培养基出胚情况,筛选出最适宜的培养基。
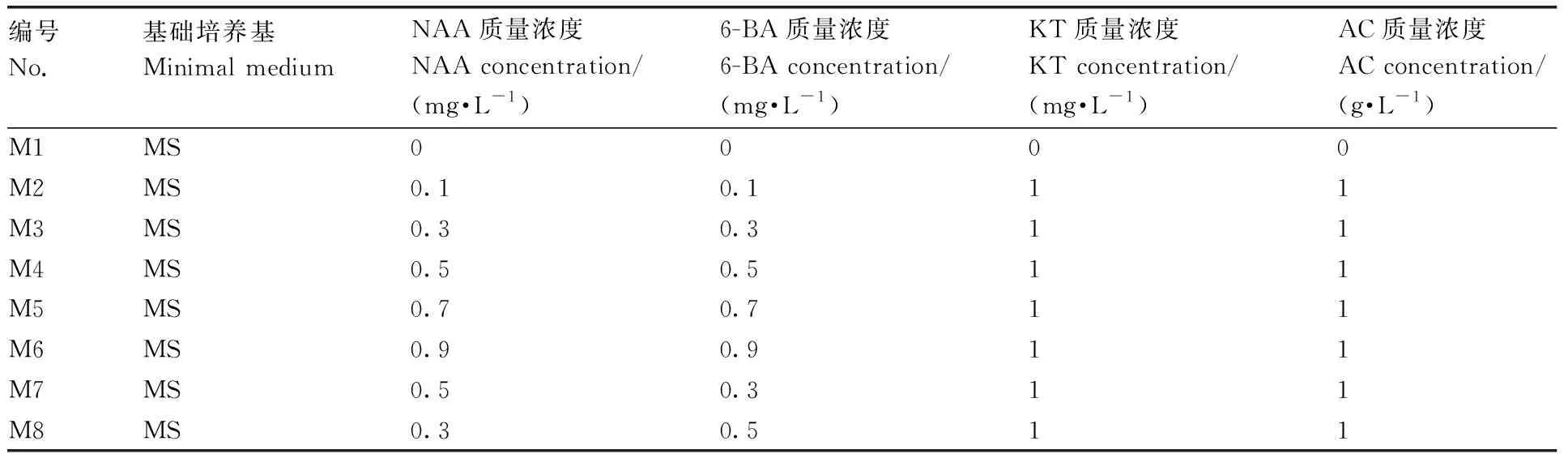
表1 胚挽救不同培养基成分Table 1 Components of embryo rescue medium for interspecific hybrid
不同取材时间。筛选出适宜培养基后,分别于第1次、第2次回交后第11、12、13、14、15、16天,取表面有明显膨大的角果,按上述相同的消毒方法,挑取饱满胚珠后,接种至筛选出的最适宜培养基,上述相同条件下培养,统计不同取材时间出胚率,选择最适宜的取材时间。并且对第1次回交和第2次回交的出胚率进行纵向比较,观察回交次数对杂交亲和性的影响。
1.2.3 田间表型观察
以轮回亲本叶用芥菜JC17000为对照,观察统计BC5代植株的生长势、株型、株高、叶片、花蕾等特征特性,随机抽取花药做镜检分析。选取100个单株,在开花期观察其雄蕊生长情况,并采用亚历山大染液显色法[11]对花药进行镜检,分析植株败育情况,统计不育株的数量,计算不育株率;同时对单株进行套袋自交,统计结荚率,计算不育度。不育度的分级标准参照杨光圣等[12]制定的方法。
1.2.4 细胞学形态鉴定
植株现蕾后,取2~3 mm的花蕾,将完整的雌蕊取出置于0.002 mol·L-18-羟基喹啉中,常温下暗处理3~4 h,转入新鲜卡诺固定液中固定12 h,转移至1 mol·L-1盐酸中60 ℃水浴6~8 min使其软化。取出软化后的材料,用蒸馏水洗净并浸泡1 min,置于干净的载玻片上捣碎,加卡宝品红染色液染色30 s,用镊子轻轻敲打盖玻片使细胞散开,置于显微镜下观察染色体数量。
1.2.5 倍性鉴定
取苗期幼嫩的叶片,用ddH2O冲洗干净,擦干放入灭菌的培养皿中,置于冰上,加入预冷的裂解液(Galbraith[13],每1 g叶片加1 mL)后,用刀片把叶片切碎,用40 μm的滤网将其过滤到1.5 mL离心管中,1 000 r·min-1离心5 min,弃上清液,加入1 μL裂解液、5 μL PI染料、2.5 μL RnaseA,混匀,避光孵化30 min后放入流式细胞仪中进行分析。
1.2.6 不育类型分子鉴定
选择1个可育白菜品种CCR21001作为对照,使用全式金生物公司的试剂盒,提取亲本、子代和选取的可育白菜的DNA,经超微量分光光度计检测其纯度和浓度,并通过1%的琼脂糖凝胶电泳检测基因组DNA的质量。利用兰梅等[5]、刘娇娇[14]设计开发的4对特异性引物(表2)进行PCR扩增,产物用1.8%的琼脂糖凝胶电泳检测,125 V条件下运行30 min后,放入凝胶成像系统中拍照记录,对比分析条带分布情况。
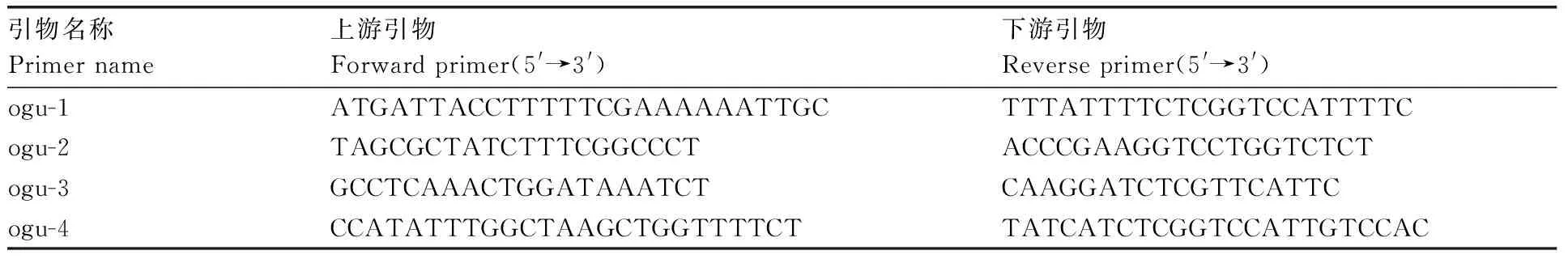
表2 鉴定萝卜胞质不育的引物信息Table 2 Information of primers for identifying Ogura cytoplasm male sterility
1.3 数据分析
采用SPSS软件对实验数据进行差异显著性分析并作图。
2 结果与分析
2.1 不同条件对出胚率的影响
2.1.1 培养基对出胚率的影响
授粉13 d后取材的胚珠在不同成分培养基中出胚率如图2所示,2次回交过程中,未添加激素的培养基M1出胚率均为0,M4的出胚率均最高,分别达到26.44%、32.66%,显著高于其他培养基;接种至M5和M6的胚珠2次回交的出胚率差异不显著,M2、M7、M8之间出胚率无显著差异。综合上述结果,2次回交过程中,M4(MS+6-BA 0.5 mg·L-1+NAA 0.5 mg·L-1+KT 1.0 mg·L-1+AC 1 g·L-1)出胚率均为最高,分别为26.44%、32.66%,为最佳培养基。离体胚在培养基中萌发后生长良好,接种15 d后胚珠萌发情况、成活胚珠增殖情况、45 d后成苗情况均如图3所示。

M1~M8为不同培养基,具体成分见表1。柱上无相同小写字母表示差异显著(P<0.05)。下同。M1-M8 were different culture mediums, their components were the same as in Table 1. Data on the bars marked without the same lowercase letter indicated significant differences at P<0.05. The same as below.图2 不同成分培养基的出胚率Fig.2 Embryogenesis rate of different culture mediums

a,胚珠萌发;b,成活胚增殖分化;c和d为胚挽救幼苗。a, Ovule germination; b, Proliferation and differentiation of survival embryos; c and d, Embryo rescued seedling.图3 F1×JC17000种间杂种胚挽救情况Fig.3 Embryo rescue situation of interspecific hybrid of F1×JC17000
2.1.2 取材时间对出胚率的影响
2次回交过程中,不同时间取材的胚珠在M4培养基上的成活率均有差异(表3)。其中,授粉后11 d取材,胚还未发育完整,出胚率较低,第1次回交出胚率仅10.06%,第2次回交出胚率也只有11.07%,说明此时雌雄配子的受精结实能力较差,不适宜离开母体存活。授粉后第13天取材进行胚挽救,出胚率最高,第1次回交出胚率达到26.44%、第2次回交出胚率达到32.66%,显著高于其他取材时间的出胚率。13 d以后取材的胚珠,出胚率逐渐下降,至第16天取材,出胚率分别降至4.73%和5.75%,说明合子胚已逐渐败育,不适宜再进行胚挽救。综上所述,2次回交过程中,授粉后第13天均为进行胚挽救的最佳取材时间。

表3 不同取材时间的出胚率Table 3 Embryogenesis rate at different sampling time
对2次回交的不同培养基和不同取材时间的出胚率进行纵向比较,结果显示,同一时间和同一培养基上,出胚率均为第2次回交略高于第1次回交,证明回交有利于胚的正常发育,能够提高A基因组与B基因组的亲和性,至第3次回交时,杂种胚已能正常发育,无需进行人工胚挽救即可得到BC3代种子。
2.2 种间杂交与回交后代的田间表型
2.2.1 植株形态
对杂交亲本、种间杂种F1和回交后代BC5植株形态进行观察发现:叶用芥菜(图4-a)的叶片呈倒卵形,叶缘波状,叶下表面无刺毛,叶面绿色平滑,叶柄背面蜡粉中等,叶柄基部横切面半圆形,植株高大;白菜叶片呈卵圆形,叶缘波状,叶下表面有刺毛,叶面绿色微皱,叶柄背面蜡粉无,叶柄基部横切面扁平,植株较矮小(图4-b);杂交种F1保留了母本白菜的大部分性状,叶片颜色较深且光滑无缺刻,幼茎和叶背具刺毛(图4-c);随着回交世代的增加,叶片逐渐出现裂刻,刺毛消失,至BC5代植株,株型与叶型与轮回亲本非常相似,叶色、叶数也近似于轮回亲本(图4-d),几乎没有母本白菜的性状特征,符合叶用芥菜的选育目标。

a,轮回亲本芥菜JC17000;b,萝卜胞质不育白菜CCR17001;c,种间杂种F1;d,BC5。a, Recurrent parent mustard JC17000; b, Ogura CMS Chinese cabbage CCR17001; c, Interspecific hybridition F1; d, BC5.图4 亲本与杂交回交后代的植株形态Fig.4 Plant morphology of parents, hybrid and backcross progeny
2.2.2 种间杂交、回交后代的不育度和不育株率
对各植株花朵进行观察,并对完全开放的花朵结构进行解剖观察,结果如图5所示。种间杂种F1和回交各世代植株的雄蕊均高度退化,BC5代花药成片状卷曲近似花瓣,且镜检无花粉,可染率为0,群体不育株率和单株不育度皆达到100%。雌蕊发育正常,柱头健壮裸露,蜜腺发达,BC5的雄蕊已退化变异成类似花瓣的结构,不会再产生花粉,是典型的高度不育类型。另外,BC5代植株的花器官明显变小,花蕾长、花蕾直径、花瓣长、花瓣宽等都小于亲本,但雌蕊的大小介于两亲本之间(表4),说明胞质不育源的转育会产生一些负效应,导致花器官形态大小受到影响。

表4 萝卜胞质不育芥菜与亲本花器官结构特征的比较Table 4 Comparison of floral organ structure characteristics between cytoplasmic male sterility of Brassica juncea and its parents cm
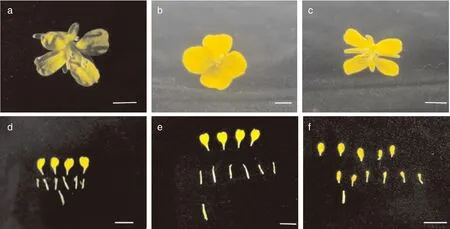
a,JC17000的花;b,CCR17001的花;c,BC5的花;d,JC17000花的解剖;e,CCR17001花的解剖;f,BC5花的解刨。标尺=1 cm。a, The flower of JC17000; b, The flower of CCR17001; c, The flower of BC5; d, Dissection of JC17000 flower; e, Dissection of CCR17001 flower; f, Dissection of BC5 flower. Scale bar=1 cm.图5 BC5与轮回亲本的花器官形态比较Fig.5 Comparison of flower morphology between BC5 and recurrent parents
2.3 种间杂交与回交后代的结实性
以叶用芥菜作为对照,对萝卜胞质不育白菜与其杂交后代、回交后代植株的结实性进行统计,结果见表5。数据显示,种间杂交存在一定程度的亲和性障碍,杂交种F1平均单花结籽数相对较低,仅有3.61;BC1、BC2代,由于三倍体形成的雌配子染色体为非整倍体,在减数分裂时期发生紊乱,表现为胚败育,无结籽能力。通过胚挽救获得的后代植株,从BC3开始恢复结籽能力,且随着回交世代的增加,平均单花结籽数逐渐提高,到BC5代结籽能力接近于轮回亲本芥菜JC17000,说明此时回交后代植株染色体数量已恢复正常水平。

表5 亲本与杂交及回交后代的结实性比较Table 5 Comparison of fruitfulness between parents, cross and backcross generations
2.4 植株的细胞学鉴定结果
2.4.1 染色体观察结果
对种间杂种和回交杂种有丝分裂过程中雌蕊染色体数量和形态进行观察,结果表明,萝卜胞质雄性不育白菜与芥菜的杂交种F1雌蕊染色体数量为28(图6-c),为亲本白菜(AA,2n=20)产生的配子A与芥菜(AABB,2n=36)产生的配子AB染色体数量之和,与预期染色体数量相符,为不育的三倍体植株。经过5代回交之后,BC5的雌蕊染色体数重新恢复到了36(图6-d),与叶用芥菜染色体数量相等,说明芥菜的细胞核已成功导入到白菜不育细胞质中,结合植株高度不育的形态学表现判断,成功创制出了基因型为AABB的萝卜胞质不育芥菜。

a,萝卜胞质不育白菜CCR17001的有丝分裂细胞,2n=20;b,轮回亲本芥菜JC17000的有丝分裂细胞,2n=36;c,种间杂交后代F1的有丝分裂细胞,2n=28;d,BC5的有丝分裂细胞,2n=36。标尺=10 μm。a, Mitotic cells of ogura CMS Chinese cabbage CCR17001, 2n=20; b, Mitotic cells of the recurrent parent mustard JC17000, 2n=36; c, Mitotic cells of interspecific hybrid progeny F1, 2n=28; d, Mitotic cells of BC5, 2n=36. Scale bar=10 μm.图6 亲本与杂交及回交后代的染色体观察Fig.6 Chromosome observation of cross and backcross generations
2.4.2 植株的倍性
以亲本雄性不育白菜和叶用芥菜作为参照,利用流式细胞仪检测F1和BC5代植株的倍性,结果如图7所示,雄性不育白菜CCR17001的荧光强度高峰位于20左右,叶用芥菜JC17000的荧光强度高峰位于50;杂交种F1的荧光强度高峰位于35,为亲本的平均值,为三倍体。经过5代回交之后的BC5荧光强度高峰位于50,与轮回亲本芥菜的荧光强度高峰位置相同,为四倍体,鉴定结果与染色体观察结果一致。综合上述鉴定结果,回交至第5代已经完成了回交核替换的目标,得到的BC5是基因型为AABB的四倍体芥菜。

a,萝卜胞质不育白菜CCR17001;b,轮回亲本芥菜JC17000;c,种间杂种F1;d,BC5。a, Ogura CMS Chinese cabbage CCR17001; b, Recurrent parent mustard JC17000; c, Interspecific hybrid progeny F1; d, BC5.图7 亲本与杂交及回交后代流式细胞图Fig.7 Flow cytometry of parent, cross and backcross progeny
2.5 萝卜胞质不育的分子鉴定结果
利用4对Ogura CMS特异性引物,对BC5及其亲本材料的DNA进行扩增,琼脂糖凝胶电泳检测结果如图8所示,以可育芥菜和可育白菜的基因组DNA为模板时,均未扩增出明显的条带,以BC5和萝卜胞质雄不育白菜的基因组DNA为模板时,4对引物中都能扩增出条带,且BC5出现条带的位置都与不育白菜的位置一致,其中,引物ogu-1扩增的条带大小在300 bp左右,引物ogu-2扩增的条带大小在1 200 bp左右,引物ogu-3扩增的条带大小在300 bp左右,ogu-4为引物扩增的条带大小在310 bp左右。以上结果表明,已成功将白菜中的不育源转育到芥菜中,创制出的BC5是萝卜胞质雄性不育材料。结合形态学和倍性鉴定结果,确定回交所得的BC5为四倍体的雄性不育芥菜。

M,DL2000 marker;1,萝卜胞质不育白菜CCR17001;2,轮回亲本芥菜JC17000;3,BC5;4,可育白菜CCR21001。M, DL2000 marker; 1, Ogura CMS Chinese cabbage CCR17001; 2, Recurrent parent mustard JC17000; 3, BC5; 4, Fertile Chinese cabbage CCR21001.图8 利用Ogura胞质雄性不育分子鉴定BC5及其亲本材料Fig.8 Ogura cytoplasmic male sterility molecular identification BC5 and its parents
3 结论与讨论
细胞质雄性不育在十字花科蔬菜新品种选育的研究中被广泛应用,可以挖掘在自然界中天然存在的不育源,如云南省农业科学院1973年报道的油用芥菜细胞质雄性不育类型欧新A,华中农业大学1999年报道的芥菜细胞质雄性不育类型hau CMS。有学者利用上述2个细胞质雄性不育源和国外引进的雄性不育源,通过远缘杂交、体细胞融合、回交核置换等手段获得分蘖芥、笋子芥、茎瘤芥3个变种的雄性不育系[15-18]。本试验以新的Ogura CMS白菜CCR17001为不育源,与叶用芥菜JC17000进行远缘杂交,并经过5代连续回交,成功将芥菜的B基因组导入到白菜的不育细胞质中,创制出了1个萝卜胞质雄性不育的芥菜材料。周庆红等[19]、王丹等[20]研究表明,白菜与芥菜正反杂交亲和性有差异,用白菜作母本能获得有胚的杂交种子,反交时获得杂交种比较困难。本实验以白菜作母本、芥菜作父本,远缘杂交后成功获得了三倍体杂种F1的种子,与前人的研究结果一致。但该结果与刘后利[21]的研究结果有差异,其认为以染色体数目多的芥菜作为母本时,更容易获得杂交种,产生差异的原因可能与亲本的基因型有关。
李祥升等[22]、柳霖坡[23]研究表明,异源三倍体F1(AAB)在减数分裂过程中,由于染色体不均等分离,一般育性较低,因此回交后代比杂种一代F1更难获得,利用胚挽救技术可以提高三倍体在回交过程中的结籽率。本试验中的F1(AAB)回交时B基因组以单价体的形式存在,影响正常的减数分裂从而导致胚败育,无法产生种子,通过胚挽救技术,成功获得了BC1、BC2代植株,证明利用胚挽救技术能够克服三倍体在回交过程中胚败育的问题。由于胚挽救技术过程较为复杂,成功率受多种因素的影响,而授粉后的取材时间和培养基的成分是胚挽救成功的关键。扈新民等[24]利用甘蓝与萝卜进行种间杂交,胚挽救研究表明授粉后14 d取材出胚率最高。Harberd[25]通过胚挽救获得甘蓝×白菜杂种,研究发现胚龄对离体胚培养的影响较大,授粉后过早或过晚取材都会导致培养的条件更复杂。本研究中,授粉后13 d取材的出胚率最高,离体胚珠在不同成分的培养基上出胚率也有显著差异,以M4(MS+6-BA 0.5 mg·L-1+NAA 0.5 mg·L-1+KT 1.0 mg·L-1+AC 1 g·L-1)培养基上的出胚率最高,第1次回交为26.44%,第2次回交为32.66%,这一结果与吕凤仙等[26]在菜心和芥蓝种间杂种胚挽救中发现的最佳培养基成分一致。
本试验利用远缘杂交将芥菜的B基因组导入白菜的不育细胞质中,并通过连续回交法结合胚挽救技术完成回交核替换的目标,创制出了萝卜胞质不育的芥菜材料,经形态学与细胞学鉴定,该不育材料的雄蕊高度退化成片状卷曲的花瓣,明显区别于其他不育类型。陈竹君等[27]在榨菜胞质不育系的研究中报道过这种雄蕊无花药类型,发现这种孢子体败育型雄蕊的不育度和不育株率均为100%。本试验中形态学和花粉育性检测表明,所得材料不育性稳定,且不育度和不育株均为100%,与其研究结果一致。试验中,回交至第5代的材料,性状表现已更接近芥菜,且此时结籽能力已接近于正常的轮回亲本芥菜,染色体和倍性鉴定结果也表明,该材料是染色体数目为36条的异源二倍体(AABB)芥菜。但在对该材料进行形态学鉴定过程中发现,与轮回亲本芥菜相比,该不育材料的大部分花器官都明显变小。邹瑞昌[28]在其他雄性胞质不育的研究中曾有过类似的报道,说明种间的不育源转育会对细胞质遗传产生一定的负效应,并提出增加回交的世代数或选择合适的父本配组可以减轻甚至克服负效应。
本试验获得了不育度和不育株率均为100%的芥菜雄性不育材料,为芥菜新品种的选育提供了材料,且利用萝卜胞质不育白菜作为不育源,为芥菜雄性不育材料的选育提供了新思路。但选育得到的不育材料,其雄蕊发育和退化机理,以及杂种优势利用潜力还有待进一步研究。

