锌指蛋白ZBTB20 敲低的血管平滑肌细胞稳转株的构建及鉴定
赵倩,陈玉霞,王平,任安经,宋金超
研究表明,锌指蛋白ZBTB20在大脑[1]、肝脏、胰腺、骨骼肌[2]、免疫系统[3]等多个器官/系统中广泛表达,其是调节神经[4]、内分泌、消化[5]和骨骼肌发育及糖脂代谢稳态的关键转录因子,其缺乏可导致个体发育障碍[6]、糖尿病[7-8]和智力障碍[9]等。笔者所在课题组前期研究发现,ZBTB20在心血管系统中呈高表达,ZBTB20敲除小鼠心率无明显异常,但会出现低血压,导致心脏、左心室壁厚度和心肌细胞明显缩小,分析原因可能与体质量下降有关;再者,ZBTB20敲除小鼠的心脏收缩能力明显受损,线粒体功能相关基因(包括Hspb8、Ckmt2、Cox7a1、Tfrc和Ogdhl等)表达明显降低[10],推测ZBTB20在心脏发育、能量代谢和心脏收缩能力方面起着重要作用。本研究拟构建ZBTB20干扰慢病毒载体,然后用其感染人肺动脉平滑肌细胞(human pulmonary artery smooth muscle cells,HPASMCs)以构建ZBTB20敲低的血管平滑肌细胞稳转株,并观察ZBTB20敲低对HPASMCs增殖和迁移的影响,以期为进一步研究ZBTB20在心血管系统尤其是血管中的生物学功能提供细胞模型。
1 材料与方法
1.1 实验时间 实验时间为2022-04-18至2022-11-29。
1.2 主要试剂与仪器 polybrene〔汉恒生物科技(上海)有限公司〕,嘌呤霉素(Sigma),DMEM培养基(Corning),胎牛血清(Gemini),磷酸盐缓冲液(phosphate buffered solution,PBC)(Cytiva),反转录试剂盒(Toyobo),PVDF膜(Merck millipore),pHBLV-U6-puro载体〔汉恒生物科技(上海)有限公司〕,Lipofectamine 3000试剂(Invitrogen),PowerUpTMSYBRTMGreen Master Mix试剂(Applied Biosystems),CCK-8试剂盒(同仁化学研究所),ECL化学发光超敏显色试剂盒(中国Yeasen生物科技股份有限公司),封闭试剂(罗氏公司),天能EPS600电泳仪(上海天能科技公司),超灵敏化学发光成像仪(GE Healthcare Life Science),台式高速大容量冷冻离心机5810R(Eppendorf),荧光显微镜(OLYMPUS公司),荧光定量PCR仪(Eppendorf)。
1.3 构建方法
1.3.1 细胞培养 HPASMCs购自美国Sciencell,采用含10%胎牛血清的DMEM培养基,于37 ℃、5% CO2孵箱中培养。
1.3.2 ZBTB20干扰慢病毒载体构建 设计合成针对ZBTB20基因的短发卡RNA(short hairpin RNA,shRNA)并退火以产生dsDNA,随后将dsDNA与经AgeⅠ和EcoR Ⅰ双酶切后的pHBLV-U6-puro载体连接。将连接产物转入感受态细胞TOP10进行扩增,之后将细胞涂板并于37 ℃环境下培养、过夜,挑取单克隆菌落并将其接种于有氨苄霉素抗性的LB培养液中,恒温(37 ℃)摇床、培养过夜。采用质粒小量抽提试剂盒提取质粒,得到ZBTB20干扰慢病毒载体——pHBLVZBTB20 shRNA并测序鉴定。
1.3.3 ZBTB20干扰慢病毒包装 将293T细胞接种于6 cm培养皿中,细胞密度约为60%。培养24 h后,根据Lipofectamine 3000试剂说明书配制载体-脂质体混合液,其中pHBLV-ZBTB20 shRNA∶包装质粒pSPAX2∶包膜质粒pMD2.G为4∶3∶1,载体与脂质体的比例为1 μg∶3 μl。将载体-脂质体混合液于室温孵育20 min,之后加入细胞中继续孵育6 h,更换培养基(DMEM+5% FBS)。转染48 h后收集ZBTB20干扰慢病毒的上清液,于4 ℃环境下离心5 min(2 000 r/min,离心半径10 cm),采用0.45 μm滤器过滤,分装保存于-80 ℃冰箱中备用。
1.3.4 ZBTB20敲低的血管平滑肌细胞稳转株的构建将HPASMCs接种于6 cm培养皿中,次日感染前细胞密度达到40%~50%,弃去细胞培养液。分别加入含8 μg/ml polybrene和0.5 ml ZBTB20干扰慢病毒上清液的无血清培养液3 ml(实验组)和含8 μg/ml polybrene和0.5 ml含无意义干扰序列的慢病毒的无血清培养液3 ml(阴性对照组)后晃匀,室温下离心30 min(1 000×g),37 ℃孵育过夜,之后更换新鲜培养液。48 h后,加入含1.5~3.0 μg/ml嘌呤霉素的新鲜完全培养液以筛选存活细胞。同时设置加入不含慢病毒的无血清培养液的HPASMCs作为空白对照组,同样加入含1.5~3.0 μg/ml嘌呤霉素的新鲜完全培养液。以空白对照组HPASMCs全部死亡为截点,观察实验组和阴性对照组中存活的HPASMCs即为转染成功的HPASMCs。之后以含0.5 μg/ml嘌呤霉素的新鲜完全培养液维持筛选1周。
1.4 鉴定方法
1.4.1 荧光定量PCR 两组细胞均进行荧光定量PCR,具体步骤如下:(1)设计合成ZBTB20引物,其正向引物:5'-GCAGCCGGCAGCCCCTTCTTC-3',反向引物:5'-CGCTCGCCGCTGCCATTCTG-3'。(2)制备cDNA:提取细胞总RNA,采用紫外分光光度计检测RNA浓度和纯度,制备总RNA并将其放入-80 ℃环境下保存备用。(3)合成cDNA:第一步,去除总RNA内的DNA;第二步,阻止DNA酶的反应,加入EDTA 1 μl,65 ℃环境下孵育10 min;第三步,采用反转录试剂盒进行反转录以获得cDNA。然后将合成的cDNA加入10 mmol/L Tris-HCl缓冲液(pH=8.0)80 μl,置于-20 ℃环境下保存备用。(4)荧光定量PCR:10 μl反应体系包括PowerUpTMSYBRTMGreen Master Mix 5.000 μl、双蒸水3.250 μl、cDNA模板1.500 μl、正向引物(10 pmol/μl)0.125 μl、反向引物(10 pmol/μl)0.125 μl。使用荧光定量PCR仪进行检测,以β-actin为内参,采用2-ΔΔCt法计算ZBTB20 mRNA的相对表达量。实验独立重复3次。
1.4.2 Western blot法 分别在6孔板上培养两组细胞,然后采用8 mol/L尿素蛋白裂解液进行裂解,将蛋白样品与SDS混合物进行电泳并转至PVDF膜上,将PVDF膜洗涤后加入5%脱脂奶粉,室温摇床封闭1 h,4 ℃环境下孵育ZBTB20 抗体过夜,洗膜后室温孵育二抗1 h。采用TBST洗涤3次后加入显影液,采用FUJIFILM LAS-4000发光检测仪进行曝光,采用Image Reader LAS-4000软件测量ZBTB20灰度值,以GAPDH为内参,计算ZBTB20相对表达量,ZBTB20相对表达量=ZBTB20灰度值/GAPDH灰度值。实验独立重复3次。
1.4.3 免疫组化试验 在两个24孔板中放入爬片,分别接种两组细胞,每孔104个细胞,然后放入培养箱中过夜,当爬片上的细胞长到50%时采用PBS漂洗3次,之后加入2%多聚甲醛,室温摇床固定8 min,采用PBS冲洗3次。置于0.5% triton中室温摇床25 min,采用PBS冲洗3次后将爬片置于blocking液〔1×TNB(牛血清白蛋白0.250 g+明胶0.050 g+脱脂奶粉0.025 g溶于Tris缓冲盐溶液,定容至50 ml)+5%山羊血清+0.5%封闭试剂〕中,放入37 ℃培养箱内孵育30 min。然后将爬片置于ZBTB20一抗(1∶2 000)中,4 ℃摇床过夜(16 h),次日采用PBS 冲洗5 次后加二抗(1 ∶500)孵育30 min。采用DAPI对细胞核进行染色,采用甘油封固,在荧光显微镜下拍照。实验独立重复3次。
1.5 细胞增殖实验 (1)细胞计数:分别将两组细胞接种到96孔板上,500个/孔,感染后连续5 d细胞处于对数生长期,经过消化、常温离心(离心半径10 cm,2 000 r/min,离心时间4 min)、PBS清洗和无血清培养基重悬后,进行细胞计数。(2)CCK8法:分别将两组细胞接种在96孔板上,每孔500个细胞(100 μl细胞悬液),感染后第1、2、3、4、5天每孔加入10 μl CCK8试剂,在孵箱继续孵育2 h后使用酶标仪检测细胞在450 nm处的OD值。实验独立重复3次。
1.6 细胞迁移实验 铺板前采用marker笔细头在6孔板底部画5条横线。分别将两组细胞消化后计数,按照1.5×105/孔的密度将其接种于6孔板中,采用含2.5%FBS的DMEM培养基培养,待细胞生长至70%~80%时吸弃培养基,用200 μl枪头垂直于孔板从上划到下方,左中右划三条,采用PBS漂洗2遍以冲洗脱落细胞,然后加入培养基,在划痕后0、8、24、48 h分别拍照,采用Image J软件测量划痕面积,然后计算划痕愈合面积百分比,划痕愈合面积百分比=(初始划痕面积-目标时间划痕面积)/初始划痕面积×100%。实验独立重复3次。
1.7 统计学方法 应用SPSS 21.0统计学软件进行数据处理。计量资料以(±s)表示,两组间比较采用成组t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 测序鉴定结果 测序鉴定结果显示,重组载体插入的片段序列与设计合成的pHBLV-ZBTB20 shRNA的序列一致,说明重组载体构建成功,见图1。

图1 pHBLV-ZBTB20 shRNA测序鉴定结果Figure 1 Sequencing identification results of pHBLV-ZBTB20 shRNA
2.2 ZBTB20敲低的血管平滑肌细胞稳转株的构建ZBTB20干扰慢病毒感染HPASMCs后,加入含3 μg/ml嘌呤霉素的新鲜完全培养液,48 h后几乎所有细胞死亡;之后将嘌呤霉素含量降至1.5 μg/ml,48 h后观察到部分细胞存活;在此基础上,对感染细胞离心30 min(1 000×g)以增加细胞的感染机会,同样加入含1.5 μg/ml嘌呤霉素的新鲜完全培养液,48 h后观察发现大部分细胞存活。
2.3 ZBTB20敲低的血管平滑肌细胞稳转株的鉴定 荧光定量PCR结果显示,实验组ZBTB20 mRNA相对表达量为(0.19±0.02),低于阴性对照组的(1.00±0.08),差异有统计学意义(t=9.731,P<0.001)。Western blot法结果显示,实验组ZBTB20为(8.62±1.63),低于阴性对照组的(131.60±6.86),差异有统计学意义(t=5.271,P<0.001),见图2。免疫组化试验结果显示,ZBTB20在阴性对照组的细胞核内高度表达,而在实验组的细胞核内无明显表达,表明ZBTB20敲低的血管平滑肌细胞稳转株构建成功,见图3。

图2 两组ZBTB20蛋白表达的电泳图Figure 2 Electrophoretogram of ZBTB20 protein expression of the two groups

图3 两组免疫组化试验结果(DAPI染色,×200)Figure 3 Immunohistochemical test results of the two groups
2.4 ZBTB20敲低对HPASMCs增殖、迁移的影响 感染后第1天,两组细胞计数比较,差异无统计学意义(P>0.05);感染后第2~5天,实验组细胞计数少于对照组,差异有统计学意义(P<0.05),见表1。感染后第1天,两组OD值比较,差异无统计学意义(P>0.05);感染后第2~5天,实验组OD值低于阴性对照组,差异有统计学意义(P<0.05),见表2。感染后8、24 h,两组划痕愈合面积百分比比较,差异无统计学意义(P>0.05);感染后48 h,实验组划痕愈合面积百分比低于阴性对照组,差异有统计学意义(P<0.05),见表3。
表1 两组感染后不同时间细胞计数比较(±s,n=3,个)Table 1 Comparison of cell counts between the two groups at different time after infection

表1 两组感染后不同时间细胞计数比较(±s,n=3,个)Table 1 Comparison of cell counts between the two groups at different time after infection
组别感染后第1天 感染后第2天 感染后第3天 感染后第4天 感染后第5天阴性对照组500±02 050±238 2 300±2002 800±634 050±266实验组500±01 300±188 1 800±110 2 300±241 2 500±167 t值02.4932.1932.0084.939 P值 1.0000.0320.0460.0490.006
表2 两组感染后不同时间OD值比较(±s,n=3)Table 2 Comparison of OD values between the two groups at different time after infection
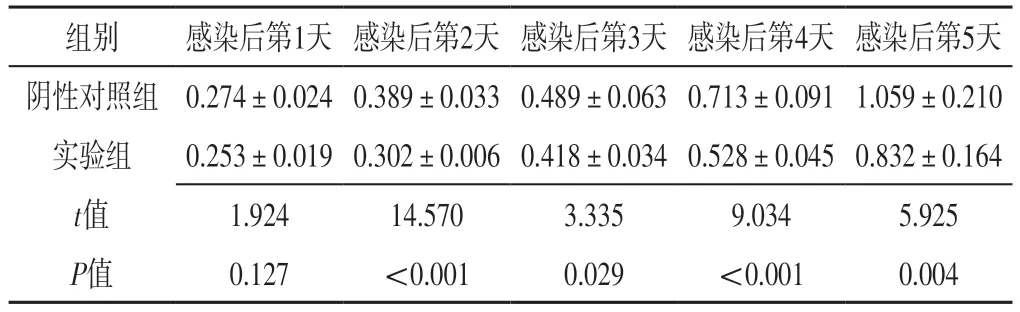
表2 两组感染后不同时间OD值比较(±s,n=3)Table 2 Comparison of OD values between the two groups at different time after infection
组别感染后第1天 感染后第2天 感染后第3天 感染后第4天 感染后第5天阴性对照组 0.274±0.024 0.389±0.033 0.489±0.063 0.713±0.091 1.059±0.210实验组0.253±0.019 0.302±0.006 0.418±0.034 0.528±0.045 0.832±0.164 t值 1.92414.5703.3359.0345.925 P值0.127<0.0010.029<0.0010.004
表3 两组感染后不同时间划痕愈合面积百分比比较(±s,n=3,%)Table 3 Comparison of the percentage of scratch healing area between the two groups at different time after infection

表3 两组感染后不同时间划痕愈合面积百分比比较(±s,n=3,%)Table 3 Comparison of the percentage of scratch healing area between the two groups at different time after infection
组别感染后8 h感染后24 h感染后48 h阴性对照组28.91±8.0646.07±4.7866.84±8.41实验组31.22±6.9040.81±4.8153.40±8.22 t值 0.5751.3443.021 P值0.5760.2500.011
3 讨论
ZBTB20由741个编码氨基酸组成,其N端含有POZ结构域,C端含有5个C2H2锌指结构域,且与已知的POZ锌指蛋白BCL6和PLZF有30%~40%的同源性[11]。近年ZBTB20的生物学功能被不断发现,如其可以调节肝脏脂质生成[12]、通过调节表皮因子生长受体(epidermal growth factor receptor,EGFR)表达和肝细胞增殖而调节小鼠肝脏再生[13]、通过抑制肝细胞中脂蛋白脂肪酶基因的转录而调节血浆三酰甘油代谢[14]。此外,神经系统、三叉神经节伤害性神经元中的ZBTB20还可以介导瘙痒感受[15],且其对哺乳动物新皮质中胼胝体投射神经元和星形胶质细胞亚群的分化至关重要[10]。
研究表明,ZBTB20基因的杂合突变可引起Primrose综合征,其临床表现包括可识别的面部特征、大头畸形、智力低下、外耳增大和钙化、体毛稀疏和远端肌肉萎缩[9]。笔者所在课题组前期研究发现,ZBTB20全身敲除小鼠会出现低血压、心功能降低[11]。LI等[16]研究发现,在结扎冠状动脉前降支引起的心肌梗死模型中,ZBTB20过表达可以缩小心肌梗死面积、改善心功能,其机制与抑制ASK1/JNK1/2信号通路有关。TAO等[17]研究发现,ZBTB20在人动脉粥样硬化斑块中表达增加,其可以正向调节氧化型低密度脂蛋白诱导的动脉粥样硬化斑块中巨噬细胞的氧化应激、线粒体裂变和炎症反应。本研究结果显示,ZBTB20在阴性对照组的细胞核内高度表达,故推测ZBTB20在血管平滑肌细胞生理功能维持中具有潜在作用。
慢病毒载体较反转录病毒载体有更广的宿主范围,其能产生表达shRNA的高滴度慢病毒,并在周期性和非周期性细胞、干细胞、受精卵及分化的后代细胞中表达shRNA[18]。本实验构建了pHBLV-ZBTB20 shRNA,获得了ZBTB2干扰慢病毒,并通过感染HPASMCs成功构建了ZBTB20敲低的血管平滑肌细胞稳转株。
PASMCs位于肺血管结构的中层,是构成肺动脉管壁的主要细胞。研究表明,肺动脉重构主要由PASMCs异常生长、过度增殖和凋亡减少引起,而抑制PASMCs增殖或诱导其凋亡是治疗肺动脉高压(pulmonary hypertension,PH)的有效策略[19-20]。因此,深入挖掘调控PASMCs增殖的分子机制对于临床治疗PH等心血管疾病具有重要意义。本研究结果显示,感染后第2~5天,实验组细胞计数少于对照组,OD值低于阴性对照组;感染后48 h,实验组划痕愈合面积百分比低于阴性对照组,提示ZBTB20敲低后HPASMCs的增殖和迁移能力明显受到抑制,这为下一步研究ZBTB20在血管功能及其作为PH的潜在靶点奠定了基础。
综上所述,本实验成功构建了ZBTB20敲低的血管平滑肌细胞稳转株,且ZBTB20敲低后HPASMCs的增殖和迁移能力明显受到抑制。
作者贡献:赵倩、任安经、宋金超进行文章的构思与设计,研究的实施与可行性分析;赵倩、王平进行数据收集、整理、分析;赵倩、陈玉霞进行结果分析与解释;赵倩、任安经负责撰写、修订论文;宋金超负责文章的质量控制及审校,并对文章整体负责、监督管理。
本文无利益冲突。

