磷脂酶D 的大肠杆菌表达系统及其转酰基催化活性
程青,谢志鹏
(浙江大学 医学院 药物生物技术研究所,浙江 杭州 310058)
磷脂酰丝氨酸(phosphatidylserine,PS)是生物膜磷脂的重要组成成分[1],可以调控细胞膜中关键蛋白质的功能状态[2]、平衡情绪[3]、改善记忆力[4]和缓解阿尔茨海默氏病症状[5]、增强运动员的恢复能力[6]。目前,PS 的制备方法主要有化学提取法和生物酶催化法。化学提取法成本高、产率低,且动物原料存在安全隐患[7]。生物酶催化法,以磷脂酰胆碱(phosphatidylcholine,PC)和L-丝氨酸为原料,以磷脂酶D(phospholipase D,PLD)为催化剂,简单高效,反应温和,更适合PS的规模化生产[8]。
PLD(EC 3.1.4.4)可催化2 种反应:(1)水解反应,催化PC 的磷酸二酯键水解,生成磷脂酸和胆碱;(2)转酰基反应,将PC 的磷脂头部转移至其他受体醇[9-10]。PLD 广泛存在于动植物以及微生物的生物膜中[11]。相对于动植物来源的PLD,微生物来源的PLD,尤其是链霉菌属(Streptomyces)来源的PLD,具有更强的转磷脂能力和更广泛的底物专一性[12]。
野生链霉菌表达PLD 发酵周期长且酶活水平低,目前获得PLD 的常用手段是对PLD 进行分子改造,将其异源表达到其他工程菌。大肠杆菌具有生长周期短、培养成本低、易于操作等优点,是PLD 的主要异源表达系统,也有研究利用其他宿主菌表达PLD,如毕赤酵母、变铅链霉菌、枯草芽孢杆菌、谷氨酸棒杆菌等。LIU 等[13]在毕赤酵母表面展示PLD,当诱导108 h 时,转酰基活力达到最大,为315 U·g-1(细胞干重),但与大肠杆菌表达PLD 相比,发酵周期过长。NAKAZAWA 等[14]通过构建大肠杆菌-变铅链霉菌穿梭质粒,在变铅链霉菌中分泌表达PLD,培养60 h 后酶活高达30 U·mL-1,但需经硫酸铵沉淀,从培养基上清中分离PLD 蛋白。HUANG 等[15]利用枯草芽孢杆菌WB600 分泌表达PLD,但需将发酵液经过镍柱洗脱得到纯PLD。HOU 等[16]首次使用谷氨酸棒杆菌分泌表达PLD,但从培养基上清中获得的PLD 粗酶液,需使用较为昂贵的脑浸出液培养基。由于PLD 的表达对大肠杆菌宿主有毒害作用,在不诱导时,PLD 的微量渗漏表达也会导致其细胞死亡或质粒丢失[17],从而令PLD 产量降低。XIONG 等[18]将大肠杆菌作为PLD 表达宿主,在质粒中加入稳定基因,使用严谨型启动子,质粒稳定性在传代5 次后仍为100%,5 L 发酵罐中的酶活达120 U·mL-1,但需经硫酸盐沉淀、镍柱洗脱等复杂纯化过程。ZHANG 等[19]通过自转运蛋白ADIA-I,在大肠杆菌表面展示PLD,虽然避免了PLD 的纯化,但诱导48 h后,酶活仅为0.074 U·mL-1。目前,已有的PLD 表达方式存在细胞发酵周期长、分离纯化步骤烦琐、培养成本较高等问题。
本研究旨在通过系统性地对比研究大肠杆菌胞内表达、分泌表达和表面展示3 种方式对PLD 酶活及其PS 催化合成效率的影响,探索全细胞催化制备PS 的可行性及最适方式,以期大幅缩短PLD 高效活性表达所需的发酵时长,优化操作烦琐、耗时、成本高昂的PLD 分离纯化工序。
1 材料与方法
1.1 材 料
1.1.1 菌 株
大肠杆菌表达宿主Escherichia coli BL21(DE3)和克隆宿主Escherichia coli DH5α 菌株均为实验室保藏。
1.1.2 主要酶与试剂
胆碱氧化酶购于上海源叶生物科技有限公司,辣根过氧化物酶购于上海生工公司,磷脂酰胆碱(98%)、磷脂酰丝氨酸(99%)购于Sigma-Aldrich 公司,L-丝氨酸(99%)购于上海麦克林生化科技公司。
1.2 方 法
1.2.1 重组菌株的构建
构建胞内表达、分泌表达和表面展示3 种方式的PLD 表达重组菌株,见表1。

表1 表达PLD 的菌株Table 1 The strains for expression of PLD
胞内表达菌株BL-PLD。基于大肠杆菌密码子偏好性,优化Streptomyces halstedii 来源的pld 基因(AB062136.1),由擎科生物公司合成,转化至BL21(DE3)菌株而得。
采用限制性内切酶Hind III 和BamH I 对合成的pET28a(+)-PLD 载体和pET22b(+)空载体进行双酶切,连接后得到重组质粒pET22b(+)-PLDp。以pET22b(+)-PLDp 为模板,将pelB 信号肽分别替换为FhuD、OmpA、DsbA 信号肽,得到分泌表达载体pET22b(+)-PLDo、pET22b(+)-PLDd、pET22b(+)-PLDf,转化至BL21(DE3)菌株,得到分泌表达菌株PLD-PelB、PLD-OmpA、PLDDsbA、PLD-FhuD。所用信号肽及其序列如表2所示。
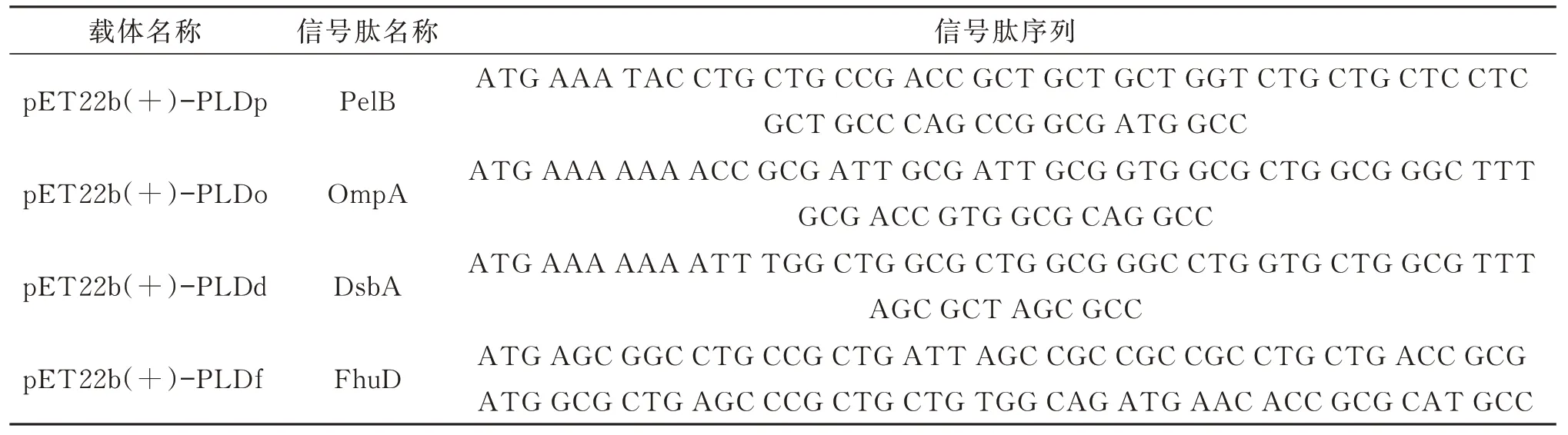
表2 分泌表达载体及其信号肽Table 2 Secreted expression vectors and their signal peptides
表面展示菌株PLD-EhaA。N 端CtxB 信号肽序列、EhaA 自转运蛋白连接子区域、β 折叠区域由擎科生物公司合成,插入pET28a(+)-PLD 载体。将重组质粒转入BL21(DE3)进行蛋白表达。
1.2.2 水解酶活检测
由于PLD 的转酰基酶活检测方法烦琐、耗时,而PLD 的水解酶活与转酰基酶活存在正相关性[20],且水解酶活检测方法简便、快速,故在进行条件优化时用水解酶活表征转酰基酶活。采用酶连比色法[21],通过检测胆碱的物质的量测定水解酶活。PLD 的一个水解酶活单位(U)定义为每分钟催化底物PC 水解产生1 μmol 胆碱所需的酶量。
分别取胞内表达菌株和分泌表达菌株的发酵液1 mL,离心后,用Tris-HCl(pH 8.0)缓冲液重悬菌体,超声破碎,得到PLD 粗酶液。稀释一定倍数后,取100 μL 进行水解酶活检测。取表面展示菌株发酵液1 mL,离心后用缓冲液重悬稀释菌体,取100 μL 细胞悬液检测酶活。
1.2.3 PLD 转酰基反应合成PS
在水-乙酸乙酯两相体系中,分别以全细胞和来源于胞内表达菌株、分泌表达菌株的粗酶液为催化剂,催化PC 和L-丝氨酸合成PS[22]。两相反应体系混合液包括3 mL 含10 mg·mL-1PC 的乙酸乙酯溶液、1 mL 含90 mg·mL-1L-丝氨酸和15 mmol·L-1CaCl2的乙酸钠缓冲液(100 mmol·L-1,pH 5.5)、0.5 mL 粗酶液或全细胞悬液。将混合液置于40 ℃、200 r·min-1摇床中振荡12 h,加入4.5 mL Floch 溶液(V氯仿∶V甲醇=2∶1),离心后取有机相,采用高效液相色谱(HPLC)法测定磷脂。
在纯水相体系中,在LIU 等[13]方法的基础上略做了修改。纯水相反应体系混合液包括1 mL 含10 mmol·L-1PC 的5% Triton X-100 溶液、1 mL 含40 mmol·L-1L-丝氨酸的100 mmol·L-1乙酸钠缓冲液(pH 5.5)、150 μL 含10 mmol·L-1CaCl2水溶液及1 mL 粗酶液或全细胞悬液。将混合液置于40 ℃、200 r·min-1摇床中振荡12 h。采用HPLC 法测定磷脂。
1.2.4 高效液相色谱检测
采用配备紫外检测器的安捷伦1260 高效液相色谱仪,选用安捷伦ZORBAX Rx-SIL 硅胶色谱柱(5 μm,150 mm×4.6 mm),以乙腈、甲醇、85% 磷酸混合液(V∶V∶V=100∶10∶0.8)为流动相,流速1 mL·min-1,柱温30 ℃,检测波长205 nm。
1.2.5 扫描电镜制样及观察
(1)固定:将细菌样品悬浮于0.5%戊二醛溶液中,4 ℃固定过夜。倒掉固定液,用0.1 mol·L-1磷酸缓冲液(pH 7.0)漂洗样品3 次,每次15 min。再用1%锇酸溶液固定样品1~2 h,小心取出锇酸废液,用0.1 mol·L-1磷酸缓冲液(pH 7.0)漂洗样品3 次,每次15 min。
(2)脱水:依次用体积分数为30%,50%,70%,80%,90%和95%的乙醇溶液对样品进行脱水处理,每种浓度处理15 min。最后用无水乙醇脱水处理20 min,并将细胞样品保存于无水乙醇中。
(3)干燥:在Hitachi HCP-2 型临界点干燥仪中干燥。
(4)观察:镀膜,将处理好的样品置于Hitachi SU-8010 型扫描电镜中观察。
1.2.6 重组PLD 的表达及发酵条件优化
LB(Luria-Bertani)液体培养基:胰蛋白胨10 g·L-1,NaCl 10 g·L-1,酵母提取物5 g·L-1。将重组菌BL-PLD 接种至50 mL LB 液体培养基,37 ℃ 220 r·min-1摇床过夜培养,得种子液。
MTB(Modified Terrific Broth)培养基:胰蛋白胨12 g·L-1,酵母提取物24 g·L-1,葡萄糖10 g·L-1,K2HPO472 mmol·L-1,KH2PO472 mmol·L-1。将1%种子液接种至150 mL MTB 培养基,37 ℃、220 r·min-1培养至菌浓(发酵液在600 nm 处的吸光度)为0.4~0.6,添加IPTG 至浓度为0.1 mmol·L-1,于25 ℃、220 r·min-1继续发酵培养。
采用单因素法,分别探究诱导温度、诱导时的OD600、IPTG 浓度、诱导时长等对PLD 表达量的影响。
2 结果与讨论
2.1 重组菌株
2.1.1 胞内表达菌株
经过优化,胞内表达菌株的密码子适应性指数(CAI)从0.71 提升至0.96,DNA 序列中鸣嘌呤(G)和胞嘧啶(C)的碱基对的占比(GC 含量)从71%降至52%。
2.1.2 分泌表达菌株
信号肽是用于指导目的蛋白跨膜转移或定位的氨基酸序列。通过将适当的信号序列融合至靶蛋白基因的N 端,如大肠杆菌宿主,令异源蛋白分泌至周质空间,从而增强其溶解度并避免形成包涵体。不同信号肽分泌蛋白的途径不同,参照文献[23],选择PelB、OmpA、FhuD 和DsbA 4 种信号肽,研究不同信号肽对PLD 分泌表达的差异。
2.1.3 表面展示菌株
ZHANG 等[19]通过自转运蛋白AIDA-I 将PLD成功展示在大肠杆菌细胞表面[19],说明将大肠杆菌作为PLD 展示菌株是可行的,但诱导48 h 后酶活仅为0.074 U·mL-1,可能是因为自转运蛋白AIDA-I的转运效率较低。另外,TOZAKIDIS 等[24]借助自转运蛋白EhaA 成功将酯酶展示在大肠杆菌细胞表面,且获得较高的酶活,故选择自转运蛋白EhaA 在大肠杆菌表面进行展示。
EhaA 是来自大肠杆菌O157:H7 EDL933 基因组的一种自转运蛋白,其与PLD 融合的自转运系统结构如图1(a)所示,包括三部分:(1)N 端的CtxB信号肽[25];(2)C 末端的自转运蛋白EhaA,包含连接子和β-折叠区域[26];(3)PLD 作为“乘客”蛋白,位于N 端与C 端之间。PLD 转运过程如图1(b)所示,CtxB 信号肽通过Sec 引导PLD 蛋白穿过内膜转运[27]至周质空间,同时信号肽被裂解。通过形成孔状结构,将β-折叠结构域整合至细胞外膜,而连接子结构域穿过β-折叠结构域并充当连接结构,以允许PLD 蛋白暴露在细胞外部。
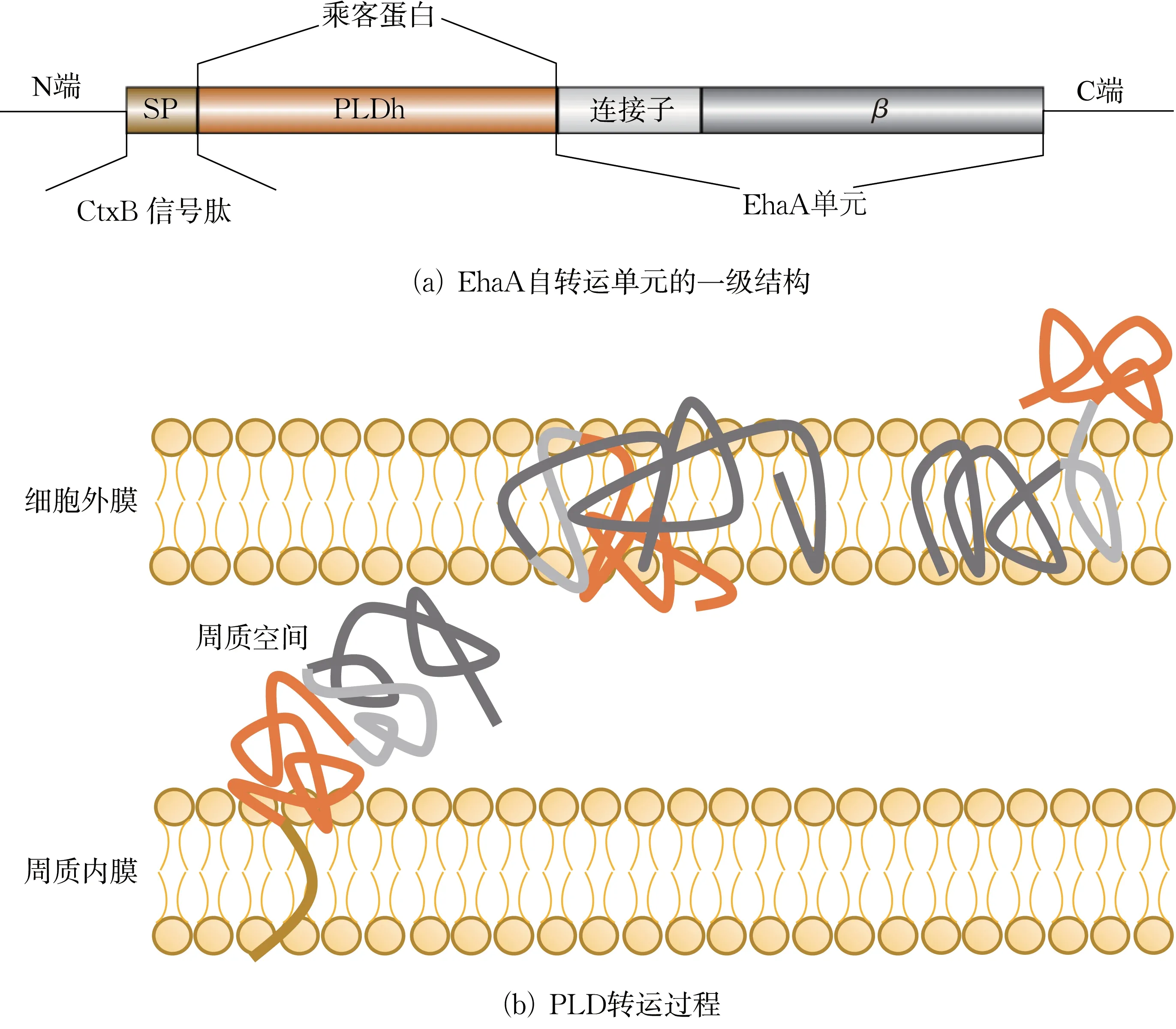
图1 EhaA 自转运载体示意Fig.1 Schematic of EhaA autotransporter
2.2 发酵条件优化
图2 展示了诱导温度、诱导时的OD600、诱导物浓度对大肠杆菌表达PLD 的影响。

图2 PLD 发酵条件优化Fig.2 Optimization of the fermentation conditions
首先,在16~32 ℃条件下诱导PLD 表达,发酵结束后检测PLD 的水解酶活。图2(a)表明,在20 ℃时,PLD 水解酶活最高。随着温度上升,酶活急剧下降,说明PLD 更倾向于较低温度的诱导表达,温度对PLD 的诱导表达较为关键。
其次,为探究诱导时的最佳细胞量,分别在OD600为0.4~1 时进行诱导。图2(b)表明,当OD600=0.7时,PLD 水解酶活最高。若过早诱导PLD 表达,则不利于菌体生长,PLD 最终表达量较低,说明在诱导PLD 表达前需积累足够多的细胞量。当OD600>0.7 时,随着OD600的增加,酶活反而降低,这可能是由于菌体生长已经偏离了对数生长期,菌体活力下降,导致PLD 表达量下降。
最后,为探究PLD 表达的最佳IPTG 浓度,设置IPTG 浓度为0.05~1.50 mmol·L-1。图2(c)表明,0.3 mmol·L-1的IPTG 可获得最佳PLD 酶活。当IPTG 浓度超过0.4 mmol·L-1时,随着浓度的升高,酶活反而降低,这可能是由于浓度过高导致PLD 形成没有活性的包涵体,且过高浓度的IPTG 对细胞具有毒害作用,影响细胞生长,从而降低酶活。
2.3 诱导时长对酶活的影响
图3 展示了不同PLD 表达菌株的诱导时长与PLD 水解酶活的关系。随着诱导时长的增加,PLD 水解酶活不断升高。当诱导达8 h 时,胞内表达菌株BL-PLD 的水解酶活最高,为0.35 U·mL-1;分泌表达菌株中的PLD-PelB 水解酶活次之,为0.23 U·mL-1;表面展示菌株PLD-EhaA 的水解酶活较低,为0.11 U·mL-1。这可能是由于胞内表达菌株和分泌表达菌株的细胞经超声破碎后,粗酶液中的PLD与底物PC 的接触更加充分,故在检测酶活的较短时间内,其水解酶活较全细胞的PLD-EhaA 更高。
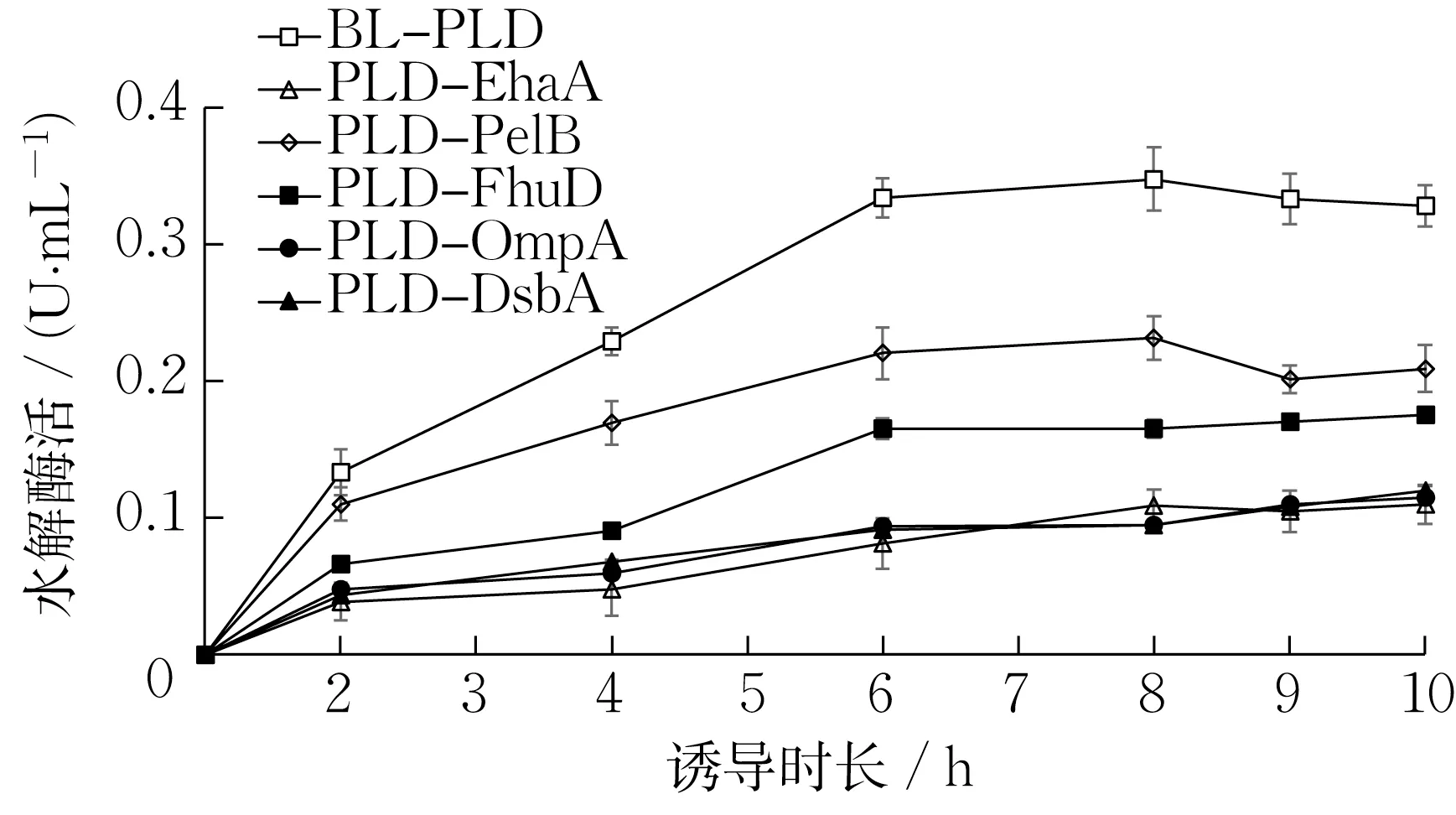
图3 诱导时长对PLD 水解酶活的影响Fig.3 Effect of induction time on PLD hydrolysis activity
在分泌表达菌株中,PLD-PelB的水解酶活最高;其次是PLD-FhuD,其酶活为0.17 U·mL-1;PLDOmpA 和PLD-DsbA 的酶活均在0.10 U·mL-1左右。所以,选择PelB信号肽做进一步研究。
总之,在PLD 的N 端连接信号肽后,其酶活反而比未连接信号肽的菌株更低。这与MISHIMA等[28]的研究结果类似,由于PLD 蛋白被信号肽转移至周质空间后不断积累,可能对宿主细胞有害,也可能导致质粒不稳定甚至丢失,从而降低酶活。
收集诱导表达PLD 8 h 的大肠杆菌细胞,用扫描电镜观察3 种方式下大肠杆菌细胞的形态变化,如图4 所示。无质粒的对照菌株细胞结构完整,呈短杆状,两端钝圆形,如图4(a)所示。在3 种表达方式下大肠杆菌细胞结构均受到一定程度的破坏,如出现不同程度的变形、断裂、塌陷等,有的细胞表面形成孔洞,有的细胞裂解出内容物,如图4(b)~(d)所示。其中,分泌表达菌株PLD-PelB 的细胞变形塌陷情况最为严重。与对照菌株相比,分泌表达菌株和胞内表达菌株的细胞表面更光滑。此外,表达PLD 蛋白之后的细胞更长,这可能是由于PLD 会影响细胞的有丝分裂,促进细胞增殖[29]。

图4 大肠杆菌的扫描电镜结果Fig.4 Scanning electron microscope images of E.coli.
综上,诱导PLD 表达的最佳条件为温度20 ℃,OD600=0.7,IPTG 浓度0.3 mmol·L-1,诱导时长8 h。
2.4 PLD 转酰基反应合成PS
2.4.1 反应介质对酶促合成PS 产率的影响
菌株BL-PLD 诱导8 h 后,以1 mL 发酵液破碎后的粗酶液为催化剂,在40 ℃下反应12 h 制备PS。比较了纯水相和两相体系的PS 产率,如图5(a)所示。在纯水相体系中,PS 产率仅为13.71%,是两相体系中PS 产率的40%。这是因为在PLD 与底物PC 反应过程中,存在生成磷脂酸的副反应,而纯水相体系会促进磷脂酸的生成[30],导致PS 产率下降。故选择用两相体系制备PS。
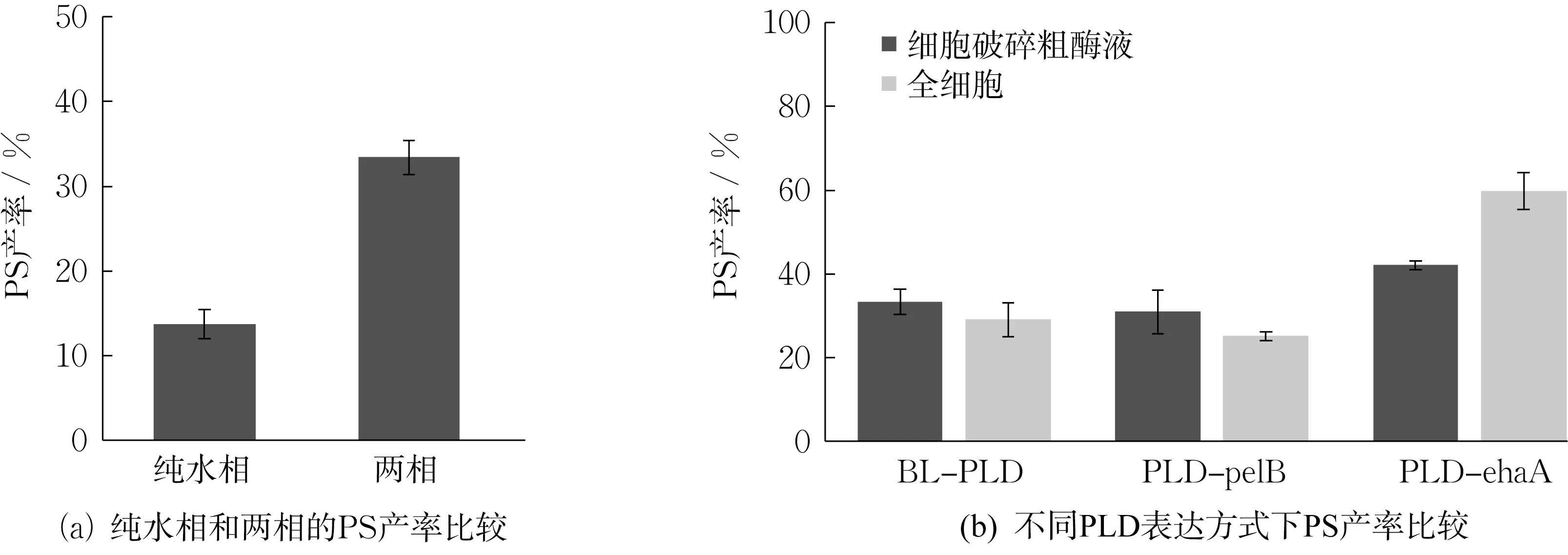
图5 PS 产率液相检测结果Fig.5 HPLC analysis of PS yield
2.4.2 不同PLD 表达方式对PS 产率的影响
为进一步获取PLD-EhaA、PLD-PelB 和BLPLD 3 种菌株的PS 产率,在诱导8 h 后离心收集菌体,按1 g 细胞加15 mL 缓冲液的比例,分别添加对应体积的Tris-HCl(pH 8.0)缓冲液,重悬菌体,取1 mL 细胞悬液催化PC;另取1 mL 超声破碎粗酶液催化PC,结果如图5(b)所示。可知,无论是使用粗酶液还是全细胞催化PC,PLD-EhaA 的PS 产率均较高,其中全细胞催化的PS 产率可达59.1%;PLDPelB 和BL-PLD 的PS 产率均在30%左右。
对于PLD-PelB 和BL-PLD 菌株,细胞经超声破碎后,PLD 粗酶液与底物PC 接触更加充分,反应效率更高,故粗酶液催化的PS 产率比全细胞催化高。在两相体系反应前期,可能粗酶液催化底物PC产生PS 的速率较快,但在反应后期,有机溶剂影响了酶的结构,进而影响PLD 酶活[31]。故反应12 h后,粗酶液催化与全细胞催化PS 产率相差不大。
对于PLD-EhaA 菌株,大肠杆菌细胞通过EhaA 转运蛋白,将PLD 转移至细胞外膜。全细胞催化PC 能避免有机溶剂与酶液直接接触,从而保持PLD 酶活。故PLD-EhaA 菌株全细胞催化PC的PS 产率较细胞破碎粗酶液催化的高。
在大肠杆菌细胞表面展示PLD 的优势在于,大肠杆菌产生的酶被连接并固定在细胞表面,避免了费时费力且昂贵的酶分离纯化步骤[32],且底物或产物均不需穿过细胞膜屏障[33],大大降低了传质阻力。此外,PLD 表面展示方式还可用于PLD 固化,更适合规模化制备PS。总之,PLD 表面展示是降低生物催化转化过程成本的一种非常有效的方法。
3 结论
利用大肠杆菌表达系统,研究了胞内表达、分泌表达和表面展示3 种方式对PLD 酶活及其磷脂酰丝氨酸(phosphatidylserine,PS)催化合成效率的影响。结果表明,大肠杆菌表达PLD 的最佳诱导条件为温度20 ℃,OD600=0.7,IPTG 浓度0.3 mmol·L-1。在最适条件下,3 种方式的PLD 水解酶活均在诱导表达8 h 时达最高值,分别为0.35,0.23,0.11 U·mL-1。进一步比较了胞内表达菌株、分泌表达菌株以及表面展示菌株的PS 产率,结果表明,在水-乙酸乙酯两相体系中,PLD 表面展示菌株的PS 产率最高,为59.1%。采用自转运蛋白EhaA 对PLD 进行表面展示,用全细胞催化底物,后期不需要对蛋白进行分离纯化,大大降低了底物或产物穿过细胞膜屏障的传质阻力。研究对工业化利用大肠杆菌生产PS 具有一定的指导意义。

