产肠毒素脆弱拟杆菌在结直肠癌中致病机制和治疗策略研究进展
王芳芳,黄亚辉,王孝清,盛春泉,刘娜*(. 海军军医大学,上海 00433;. 福建中医药大学,福州 350)
据统计,全球每年约有90万人死于结直肠癌(colorectal cancer,CRC),CRC已成为全球第三大常见恶性肿瘤和第二大致命癌症[1]。虽然科研人员已经进行了广泛的研究,但CRC的致病机制仍未完全阐明。由于高通量测序等科学技术的进步,肠道微生物群失衡被认为和CRC的发病机制相关[2]。微生物群是指存在于特定环境中的微生物的集合,包括细菌、古细菌、病毒(噬菌体和真核病毒)、真菌、单细胞原生动物和蠕虫[3]。人体健康虽然与我们自身的基因组密切相关,但是很大程度上依然与生活在我们体内的微生物有关[4]。在人体中,胃肠道是微生物最易富集的部位,大约含有3×1013个细菌,其中大多数是共生菌[5]。肠道微生物通常分为有益微生物和有害微生物:有益微生物在肠道内为人体提供营养物质和预防疾病发生,而有害微生物在肠道内定植会产生毒素和致癌物质[6]。肠道内细菌主要由拟杆菌门、厚壁菌门、放线菌门、变形菌门和瘤胃球菌科等组成,此外还包括少量的梭状芽孢杆菌[7]。肠道内定植的细菌中,拟杆菌门的产肠毒素脆弱拟杆菌尤其引人关注且被发现参与CRC的发生发展。
1 脆弱拟杆菌(Bacteroides fragilis,B. fragilis)
拟杆菌门为无芽孢、专性厌氧的革兰氏阴性菌。拟杆菌门种类繁多,超过20多种,这些细菌在人体肠道中通常扮演健康菌群的角色,维持着肠道菌群平衡。脆弱拟杆菌隶属于拟杆菌门,属于条件致病菌,分为非产肠毒素脆弱拟杆菌(nontoxigenicBacteroides fragilis,NTBF)和产肠毒素脆弱拟杆菌 (enterotoxigenicBacteroides fragilis,ETBF)[8]。NTBF与ETBF的不同之处在于是否能够产生脆弱拟杆菌毒素(Bacteroides fragilisenterotoxin,BFT)。BFT是ETBF的毒力因子,共有BFT-1、BFT-2 和BFT-3 三种基因型。BFT是一种20 kDa锌依赖型金属蛋白酶,也被称为Fragilysin[9]。BFT作为一种无活性酶原,由一个N前端结构域、一个柔性连接体和一个C端催化结构域组成[10],通过一种被称为fragipain(Fpn)的肽酶裂解其柔性连接蛋白中的精氨酸位点而被激活[10-12]。Fpn是一种C11家族半胱氨酸蛋白酶,通过去除BFT前端结构域而直接激活脆弱拟杆菌细胞中的BFT。BFT通过破坏细胞间紧密连接和增加肠黏膜通透性而导致肠道炎症和组织损伤[9],进一步研究发现,肠道炎症和组织损伤会促进CRC的形成[13]。
2 ETBF促进CRC发生的作用机制
ETBF可通过以下几种途径促进CRC的发生:① 诱导炎症反应;② 降解E-钙黏蛋白(E-cadherin)刺激细胞增殖;③ 激活转录激活因子3(STAT3)通路;④ 促进调节性T细胞(Treg)和辅助性T细胞17(Th17)累积;⑤ 参与CRC相关的多种信号通路;⑥ 形成生物膜(见图1)。
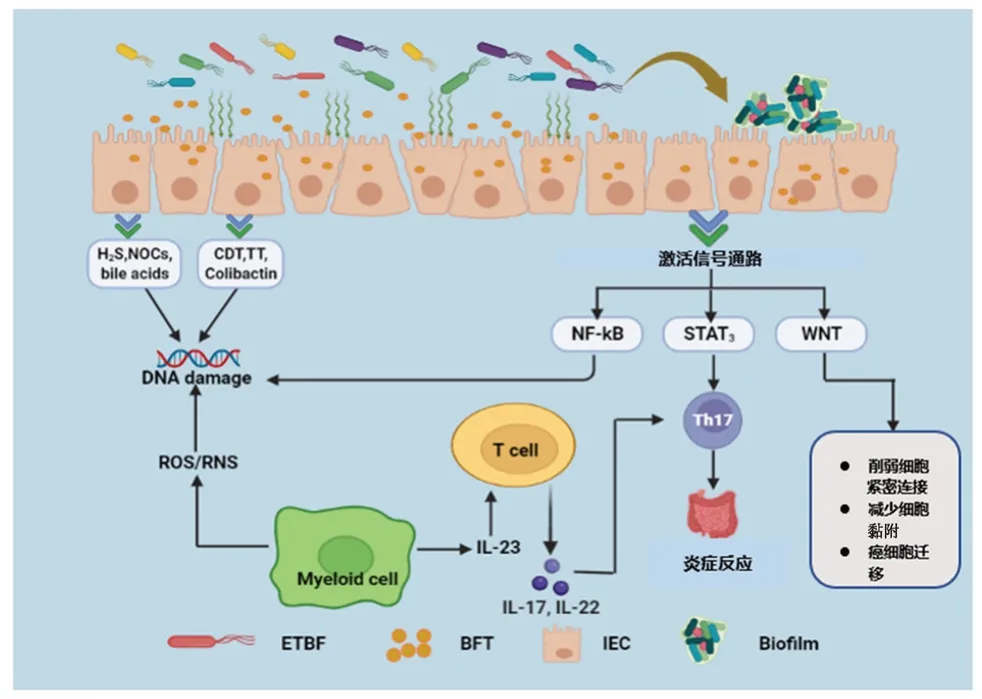
图1 ETBF与结直肠癌相关作用机制图Fig 1 ETBF associated mechanism in colorectal cancer
2.1 ETBF诱导炎症反应
正常情况下,肠道黏膜屏障由一层紧密连接的肠上皮细胞组成并将肠道菌群与免疫细胞隔离开来[14]。在人体和CRC小鼠模型中,肠黏膜屏障具有高渗透性[15]。ETBF产生的BFT,会降解结肠上皮细胞上的E-cadherin,从而破坏结肠黏膜屏障[16]。ETBF还通过分泌颗粒刺激结肠上皮细胞产生外泌体样纳米颗粒,这些颗粒含有高水平的C-C类趋化因子20和前列腺素E2,是Th17细胞募集和IL-17信号增殖转化所必需的[17]。ETBF还会与宿主免疫系统相互作用,进而发展为慢性炎症,导致肿瘤发生[18]。导致CRC发展的主要环境风险因素之一是慢性肠道炎症,慢性炎症会改变细胞微环境,促使基因突变,抑制细胞凋亡,诱导血管新生和细胞增殖产生癌前病变,最终导致癌症[19]。在肿瘤发展过程中,肿瘤细胞和ETBF相互作用,产生基因和炎症免疫因子,这些因子影响肿瘤细胞的存活和增殖[20]。
2.2 ETBF通过降解E-cadherin刺激细胞增殖
除了炎症反应,BFT还会通过降解E-cadherin改变结肠上皮细胞的结构和功能[21]。E-cadherin是一种120 kDa跨膜糖蛋白,是黏着带的主要结构蛋白,也被认为是肿瘤抑制因子黏着带蛋白。正常情况下,E-cadherin的表达与细胞凋亡以及同型细胞之间黏附等细胞功能相关[22]。然而,当E-cadherin与肠上皮细胞中的BFT相互作用时,它以一种不依赖三磷酸腺苷(ATP)的方式迅速降解E-cadherin。这种降解会导致结肠损伤加重,进而导致细胞形态学改变和细胞转移能力增强。同时,E-cadherin的降解也促进了β-连环蛋白(β-catenin)和依赖T细胞因子的转录激活因子的核定位结合[23-25],这种结合促进了基因调控与转录。此外,β-catenin在WNT信号通路中通过促进细胞增殖和上皮-间充质转化,在增强原癌基因表达中发挥重要作用[21,26]。
2.3 ETBF激活STAT3通路
ETBF引发的慢性炎症导致基因改变直接影响STAT3通路并促进癌变[27]。ETBF能够在结肠上皮细胞和结肠细胞中通过磷酸化和核易位迅速激活黏膜免疫细胞中的STAT3。而要激活免疫细胞中的STAT3,上皮细胞要响应产生的细胞因子,如白细胞介素(IL)-6、IL-10和IL-23。除了细胞因子,生长因子如血管内皮生长因子(VEGF)和碱性成纤维细胞生长因子(FGF-2)也参与了STAT3的激活。当ETBF与结肠上皮细胞相互作用时,它们将刺激结肠黏膜免疫细胞中STAT3的早期激活。这种STAT3激活持续缓慢上升,直到达到峰值水平,此时意味着ETBF激活了免疫系统[28]。在ETBF诱发的结肠炎中,由于激活了结肠黏膜中的STAT3通路和Th17细胞免疫应答,因此诱发了原癌性炎症反应并增加了肠黏膜的渗透性[28]。虽然STAT3激活是长期的,可持续数月,但它会极大地增加慢性炎症引起肿瘤的概率。此外,STAT3激活会促进肿瘤Treg的积累,并阻止产生抗肿瘤免疫反应,对身体产生不利影响。这种异常持续的STAT3激活增加了肿瘤细胞的耐受性,阻止了免疫系统的排斥反应,降低了免疫治疗的有效性,增强了肿瘤发生的可能性[29]。
2.4 ETBF促进Treg和Th17细胞的累积
在正常状态下,Treg通过高度表达IL-2受体并产生内源性IL-2来抑制IL-17的产生,因而在炎症反应和肠道免疫调节中发挥重要作用。然而,当ETBF定植在结肠中某个特定的部位时,产生的BFT会激活STAT3通路并诱发结肠炎从而破坏肠道黏膜。同时还会导致Treg与ETBF直接接触从而促进Treg的激活,激活后的Treg缺乏产生内源性IL-2的能力[30]。一旦Treg不能产生内源性IL-2,它只能通过消耗外源性IL-2来维持生存,Treg对外源性IL-2的消耗降低了外源性IL-2的水平,这就产生了有利于Th17细胞生长的微环境。这表明ETBF在肠道内定植促进了Treg和Th17细胞的累积,Th17细胞开始产生大量的肿瘤坏死因子-α(TNF-α)和IL-17等炎症细胞因子,这些细胞因子在组织损伤时促进细胞生长和增殖,进而引发慢性炎症。由致病性Th17细胞产生的IL-17不仅参与组织损伤的早期炎症反应,而且还会促进肿瘤细胞存活和增殖、肿瘤新生血管形成和转移,从而导致癌变[31]。同时IL-17可通过IL-6间接激活STAT3通路[28]。由此可见,当ETBF在肠道内定植时,STAT3通路激活与Treg细胞累积都与CRC发生相关。
2.5 ETBF参与CRC多种信号通路(NF-κB、WNT、MAPK)
ETBF产生的BFT参与了结肠上皮细胞的多种信号通路。当BFT激活这些信号通路时,它会给身体带来不利影响,并可能导致CRC发生。结肠上皮细胞信号转导可激活NF-κB、WNT和MAPK等多种信号通路[32]。BFT通过激活血红素加氧酶-1 (HO-1)表达的肠上皮细胞NF-κB通路而导致肠黏膜产生炎症,该通路可以防止肿瘤细胞凋亡,增强肿瘤细胞存活能力,从而导致肿瘤的发生[33]。此外,当结肠上皮细胞内的NF-κB通路长期被激活时,就会导致一氧化氮合酶活性增强而分解L-精氨酸产生一氧化氮[34]。WNT信号通路是维持结肠上皮细胞结构的重要途径,因此WNT信号通路对于CRC的发生和进展是极其重要的[35]。随着WNT信号通路被激活,它会削弱细胞间紧密连接,减少细胞黏附,因而使肿瘤细胞得以迁徙和转移到其他器官[36]。基质金属蛋白酶是锌依赖性蛋白酶,在控制肠道屏障中的基膜及细胞外基质的合成和降解起到重要作用[37]。通过处理非基质生物活性物质来修饰趋化因子或生长因子相关的基质,以及调节其他蛋白酶的活性[38]。基质金属蛋白酶-7(MMP-7)的分泌与肿瘤转移和炎症相关[39]。NF-κB和激活因子-1(AP-1)等转录因子可调节MMP-7的表达[40]。有研究发现,BFT刺激结肠上皮细胞可诱导MMP-7激活NF-κB和AP-1等转录因子,丝裂原激活蛋白激酶(MAPKs)信号通路对于MMP-7诱导至关重要[41]。
2.6 ETBF形成的生物膜在CRC中的作用
CRC发生的风险因素有很多,包括家族史、年龄、性别、个人病史、吸烟、饮食(红肉)、肥胖、酗酒和炎症性肠病等。然而,最近的研究也发现了一种新的危险因素,即细菌生物膜的形成,也被证实与CRC的进展相关[42]。结肠上皮增生的增加导致微生物群落关系的改变,从而改变微生物的组成和活性,进而导致生物膜的形成[43]。生物膜的形成是细菌黏附和生长所必需的,它伴随着细胞外聚合物和黏附基质的产生而产生,这将导致细菌生长和基因表达的变化。而这些微生物形成的生物膜作为前致癌炎症反应的触发器,有可能最终发展成CRC[44]。生物膜会导致结肠上皮细胞E-cadherin的重新分布,增加肠道通透性,导致肠道屏障功能丧失,从而加剧肠道失调,同时生物膜的形成也降低了细菌对辐射和抗菌药物的敏感性[45]。
与健康人相比,CRC患者结肠组织样本中产生的生物膜更为常见。有一种理论认为,生物膜承载着不同种类的细菌,而不是入侵微生物的单一变种,并可能导致炎症反应的增加和具有遗传毒性的细菌源衍生物的产生。无论是健康个体还是CRC患者,肠道微生物群形成的生物膜都与促癌生物学变化一致,即结肠上皮增生增加,IL-6、STAT3激活增加,多胺增加,E-cadherin减少[46]。而多胺代谢物水平的增加被认为协同促进生物膜的形成和细胞增殖,为结肠细胞的致癌转化的创造有利条件[46]。此外,改变结肠黏膜的渗透性和细胞代谢也会导致肿瘤微环境的变化。另一方面,在家族性腺瘤性息肉病患者中也发现了生物膜存在,这些患者遗传了突变的APC基因,作为“腺瘤-癌序列”[47]的早期阶段,由于息肉和腺瘤的形成,极易发展成CRC。
3 靶向ETBF药物治疗策略
CRC的常规治疗手段包括化疗和手术,两者都有可能导致严重的并发症。手术具有侵入性、死亡率高;化疗容易产生耐药性、细胞毒性和其他不良反应。ETBF被认为是导致CRC癌变的关键病原体,而开发靶向这些关键病原体的药物可以减少不良反应或增强现有CRC化疗方案的疗效,成为一种实用的辅助策略。本文将对几种作用于ETBF药物进行简要回顾,包括抗菌药物、天然产物、抗炎药物、益生菌类等。
3.1 抗菌药物
临床上用来治疗ETBF感染的常用抗菌药物有青霉素类(如苄青霉素)、头孢菌素类、喹诺酮类(如诺氟沙星)、克林霉素和甲硝唑等药物。然而,近年来不断有抗菌药物耐药的相关报道,且耐药率呈逐步升高趋势。同时细菌形成的生物膜也会导致其对抗菌药物的耐药性增加,迄今为止,还没有一种抗菌药物被证明可以有效治疗细菌生物膜相关感染。抗菌药物如多黏菌素、亚胺培南的研究表明,它们不能完全消除生物膜,而只是减少生物膜的产生[48]。最近的研究也表明,广谱抗菌药物在包括CRC[8]在内的各种类型癌症患者中并不能产生良好的临床效果。生物膜会导致吞噬细胞和补体系统的激活减弱,从而保护致病菌不受宿主免疫系统的影响,使其对常规抗菌药物的耐药性增加约1000倍[49]。细菌在生物膜中的代谢状态和有限的供氧也是导致其对抗菌药物产生耐药性的可能因素[50]。Jeyaraj等[51]发现,当给予致死浓度的抗菌药物时含有生物膜的细胞比浮游细胞的突变率更高,从而增加了抗菌药物耐药基因通过质粒转移的机会。虽然使用抗菌药物治疗可以杀灭ETBF等肠道致病菌,但是由于缺乏靶向性,抗菌药物的使用会破坏胃肠道生态系统的平衡性和导致耐药性的发生,使得CRC的临床治疗效果受到限制。
3.2 天然产物
天然产物由于化学结构的多样性及其已知的生物活性,已成为药物开发中十分具有潜力的候选药物。许多天然产物已被证明具有良好的抗菌和抗生物膜活性,最近报道的几种源自植物的天然产物显示了其对CRC相关病原体的抗菌作用。
3.2.1 花姜酮(zerumbone) 近年来有研究表明,花姜酮具有抗诱变、抗菌、抗癌变、抗炎等多种生物活性[52]。Kim等[53]研究发现,花姜酮对不同的脆弱拟杆菌菌株,包括野生型ETBF、BFT-2过表达的ETBF和NTBF,均具有抗菌活性。研究证实花姜酮不仅可以抑制生物膜的形成,而且能够根除已形成的生物膜。同时花姜酮对含有毒性BFT-2基因的脆弱拟杆菌菌株的生物膜形成的抑制作用比非产肠毒素菌株更有效。此外,花姜酮的抗菌膜活性可能是通过下调与生物膜形成相关的外排泵基因(bmeB12)而诱导的[53]。以上结果表明,花姜酮可作为一种抗生物膜和抗菌剂,用于治疗和预防ETBF引起的生物膜相关感染,同时还是一种有效的免疫调节剂以及一种具有开发潜力的抗肿瘤药物。
3.2.2α-葎草烯(α-caryophyllene)α-葎草烯也显示了抑制ETBF生物膜形成的潜力[54]。α-葎草烯是一种倍半萜,存在于芳香植物包括薄荷、鼠尾草和生姜(姜科)的精油中[55]。有报道称α-葎草烯精油具有抗炎和抗菌作用[56-57]。与花姜酮类似,α-葎草烯也通过诱导RND型外排泵基因bmeB1和bmeB3的下调来发挥抗菌活性,导致ETBF的细胞膜破坏和生物膜形成的抑制[54]。此外,α-葎草烯在动物模型中表现出显著的抗炎活性,可减少组胺注射引起的水肿[56]。在卡拉胶注射的大鼠模型中,使用α-葎草烯全身治疗可以阻止TNF-α和IL-1β的产生[56]。
3.2.3 小檗碱(berberine) Chen等[58]对小檗碱预防结直肠腺瘤复发的一项多中心、随机、双盲研究发现小檗碱可以降低息肉切除术后患者结肠腺瘤和息肉样病变复发的风险。小檗碱的低成本和安全性展现了它在预防CRC方面的潜力。小檗碱(最初从中草药黄连中提取)在中国已经使用了几个世纪,用于治疗腹泻和肠炎。小檗碱的抗肿瘤活性在动物实验中也有报道,它可以调节肿瘤微环境,阻断肿瘤发生相关通路的激活,此外,研究也证实小檗碱可以通过改变微生物群的组成来预防小鼠大肠癌的发生。
3.3 抗炎药物
金诺芬(auranofin)是一种金属盐,已获得美国食品和药品监督管理局(FDA)批准作为治疗类风湿关节炎的药物。同时它还具有抑制肠道细菌(如ETBF)生长的作用,有可能作为一种抗肿瘤药物而被重新使用。对类似于金诺芬等已批准药物的重新使用,可以节省开发和测试新药所需的时间和费用,同时其安全性也得到了广泛的验证[59]。一项研究表明,金诺芬对p53为零的卵巢癌SKOV3细胞系具有抗肿瘤活性[60]。Jang等[59]研究了金诺芬对ETBF的抗菌和抗生物膜作用,证实了用相对较低浓度的金诺芬对ETBF有很好的抑制和根除细菌生物膜作用。经金诺芬治疗后,外膜蛋白(OmpA)基因和外排泵相关基因bmeB3的表达显著降低。后续研究需要进一步在体内模型中验证金诺芬抑制ETBF的作用机制。
3.4 益生菌
益生菌被认为是无致病性的安全菌株,通过维持肠道微生物平衡而起到促进健康的作用,常被作为活补剂使用[60]。益生菌在治疗微生物感染,促进人类健康,并在预防抗菌药物相关的腹泻、早产儿坏死性小肠结肠炎,治疗婴儿结肠绞痛、牙周病以及诱导或维持溃疡性结肠炎缓解等方面表现出良好的应用前景[61]。不同益生菌混合物对产生生物膜的肠菌病原体(包括ETBF和产肠毒素的大肠埃希菌)都有抗菌膜特性[62-63]。Shin等[62]最近研究了益生菌丁酸梭菌NCTC 7423上清液对ETBF基因表达和生物膜形成的影响。丁酸梭菌对ETBF的生长表现出拮抗作用,丁酸梭菌的细菌定植因子(CFs)还抑制了生物膜的成熟,使已形成的生物膜被破坏,降低了生物膜中细胞的代谢活性[62]。
益生菌产生多种拮抗化合物,包括胞外多糖[64]、细菌素[64]和生物表面活性剂[65],这些拮抗化合物可以干扰生物膜的附着和形成,以及分解成熟的生物膜。此外,益生菌能够改变肠道pH值,从而与致病菌竞争营养物质[66]。益生菌在进入宿主体内后,除与病原体直接相互作用外,还可以通过与免疫系统相互作用发挥免疫调节作用。研究表明,益生菌和其产生的可溶性因子可通过Toll样受体识别调节和激活特异性免疫细胞,释放细胞因子,从而产生免疫调节作用[67]。有研究报道联合补充ω-3脂肪酸和微生物细胞制剂可以改善CRC患者化疗的生活质量,减少炎症生物标志物(如IL-6、TNF-α)水平,缓解化疗产生的不良反应[68]。在结肠癌患者肿瘤组织和附近的黏膜中有明显的微生物群存在,经过益生菌干预后,患者粪便中具核梭杆菌和ETBF含量显著降低[69]。目前,益生菌的摄入在一些临床试验中显示出了良好的结果,被认为是一种可行的通过调节肠道微生物群来预防CRC的方法。
4 总结和展望
随着CRC发病率逐年升高,ETBF作为导致CRC发生的关键病原体,正成为近年来研究的热点,而开发靶向这些关键病原体的药物将为CRC的治疗开辟新的方向。本文通过对ETBF的致病机制和靶向治疗药物进行简要回顾,发现研发新的CRC针对性治疗药物迫在眉睫,而开发靶向肠道微生物相关药物将成为一种潜在的预防和治疗CRC的方法。结直肠特殊的生理位置,胃肠道的生理复杂性,结肠生物利用度以及干预的特定部位靶向能力等问题都为开发抗CRC药物增加了难度。对定植于胃肠道中的具有致病性的ETBF等微生物进行针对性的干预,不仅可以消除特定的致病微生物,同时也可以最大限度地降低对胃肠道生态系统的破坏。开发靶向肠道致病菌相关药物,将为优化精准治疗方案,提高患者生存率提供可能。微生物学和肿瘤学领域未来的挑战将包括开发快速和经济有效的肠道微生物群失调诊断方法,以及阐明致病菌对CRC的生物效应和作用机制。

